尿酸酶突变体的高通量筛选方法
2015-12-29廖娟,刘红博,高昂等
·生命科学·
尿酸酶突变体的高通量筛选方法
廖娟1,刘红博2,高昂2,杨晓兰2,李元丽2,廖飞2
(1.重庆医科大学 附属永川医院中心实验室,重庆402160;2.重庆医科大学 检验医学院临床检验诊断学教育部重点实验室,重庆400016)
摘要:建立一种尿酸酶突变体的高通量筛选方法。将野生型苛求芽孢杆菌尿酸酶及其突变体的表达载体转入大肠杆菌,每个克隆诱导培养后超声裂解上清液为样品,全自动酶标仪测定293 nm光吸收,并分析反应启动后8~28 min的数据计算酶活性,Bradford法测定总蛋白; ROC比较用酶活性或比活性识别阳性突变体的可靠性。任2种突变体酶活性或比活性比值>2时,ROC分析曲线下面积接近1;当酶活性或比活性仅增加50%时,分析比活性所得曲线下面积比分析酶活性更大,将ROC分析比活性提高近1倍。突变体敏感度达90%时,比活性为判断阳性突变体阈值,其相当于以起始物比活性均值加1.7倍标准差;此阈值能用于高通量筛选变体库中比活性增加1倍以上的阳性突变体。
关键词:尿酸酶;比活性;阳性突变体;通用阈值
收稿日期:2014-10-21
基金项目:国家自然科学基金资助项目(30672009);教育部新世纪优秀人才支持计划基金资助项目(NCET-09-0928),重庆市科委重点基金资助项目(CSTC2011BA5039)
作者简介:廖娟,女,重庆市人,从事体外诊断与药物筛选生物技术研究。
中图分类号:Q55
A high-throughput method for recognizing Uricase
mutants of higher activity
LIAO Juan1, LIU Hong-bo2, GAO Ang2,YANG Xiao-lang2, LI Yuan-li2, LIAO Fei2
(1.Central Laboratory, of Yongchuan Hospital , Chongqing Medical University, Chongqing 402160, China;
2.Key Laboratory of Clinical Laboratory Diagnostics of the Education Ministry, College of Laboratory Medicine,
Chongqing Medical University, Chongqing 400016, China)
Abstract:Using an automatic microplate reader, a high-throughput screening method was developed to recognize uricase mutants of higher activity. The expression vectors of wildtype uricase and its three mutants were used to transform Escherichia coli cells separately. After lysis of cells via ultrasonic treatment, crude enzymes in lysates served as samples to measure activity. Uricase activity was estimated by analyzing absorbance at 293 nm from 8 min to 28 min since reaction initiation. The concentrations of total protein in a lysate were determined by the Bradford assay. Uricase activity or specific activity was compared against a threshold to recognize a mutant of higher activity. The reliability of activity and specific activity for recognizing positive mutants were evaluated by Receiver-operation-curve (ROC). Any uricase mutant with> 200% improvement of activity yielded area-under-the-curve (AUC) close to 1.00. For a mutant with about 50% improvement of activity, ROC analysis of specific activity gave AUC close to 1.00 while the analysis of activity gave smaller AUC. The threshold was determined by fixing the sensitivity at 90% in ROC and expressed as the mean plus 1.7-fold standard deviation of specific activity of the starting material. A uricase mutant with>100% improvement of specific activity could be efficiently recognized as a positive candidate by the high-throughput method.
Key words: Uricase; specific activity; positive mutants; universal threshold
人体无尿酸酶,体内嘌呤代谢终产物为尿酸,其主要经肾脏排泄;体内尿酸生成过快或肾脏排泄受阻都会造成尿酸累积,并导致痛风或肿瘤融解综合征。外源尿酸酶制剂静脉注射给药能清除体内血清尿酸且几乎无副作用,是临床治疗尿酸积累所致难治性痛风和肿瘤融解综合征的有效药物[1-4]。但长期连续注射外源蛋白制剂会诱发人体产生抗体而降低其疗效,甚至产生难以预计的毒副作用;新近上市的pegloticase连用两周后就易诱导产生特异性抗体[2,4]。提高尿酸酶催化能力以降低治疗剂量,从而减少/避免副作用是蛋白药物治疗应用的关键[5]。此外,尿酸酶是体外诊断血清尿酸含量的关键工具酶,其比活性越高则应用成本越低[6]。因此,获得高比活性尿酸酶是其应用于诊断和治疗领域的关键。
筛选进化生物技术建立的尿酸酶突变体库是获得高活性尿酸酶的有效策略,但需高通量方法快速、准确地测定酶活性或比活性,以及可靠识别高活性阳性突变体的方法。课题组所发现苛求芽孢杆菌尿酸酶序列已获发明专利授权,此尿酸酶有超强热稳定性,但对底物亲和力低且比活性较低,需进行分子改造以提高其应用价值[7-8]。本文以野生型苛求芽孢杆菌胞内尿酸酶及其3种突变体为模型,在全自动酶标仪上建立高通量测定尿酸酶活性和比活性的方法,并建立识别其阳性突变体的通用判断阈值,为筛选尿酸酶突变体库奠定基础。
1材料与方法
1.1试剂与仪器
光谱扫描多功能读数仪(Thermo Scientific Varioskan Flash,赛默飞世尔科技),超声破碎仪(JY92-Ⅱ,宁波新芝生物科技股份有限公司),96孔酶标板(BIO basic INC),纯水器(Classic UVF,法国威立雅),紫外分光光度计(TU-1810,北京普析通用仪器有限责任公司)均按照仪器使用手册要求进行操作。尿酸、牛血清白蛋白均购买于Sigma-Aldrich。考马斯亮蓝G250购于上海生工。超纯水18.2 MΩ·cm-1。苛求芽孢杆菌A.T.C.C. 29604野生型胞内尿酸酶的pET28a载体为课题组此前构建[7]。大肠杆菌细胞株BL21(DE3)来自上海生工。4种尿酸酶突变体按活性下降顺序命名为候选突变体A,B,C和D(表1,基因突变和这些突变体的表达载体构建委托北京泰和基因有限公司完成),具体序列见此前报道[9]。
1.2尿酸酶及其突变体的重组表达、纯化和活性测定
尿酸酶及其突变体的重组表达参照文献[7]。将尿酸酶对应pET28a载体转入大肠杆菌中(大肠杆菌无内源性尿酸酶);挑选阳性克隆转移到液体培养基中,37℃培养3 h后,18℃下加入终浓度为1.0 mmol/L的异丙基-β-D-半乳糖苷在18℃诱导尿酸酶表达16 h。收集菌体,150 W超声间隔2.5 s破碎2.0 min,10 000 r/min,离心10 min的上清液为细胞裂解液。各种尿酸酶突变体分别经DEAE-纤维素离子交换层析和制备型电泳纯化。在25℃用0.075 mmol/L尿酸在pH 9.2硼酸盐缓沖液中在全自动酶标仪上测定293 nm光吸收变化的初速度表示尿酸酶活性,按其摩尔消光系数11.5 (mmol/L)-1cm-1校正尿酸储备液的浓度[10]。尿酸溶液每天配制,使用前在(25±0.5)℃下预热20 min。尿酸酶反应体系共150 μL,含尿酸溶液50 μL,加入用50.0 mmol/L的硼酸缓冲液(pH 9.2)稀释的裂解液100 μL启动反应,间隔2.0或5.0 min测定293 nm光吸收变化,每份样品测定3次。用各突变体酶活性与其总蛋白浓度之比表示比活性。每分钟消耗1微摩尔尿酸的酶量为1单位。
1.3总蛋白测定
用牛血清白蛋白为参考,用Bradford法测定尿酸酶样品中的蛋白浓度[11]。硼酸缓冲液稀释裂解液8倍,反应体系共150 μL,尿酸酶溶液50 μL,考马斯亮蓝溶液100 μL,振荡10 min后检测595 nm光吸收。
1.4尿酸酶突变体的模拟筛选
在模拟筛选过程中所用4种尿酸酶同此前报道[9];这4种尿酸酶纯化后任两种尿酸酶活性比值在1.3~4.0倍间。每种尿酸酶突变体pET28a载体转化大肠杆菌BL21(DE3)感受态细胞,平板筛选30个阳性克隆;每个克隆分别转移到含1.0 mL选择性液体培养基的5.0 mL Ependorf 管中,37℃放大培养3 h;加入异丙基-β-D-半乳糖苷到终浓度为1.0 mmol/L,在18℃ 诱导表达16 h;离心收集滤渣洗涤,加50 mmol/L pH8.0 Tris-HCl缓沖液0.20 mL,冰浴超声裂解,离心后上清液为裂解液样品用于测定突变体酶活性。
1.5数据分析及尿酸酶阳性突变体的识别
用Microsoft Excel计算均值(χ)、标准差(s)、变异系数(CV)。用SPSS 17.0进行F检验和t检验比较各突变体的酶活性、比活性和总蛋白浓度。任选两种突变体为一对,催化效力低者为起始物,高者为阳性突变体。比较来自单个克隆的裂解液中尿酸酶活性或比活性均值判断阳性突变体。作受试品工作曲线(receiver-operation-curve,ROC),分析曲线下面积(area under curve,AUC)与酶催化效力比值的关系[12-13]。通过ROC分析得到满足设定灵敏度和特异性要求的判断阈值,以起始物的均值和标准差表示,用于测定裂解液中酶活性进行筛选。
2结果
2.1尿酸酶活性的高通量测定
测定80,130和180 μmol/L尿酸在293 nm光吸收(各浓度测定30次,重复测定7批次),其吸收分别为1.186±0.019,1.579±0.032和1.855±0.044,这些尿酸浓度均在吸收的有效测定范围内且精度相当。尿酸浓度越低,所测吸收受仪器噪声干扰越大。苛求芽孢杆菌尿酸酶对尿酸米氏常数高于200 μmol/L,测定其初速度要求尿酸消耗比例尽可能低,故需较高尿酸浓度才能获得较宽可测范围。因此,选用130 μmol/L尿酸测定活性。
在25 ℃下用130 μmol/L尿酸,分别以100,150,200,300倍稀释尿酸酶突变体A的裂解液启动反应,每隔2 min检测293 nm吸收,连续监测30 min。结果表明:①启动反应3 min后,稀释100,150,200和300倍裂解液的尿酸消耗量分别为11.8%,8.0%,7.4%,4.3%;②反应20 min后,4种稀释倍数样品使反应体系尿酸消耗分别为35%,27%,20%和15%;③稀释300和200倍裂解液在7~21 min内吸收线性下降,稀释100和150倍的裂解液在3~13 min内吸收线性下降。分析启动反应3 min后数据,发现5~20 min间的尿酸酶反应初速度对稀释200倍的突变体A的量呈线性响应(R2=0.989 6,n=5,图1b),对应初速度可测上限达到1.52 U/L。在130μmol/L尿酸时无尿酸酶作用30 min内吸收随机波动小于0.04,而方法检测下限为0,则此高通量测定系统对尿酸酶活性检测下限约为0.04 U/L;此高通量测定尿酸酶活性过程为:裂解液100 μL(稀释200倍),尿酸50 μL(终浓度为130 μmol/L),持续振荡3 min后,以5.0 min间隔连续监测20 min内293 nm吸收变化,以启动反应后8~28 min的数据计算初速度。

图1 尿酸酶活性测定(a,尿酸酶突变体A在不同稀释倍数下与130 μmol/L尿酸在293nm光吸收变化;b,尿酸酶突变体的加样量与酶初速度的线性关系) Fig.1 Assay of uricase activity with microplate reader
2.2阳性突变体的判断方法
从突变体库中筛选阳性突变体的灵敏度和特异性越高越好。这需识别阳性突变体的比较指标及其阈值,突变体酶活性指标大于此阈值即为阳性突变体。有限位点突变的突变体催化效力变化有限,从中筛选出催化效力增加1倍的阳性突变体是一个挑战。本文以催化效力比值在1.3~4.0的4种尿酸酶突变体组合为模型建立识别阳性突变体的判断阈值。
F检验发现4种突变体裂解液中总蛋白浓度无差异(P>0.05),而酶活性和比活性差异显著(P<0.05, 见表1)。当两种突变体的比活性比值大于1.50后,比较其比活性的AUC>0.9,P<0.05且都高于分析酶活性所得 (表2),说明高通量方法测定尿酸酶比活性用于识别其阳性突变体有一定优势[9]。可能因为候选突变体D表达效率偏低,使另外3种候选突变体与候选突变体D的比活性比值明显大于纯化后样品所得催化效力比值,但其余3种候选突变体之间比活性比值与纯化后测定催化效力比值差异较小。每对尿酸酶突变体间催化效力差异越大,ROC分析所得AUC越高。两种尿酸酶间催化效力大于3.0后,ROC分析尿酸酶活性或比活性所得AUC都接近1.00。无论分析酶活性还是比活性都无法完全识别催化效力比值小于2.0时阳性突变体,但两种尿酸酶突变体间催化效力接近或大于2.0后ROC分析比活性的AUC大于0.95。所以,高通量方法测定尿酸酶的初速度进行比较能用于识别催化效力提高接近1倍的阳性突变体,且以突变体的比活性作为识别阳性突变体灵敏度更高。
在筛选突变体库时需从裂解液所得酶活性判断其是否为阳性突变体。候选突变体A与C裂解液样品所得比活性比值与纯化后催化效力比值≥1.69且差异较小;两种突变体裂解液中尿酸酶比活性的变异系数一致(表1,2),故选A和C成对作ROC分析以确定识别阳性突变体的阈值[15]。用Youden 指数(Youden index,YI)最大、设定敏感度80%和90%确定识别二者中高比活性者为阳性突变体时所需比活性的阈值,分别为1.01,1.17和1.06 U/mg(表3和图3)。 在筛选突变体库时阈值较小会引入太多比活性较低的阳性突变体而增加筛选工作量;设定敏感度过低可能丢失阳性突变体。因此选择敏感度为90%对应最大特异度的比活性为阈值,即1.06 U/mg可作为识别A和C组合中的阳性突变体的阈值。参照畸异值识别方法,可将此阈值换算成以起始物比活性均值和标准差表示的参数作为识别阳性突变体的通用阈值;上述阈值就等同于突变体C为起始物的比活性均值+1.7倍起始物比活性标准差,可作为阳性突变体识别的阈值并有望通用于不同的起始物(表3)。
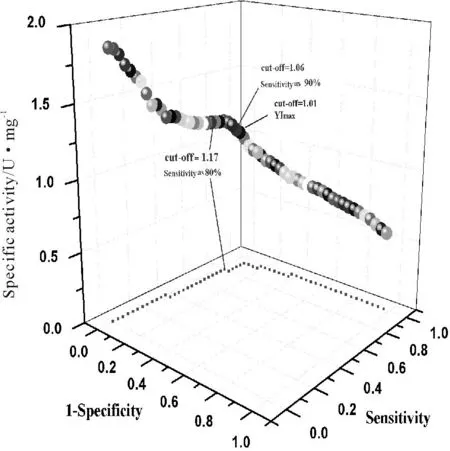
图2 ROC判断候选突变体A和C的阈值(n=30) Fig.2 ROC analysis of activities in lysates between uricase A and C (n=30)

突变体总蛋白浓度/mg·mL-1酶活性/U·mL-1比活性/U·mg-1χ±sCV(%)χ±sCV(%)χ±sCV(%)A0.22±0.0315.20.28±0.0516.41.30±0.2820.7B0.21±0.0313.90.24±0.0416.71.16±0.1411.8C0.22±0.0417.60.17±0.0425.20.77±0.1722.1D0.21±0.0522.70.04±0.0243.30.22±0.1565.3F0.859229.637191.147P0.4650.0000.000
用上述阈值,识别酶比活性之比大于1.7的A和C尿酸酶突变体组合中的阳性突变体的敏感度大于90%,特异度大于93%;识别突变体酶比活性之比大于4.6的尿酸酶中的阳性突变体,其敏感度和特异度都满足筛选要求;识别酶比活性比值为1.5尿酸酶中的阳性突变体,其敏感度接近80%,特异度大于93%,可见此阈值有通用性。

表2 ROC分析配对候选突变体的酶活性和比活性( n=30)

表3 识别尿酸酶突变体A和C阳性突变体的阈值( n=30)
3讨论
筛选酶突变体需高通量测定酶活性和准确识别阳性突变体的阈值。全自动酶标仪适合高通量测定酶活性。直接测定尿酸吸收跟踪尿酸酶反应过程计算尿酸酶初速度的效率最高。测定酶初速度时要求延迟时间内底物消耗量尽可能低,用于分析数据中底物消耗比例不能超过设定界限,且米氏常数越高,测定初速度所允许的最大底物消耗比例越低。苛求芽孢杆菌胞内尿酸酶米氏常数接近0.25 mmol/L,用尽可能高的尿酸浓度测定酶活性有助于提高识别高活性尿酸酶突变体的灵敏度,并允许较宽可测范围。但最大尿酸浓度受到仪器测量范围限制。故需优化底物浓度、反应时间和样品稀释比例建立高通量测定尿酸酶活性方法。

表4 尿酸酶候选突变体的特异度和敏感度
据裂解液中酶活性识别阳性突变体需要的阈值,酶活性大于此阈值即为阳性突变体;这种识别方法需尽可能高的灵敏度和特异性。在ROC分析中,各种可能cut-off值被尝试为阈值考察识别阳性突变体的特异性和敏感度。通过ROC分析确定阈值的常用方法包括[12-13]:①设定敏感度最低限对应的最大特异度处cut-off值为阈值,通常设定敏感度的最低限为80~90%;②Youden指数(Youden index,YI)最大的cut-off值为阈值,YI=敏感度-(1-特异度),即敏感度和特异度的和最大,以最靠左上角的截割点为判断参考范围。综合考虑,选择敏感度为90%对应最大特异度的比活性为判断阳性突变体的阈值。上述阈值等同于起始物C比活性均值+1.7倍起始物比活性的标准差;此阈值用于识别酶催化活力提高近1倍的尿酸酶阳性突变体时敏感度和特异度都能满足要求,可作为候选通用阈值。
参考文献:
[1]RICHETTE P, BARDIN T. Gout [J]. Lancet, 2010, 375(9711):318-328.
[2]SCHLESINGER N, YASOTHAN U, KIRKPATRICK P. Pegloticase [J]. Nature Reviews Drug Discovery, 2011, 10(1): 17-18.
[3]TERKELTAUB R. Update on gout: new therapeutic strategies and options [J]. Nature Reviews Rheumatology, 2010,6(1): 30-38.
[4]SHANNON J A, COLE S W. Pegloticase: a novel agent for treatment-refractory gout [J]. The Annals of Pharmacotherapy, 2012,46(3):368-76.
[5]YANG X, YUAN Y, ZHAN C G, et al. Uricases as therapeutic agents to treat refractory gout: Current states and future directions [J]. Drug Development Research, 2012, 73(2):66-72.
[6]ZHAO Y S, YANG X Y, LU W, et al. Uricase based methods for determination of uric acid in serum [J]. Microchim Acta, 2009, 164(1):1-6.
[7]ZHANG C, YANG X L, FENG J, et al. Effects of modification of amino groups with poly(ethylene glycol) on a recombinant uricase from Bacillus fastidiosus [J]. Bioscience, Biotechnology, and Biochemistry, 2010, 74(6):1298-1301.
[8]FENG J, LI X, YANG X L, et al. A new practical system for evaluating pharmacological properties of uricase as potential drug to handle hyperuricemia [J]. Archives of Pharmacal Research, 2010, 33(11):1761-1769.
[9]FENG J, LIU H B, YANG X L, et al. Comparison of activity indexes for recognizing enzyme mutants of higher activity with uricase as model [J]. Chem Cent J, 2013, 7(1):69.
[10]LIAO F, ZHU X Y, WANG Y M, et al, The comparison of the estimation of enzyme kinetic parameters by fitting reaction curve to the integrated Michaelis-Menten rate equations of different predictor variables [J]. Journal of Biochemical and Biophysical Methods, 2005, 62(1): 13-24.
[11]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(2): 248~254.
[12]ANTHONY K A. Understanding diagnostic tests 3: receiver operating characteristic curves [J]. Acta Paediatrica, 2007, 96(5):644-647.
[13]CERDA J, CIFUENTES L. Using ROC curves in clinical investigation: theoretical and practical issues [J]. Revista Chilena de Infectología, 2012, 29(2):138-141.
(编辑徐象平)

