不同血型个体混合细胞的免疫标识及DNA检验
2015-12-29
不同血型个体混合细胞的免疫标识及DNA检验
王清山1,2,李学博1,李红卫1,2
(1.山东政法学院山东省高校证据鉴识重点实验室,山东济南250014;2.重庆市公安局物证鉴定中心,重庆400021)
摘要:目的应用免疫技术标识不同ABO血型个体的上皮细胞,建立混合物证分离检验鉴定方法。方法取正常人体口腔上皮细胞,制备不同血型个体的混合口腔上皮细胞,经免疫组化染色,根据细胞膜的呈色差异,利用激光捕获显微切割目的细胞5个、10个、20个,所获样本进行多位点低体积复合扩增,扩增产物用ABI3130XL型DNA测序仪检测,GeneMapper ID software vs. 3.2软件分析,以获得13个以上STR分型为有效分型(各等位基因峰高大于50RFU)。结果根据免疫组化结果,可对ABO血型个体的混合细胞中的某单一血型细胞进行分离检验。DNA有效分型检出率随着切割回收细胞数的增加而提高,切割20个细胞时样本的DNA检出率达到90%以上。结论利用免疫标识技术可以分离不同ABO血型个体的上皮细胞,对混合样本的分离检验有重要价值。
关键词:法医遗传学;混合细胞;DNA;STR
混合细胞物证是较为常见的法医学生物检材,常见的为乳头拭子、阴茎拭子、饮料瓶口、烟蒂等,此类物证用常规方法提取和扩增,得到的结果多为混合图谱,达不到同一认定的要求。法医学工作者对混合图谱采取了多种分析方法,如钟摆系统法[1]、最小二乘法[2]、PE法[3]、峰面积分析法[4]及线性分析法[5]等,但图谱拆分操作复杂,且获得的结果难以确定某一个体的DNA分型,导致嫌疑人认定困难。A、B抗原不仅存在于红细胞膜上,也不同程度的分布在其他细胞表面和体液内,口腔上皮细胞在内的多种组织细胞存在ABH物质已被研究人员所熟知,甚至腐败、自溶的组织内亦可检测出来。本研究应用免疫技术标识不同ABO血型个体膜抗原的细胞,结合激光显微切割技术,实现了不同血型混合细胞的细胞分离检验的效果。现报道如下。
1 材料与方法
1.1材料与仪器
(1)实验用口腔上皮细胞:在知情同意的原则下,由本实验室30名成年志愿者(A、B、O血型个体各10名)提供口腔上皮细胞。漱口后用压舌板刮取口腔上皮细胞,PBS洗涤3次,经细胞计数板计数确定单位体积内细胞数量,稀释并配制成含有口腔上皮细胞104/mL个左右的悬液,4℃保存。另取志愿者的血样进行血型及STR分型检验。
(2)Anti-Blood Group A Antigen antibody(美国Abcam公司)。
(3)Anti-Blood Group B Antigen antibody(美国Abcam公司)。
(4)goat anti-mouse IgG-HRP(英国Abcam公司)。
(5)DAB显色试剂盒(北京康为世纪生物科技有限公司)。
(6)PCR反应液:ID-plus试剂盒,ABI. (7)高速冷冻离心机(德国eppendorf)。
(8)电热恒温箱(精宏实验设备有限公司)。(9)显微激光切割仪(德国ZEISS)。(10)低体积扩增系统(德国Advalytix AG)。(11)3130XL型遗传分析仪(美国AB公司)。
1.2方法
1.2.1 A、B抗原的稳定性及抗体特异性检验
(1)分别取上述制备好的上皮细胞悬液(4℃保存1 d及7 d)0.3 mL涂于粘附载玻片上,置于电热恒温箱内37℃烤干。
(2)将载玻片置于1% Triton-100溶液内透明15 min,PBS洗涤3次,每次5 min。
(3)将载玻片放入柠檬酸盐溶液中置于微波炉中煮沸15 min,取出置于室温待载玻片恢复到室温后用PBS洗涤3次,每次5 min。
(4)滴加0.5 mL山羊血清于载玻片细胞斑迹处,封闭15 min。向各组载玻片上分别滴加抗A抗体、抗B抗体及PBS缓冲液。37℃孵育1 h。PBS洗涤3次,每次5 min。
(5)加入辣根过氧化物酶标记山羊抗小鼠IgG,电热恒温箱内37℃孵育1 h,PBS洗涤3次,每次5 min。
(6)DAB染色2 min,去离子水洗涤1次。将载玻片放入苏木精染液中3 min,90%、100%酒精各1 min,晾干载玻片,显微镜下观察。
1.2.2不同血型混合口腔上皮细胞的免疫标识及DNA分离检验
(1)混合口腔上皮细胞的制备
取0.2 mL已知不同血型个体的口腔上皮细胞两两混合,制成A/B、A/O、B/O混合上皮细胞悬液各10份。
(2)不同血型混合口腔上皮细胞的免疫标识
①分别取上述制备的各组混合上皮细胞悬液0.4mL涂于粘附载玻片上,置于电热恒温箱内37℃烤干;
②、③操作同1.2.1步骤(2)、(3)。
④滴加0.5mL山羊血清于载玻片细胞斑迹处,封闭15min。向各组中分别加入抗A抗体、抗B抗体。37℃孵育1h。PBS洗涤3次,每次5 min。
⑤、⑥操作同1.2.1步骤(5)、(6)。
(3)不同血型个体混合细胞的显微激光切割捕获。
打开显微激光切割捕获仪操作软件,先在空白处聚焦,切割空白处,以检验激光强度、校正切割面积、切割次数。对准细胞膜呈棕色的细胞及未染棕色的细胞,分别切割回收5个、10个、20个。1.2.3 PCR-STR检验
志愿者血样用Chelex-100法提取DNA,应用Identifiler试剂盒及DNA TYPERR○21荧光复合扩增系统进行PCR扩增,切割回收的细胞利用低体积扩增系统进行Identifiler多位点复合扩增(重复扩增3次),扩增产物用3130XL型遗传分析仪电泳分离和激光扫描分析,应用GeneMapper ID software vs. 3.2软件分析。
以等位基因峰高大于50RFU,同一基因座出现该等位基因3次以上为有效数据,获得13个以上基因座正确分型为有效分型。STR正确分型检出率=有效分型次数/重复次数;等位基因丢失率=等位基因丢失条带总数/预计等位基因总条带;非特异扩增=出现非特异性扩增的基因座/(16×重复次数)。
2 结果
(1)按上述1.2.1操作步骤染色后,在显微镜随机视野内可见4℃保存1 d及7 d的口腔上皮细胞结构完整,已知血型的口腔上皮细胞与相应抗体结合后,镜下见核呈蓝色,细胞膜呈棕色;与其他抗体或PBS反应后,镜下见核呈蓝色,细胞膜未染色(见图1)。
(2)A/B、A/O、B/A、B/O四组混合口腔上皮细胞,分别加抗A、抗A、抗B、抗B抗体,按上述1.2.2操作步骤染色后,在随机视野内可见口腔上皮细胞结构完整,核呈蓝色,部分上皮细胞膜呈棕色,部分上皮细胞膜未染成棕色(见图2)。
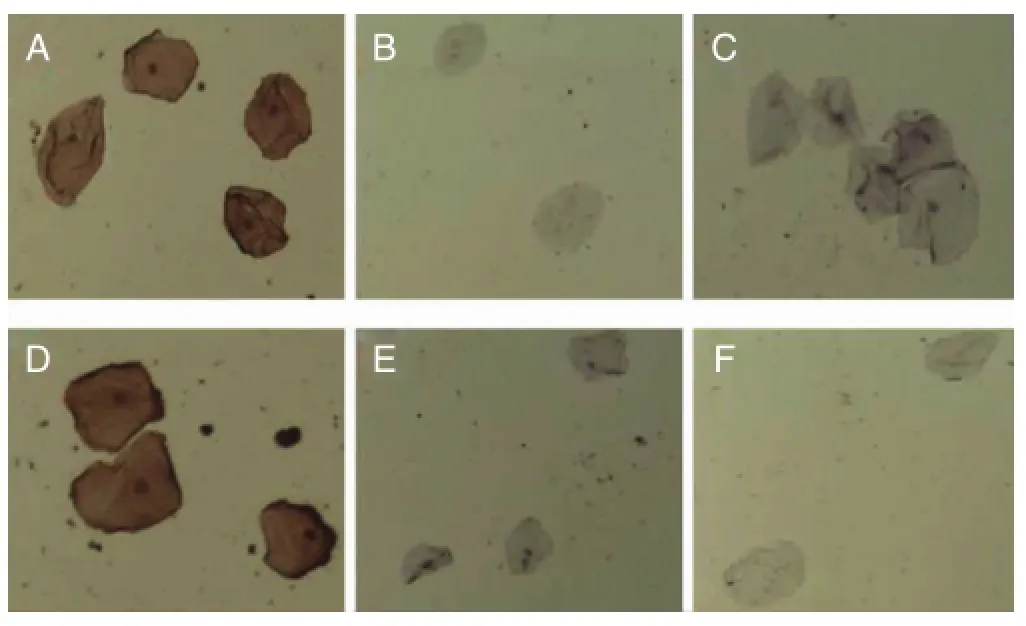
图1 口腔上皮细胞(4℃保存7d)免疫组化染色情况

图2 A型、B型混合上皮细胞(4℃保存7d)加抗A抗体
(3)激光捕获显微切割后经Lv-PCR扩增,电泳检测显示:各组棕色细胞DNA分型与该血型志愿者的分型相同。不同血型个体的细胞在5个、10个、20个细胞数量的检验结果显示,随着回收细胞数量的增多,STR正确分型检出率明显提高,等位基因丢失率及非特异扩增率也相应降低,10个细胞样本组的检出率达80%以上,20个细胞样本组的有效检出率达90%以上。经X2检验,P<0.05,说明不同细胞个数的DNA有效检出率的差别有统计学意义。具体结果(见表1)。
3 讨论
混合生物检材的DNA检验是法医检案的难题之一,近年来单细胞分离技术为混合样本检验提供了新的解决方案,有学者将荧光原位杂交技术(Fluorescence In Situ Hybridization,FISH)用于法医混合生物样品的检验,但该方法只局限于男女混合细胞的分离检验,且荧光原位杂交技术的反应条件对混合样本有一定的要求,轻微污染及陈旧的混合斑样本都可能导致检验失败[6-9]。
ABO血型系统是人类的重要遗传标记及最常用的血型分类方法之一,可将人群分为A型、B型、AB型和O型4个群体,在人群中分别占有一定的比例,并遵循遗传学规律遗传给后代。利用A、B抗原的存在情况可对不同血型个体来源的上皮细胞进行区分,这为混合细胞的特定分离及DNA检验提供了重要思路。本研究对4℃保存1 d及7 d的口腔上皮细胞进行免疫组化染色检验,发现细胞结构完整,细胞膜呈棕色,这一结果进一步证实上皮细胞膜AB物质是稳定存在的。LCM技术在国内外法医DNA检测中已经得到了广泛应用,如在混合斑精子细胞分离、流产组织中胎儿成分分离以及口腔细胞的分离检验中获得了良好效果[10-12]。本研究将免疫标识与LCM技术相结合,实现了不同血型口腔上皮细胞切割分离的目标,同时应用低体积扩增技术进行荧光复合扩增,检验灵敏度大大提高。实验结果显示,捕获5个细胞即可得到完整的DNA分型,随着细胞数目的增多,有效检出率逐渐提高而等位基因丢失率逐渐降低,当捕获细胞数为20个时样本的有效检出率达90 %以上。亓冰等[13]应用单细胞显微捕获技术联合Lv-PCR系统的研究表明,捕获3个细胞即可获得完整的DNA分型,1个细胞的检出率亦可达到43.3%。本实验的灵敏度相比之较低,分析原因可能是在捕获前对细胞和涂片做了一些处理,可能会造成某些细胞核膜破裂,导致染色体丢失无法检测之故,相关研究中也报道了这一结果[14]。
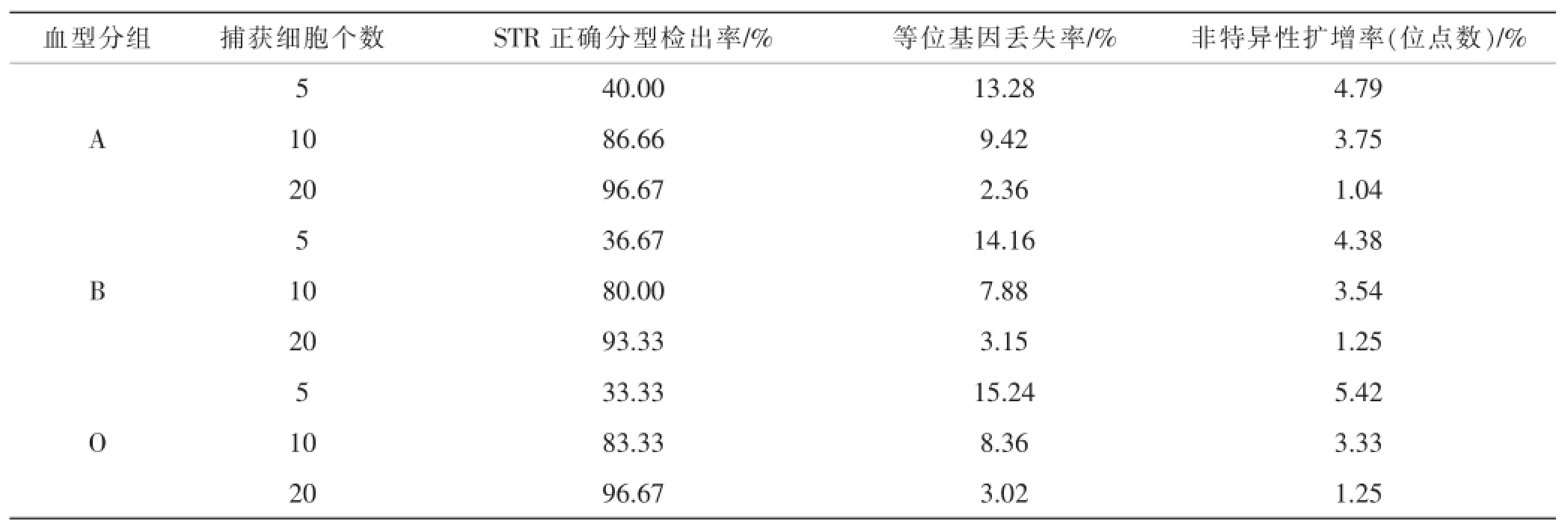
表1 切割回收不同细胞个数样本组DNA分型情况
本研究运用的免疫组化方法比免疫荧光染色对样本的要求更低,可以对不同血型个体的细胞进行了有效区分,LCM切割回收20个细胞即可获得满足需求的STR分型,对实际检案具有重要意义。在今后的研究中,如何区分A/AB型、B/AB型混合的口腔上皮细胞,如何将该技术扩展到混合精液、混合血等混合样本的分离检验,是我们要不断努力攻克的方向。
参考文献:
[1]Bill M,Gill P,Curran J,et al. Pendulum-a guidelinebased approach to the interpretation of str mixtures[J]. Forensic science international,2005,148(2-3):181-189.
[2]Wang T,Xue N,Birdwell JD. Least-square deconvolution: A framework for interpreting short tandem repeat mixtures[J]. J Forensic Sci,2006,51(6):1284-1297.
[3]Scientific working group on DNA analysis methods(swgdam). Short tandem repeat(str)interpretation guidelines[Z]. 2000.
[4]Gill P,Sparkes R,Pinchin R,et al. Interpreting simple str mixtures using allele peak areas[J]. Forensic Sci Int,1998,91 (1):41-53.
[5]Perlin MW,Szabady B. Linear mixture analysis: A mathematical approach to resolving mixed DNA samples [J]. J Forensic Sci,2001,46(6):1372-1378.
[6]董研,吴丹,徐庆文,等.荧光原位杂交技术在法庭科学DNA检验中的应用[J].中国司法鉴定,2009,4(45):49-51.
[7]韩俊萍,李彩霞,杨帆,等.单细胞分离荧光原位杂交法用于男女混合血DNA分型[J].中国法医学杂志,2012,27(1):22-26.
[8]Murray C,McAlister C,Elliott K. Identification and isolation of male cells using fluorescence in situ hybridisation and laser microdissection,for use in the investigation of sexual assault[J]. Forensic Sci Int Genet,2007,1(3-4):247-252.
[9]Vandewoestyne M,Van Hoofstat D,Van Nieuwerburgh F,et al. Suspension fluorescence in situ hybridization(s-fish)combined with automatic detection and laser microdissection for str profiling of male cells in male/female mixtures[J]. Int J Legal Med,2009,123(5):441-447.
[10]韩俊萍,胡兰,朱典,等.不同保存时间和不同精子数量精斑样本DNA分型比较[J].中国法医学杂志,2013,28(6):51-53.
[11]Li C,Qi B,Ji A,et al. The combination of single cell micromanipulation with lv-pcr system and its application in forensic science [J]. Forensic Sci Int Genet,2009,2(1):516-517.
[12]李艮平,李彩霞,郝建文,等.早期流产组织冰冻切片中胚胎成分的分离检验[J].激光杂志,2012,33(3):79-81.
[13]亓冰,李彩霞,涂政,等.单细胞显微捕获技术联合LV-PCR系统在法医学中的应用[J].国际遗传学杂志,2009,32(2):84-88.
[14]朱典,李彩霞,黄江平,等.3种碱性染液对显微捕获联合低体积扩增技术的影响[J].重庆医科大学学报,2011,36(5): 589-592.
(本文编辑:李成涛)
鉴定制度
Forensic System
E-mail:cqlhw2013@126.com。
Separation of Mixed Cell Samples of Different Blood Groups by Immuno-labelling and DNA Typing
WANG Qing-shan1,2,LI Xue-bo1,LI Hong-wei1,2
(1.Shandong University of Political Science and Law,Key Laboratory of Evidence Identification in Colleges and Universities of Shandong Province,Jinan 250014,China; 2.Institute of Forensic Science,Chongqing Public Security Bureau,Chongqing 400021,China)
Abstract:Objective To establish a new method for separating mixed epithelial cell mixtures from individuals of different ABO blood groups by immunological method. Method Mixed oral epithelial cell samples from individuals of different ABO blood groups were prepared. The cells were distinguished by immunohistochemical staining method. Three groups of samples which contained 5,10 and 20 oral epithelial cells were captured respectively by laser capture micro-dissection. All the samples were then amplified by low volume amplification techniques. The PCR products were separated and analyzed with a 3130XL genetic analyzer and GeneMapper ID software version 3.2. The number of correctly amplified gene loci was calculated. Results The cells of a single blood group can be separated from the mixture by the established method. The detection rate of DNA typing increased with the number of oral epithelial cells. When 20 oral epithelial cells were captured and amplified,the rate of detection reached 90%. Conclusion Immunohistochemical staining method is effective for separating the mixed samples from individuals of different ABO blood groups and can be utilized in forensic practice.
Key words:forensic genetics; mixed cells; DNA; STR
通信作者:李红卫(1969—),男,主任法医师,博士,硕士研究生导师,主要从事法医学检案、科研及教学等研究工作。
作者简介:王清山(1981—),男,主检法医师,硕士,主要从事DNA检验鉴定、法医现场勘查工作。E-mail: wqshan105@163.com。
基金项目:山东省自然科学基金资助项目(ZR2014HQ018);上海市法医学重点实验室开放课题(KF1510);山东省高校证据鉴识重点实验室(山东政法学院)开放课题(KFKT-201401);重庆市公安局科技攻关项目(G2014-10)
收稿日期:2015-06-26
文章编号:1671-2072-(2015)05-0044-04
doi:10.3969/j.issn.1671-2072.2015.05.008
文献标志码:A
中图分类号:DF795.4
