内质网应激相关基因在2型糖尿病合并脂肪肝小鼠肝脏中的表达变化
2015-12-29程莉娟,成细华,喻嵘等
内质网应激相关基因在2型糖尿病合并脂肪肝小鼠肝脏中的表达变化
程莉娟成细华喻嵘1曾辛1
(湖南中医药大学医学院,湖南长沙410208)
摘要〔〕目的探讨内质网应激(ERS)在高脂饮食2型糖尿病转基因MKR小鼠脂肪肝发生中的作用。方法高脂饲料诱发MKR鼠形成脂肪肝,观察肝脏形态变化,检测肝脏甘油三酯和脂肪酸水平,RT-PCR检测小鼠肝脏内质网应激相关基因mRNA表达变化。结果与正常小鼠比较,MKR组小鼠肝脏GRP78、XBP1、FAS、ACC-α、GSK3β mRNA表达水平升高(P<0.05);与MKR小鼠比较,高脂饮食MKR小鼠肝脏甘油三酯(TG)和脂肪酸(FFA)水平显著升高(P<0.01),肝脏GRP78、XBP1、CHOP、SREBP1c 、FAS、ACC-α、GSK3β和EDEM1基因mRNA表达水平均增加(P<0.01),而ApoB100 mRNA表达水平降低(P<0.01)。结论ERS参与调节肝脏脂质及ApoB100的代谢过程,在转基因2型糖尿病MKR鼠脂肪肝形成中发挥重要作用。
关键词〔〕内质网应激; 糖尿病合并脂肪肝; MKR小鼠; 脂代谢
中图分类号〔〕R285.5〔
基金项目:国家自然科学基金(81102593,81273753);中国博士后科学基金(20110491258);湖南省科技计划项目(2014FJ3023);地方高校国家级大学生创新创业训练计划项目(201210541003);湖南省中西医结合基础重点学科资助
通讯作者:成细华(1974-),女,教授,博士,主要从事中医药防治糖尿病及其并发症的机制研究。
The related gene expressions of endoplasmic reticulum stress in the liver of type 2 diabetes mice combined with liver steatosis
CHENG Li-Juan,CHENG Xi-Hua,YU Rong,etal.
Hunan University of Chinese Medicine,Changsha 410208,Hunan,China
Abstract【】ObjectiveTo observe the effect of endoplasmic reticulum stress on the formation of liver steatosis in MKR mice raised by high fat feeds. MethodsMKR mice were raised by high fat feeds to form liver steatosis. The pathological changes of liver were examined,and the levels of TG and FFA in the liver were examined too. RT-PCR was used to analyze the related gene expressions of endoplasmic reticulum stress in the liver. ResultsThe gene expressions of GRP78,XBP1,FAS,ACC-α and GSK3β on mRNA level in MKR mice were elevated slightly in contrast with normal mice(P<0.05). The levels of TG and FFA in the liver were increased remarkably,and the gene expressions of GRP78,XBP1,CHOP,SREBP1c,FAS,ACC-α,GSK3β and EDEM1 on mRNA level in MKR mice with liver steatosis were elevated significantly in contrast with MKR mice(P<0.01),while the gene expression of apoB100 was decreased(P<0.01). ConclusionsThere has a close relationship between the liver steatosis and the involvement of ERS in the lipid metabolism in the liver of MKR mice.
【Key words】Endoplasmic reticulum stress;Diabetes combined with liver steatosis;MKR mice;Lipid metabolism
第一作者:程莉娟(1979-),女,硕士,主要从事中医药防治糖尿病的机制研究。
非酒精性脂肪肝(NAFLD)是2型糖尿病的常见肝脏并发症〔1〕。根据糖尿病是形成NAFLD的重要原因之一,本课题组以高脂饮食喂养转基因2型糖尿病 MKR鼠,建立 2型糖尿病并发NAFLD模型。该模型动物的肝质量增加,肝指数上升,肝细胞弥漫性脂肪性变,糖脂代谢紊乱,血清谷丙转氨酶和谷草转氨酶浓度升高,与临床2型糖尿病合并 NAFLD极为一致,为糖尿病合并NAFLD机制研究提供一个很好的平台〔2〕。研究表明,内质网应激(ERS)在2型糖尿病合并NAFLD中具有重要作用〔3,4〕。ERS可能通过影响脂代谢相关基因,如固醇调节元件结合蛋白等的表达,增加肝脏脂肪酸的合成和积聚〔5〕。另外,ERS在肝载脂蛋白(Apo)B100的合成和分泌过程中也具有重要的调节作用,影响并制约肝细胞合成和分泌极低密度脂蛋白〔4〕。目前,ERS在2型糖尿病合并NAFLD发病中的作用尚未完全明了。本研究探讨ERS在2型糖尿病合并NAFLD小鼠模型中的作用机制。
1材料与方法
1.1动物8周龄FVB/N野生小鼠购自维通利华,MKR小鼠(采用组织特异过度表达转基因技术产生),由美国国立卫生研究院(Dr.D.LeRoith)提供纯合子MKR小鼠,经自然交配后繁殖的后代用于实验研究。上述实验用小鼠由湖南中医药大学SPF级实验动物中心饲养。
1.2主要试剂TG、FFA测定试剂盒(南京建成生物工程研究所);动物组织总RNA提取试剂盒(北京TIANGEN生物技术公司);逆转录试剂盒(Fermentas公司);PCR引物由上海生工公司合成;2×Taq PCR MasterMIX(北京TIANGEN生物技术公司)。
1.3实验分组随机选取8周龄FVB/N野生小鼠10只作为正常对照组。20只8周龄经遗传鉴定的MKR鼠根据性别、体质量,随机分为MKR组、MKR高脂组,每组10只。MKR高脂组以高脂饲料喂养,高脂饲料为动物基础饲料加15%猪油、1%胆固醇。FVB/N野生小鼠、MKR组以基础饲料喂养8 w,试验中无小鼠死亡。
1.4肝组织形态学观察取小鼠肝脏最大叶距边缘5 mm处肝组织,10%甲醛溶液固定,石蜡包埋,病理切片,HE染色后光镜观察,拍照。同时取一大小约1 mm3的肝组织,4%戊二醛溶液固定,用于透射电镜(日本JEOL公司1230型)观察肝脏的超微结构。
1.5肝脏TG和FFA的测定取新鲜肝脏组织,用9 g/L的生理盐水4℃制备10%的肝匀浆,3 000 rp/min离心15 min,取上清。严格按照试剂盒要求测定TG和FFA含量。
1.6RT-PCR检测MKR小鼠肝组织脂代谢ERS相关基因的表达取各组小鼠新鲜肝脏组织,用动物组织总RNA提取试剂盒抽提其总RNA,采用紫外分光光度计测定其浓度。取1 μg总RNA,用逆转录试剂盒以Oligo(dT)为引物进行逆转录反应。使用DNAStar 6.0软件,根据GenBank中小鼠的ERS相关靶基因葡萄糖调节蛋白(GRP)78、X盒结合蛋白(XBP)1、C/EBP同源蛋白(CHOP)、固醇调节元件结合蛋白(SREBP)1c、脂肪酸合酶(FAS)、乙酰辅酶A羧化酶(ACC-α)、糖原合酶激酶(GSK3)β、Apo B100和内质网甘露糖苷酶样蛋白(EDEM)1 mRNA序列设计PCR引物(见表1)。选择最适条件分别对小鼠肝脏靶基因和内参基因β-肌动蛋白(β-actin)进行PCR扩增。PCR产物进行2.5%琼脂糖凝胶电泳,凝胶扫描分析系统拍照并分析电泳条带灰度值,以靶基因与β-actin电泳条带密度比值计算各靶基因mRNA相对表达量。实验重复3次,取均值。

表1 小鼠肝脏内质网相关基因RT-PCR引物序列
2结果
2.1肝脏组织形态学变化见图1。FVB/N野生小鼠和MKR鼠肝脏大体形态基本相似,MKR鼠肝脏色泽较深;MKR高脂组小鼠肝脏外观呈弥漫性肿大,边缘钝而厚,质如面团,表面色泽苍白。光镜下,FVB/N野生小鼠和MKR鼠肝脏肝小叶结构正常;肝细胞排列规则成条索状,以中央静脉为中心,呈放射状分布,肝细胞大小正常,胞核位于细胞中央。MKR高脂组小鼠肝细胞大泡性脂变混有小泡性脂变,在大泡性脂变为主的细胞中,胞核挤至边侧。 电镜下,FVB/N野生小鼠和MKR鼠肝细胞形态结构正常,有丰富的线粒体。MKR高脂组小鼠肝细胞内堆满大小不一的脂滴。
2.2肝脏TG和FAA含量检测结果见表2。与正常对照组比较,MKR组小鼠肝脏TG和FAA含量增加,但差异无统计学意义(P>0.05)。与MKR组小鼠比较,MKR高脂组小鼠肝脏TG和FAA含量异常增加(P<0.01)。

A:肝脏大体形态(左:MKR组;中:MKR高脂组,右:FVB/N野生小鼠);B1:MKR组(HE,×400);B2:MKR高脂组(HE,×400);C1:MKR组(EM,×9 700);C2:MKR高脂组(EM,×9 700) 图1 各组小鼠肝脏病理变化

组别nTG(μmol/g)FAA(μmol/g)正常对照组1024.64±2.5528.24±4.12MKR组1026.50±4.2130.21±5.35MKR高脂组1052.94±5.731)102.23±12.281)
与MKR组比较:1)P<0.01
2.3肝脏内质网应激和脂代谢相关基因表达变化见图2、表3。与正常对照组比较,MKR组小鼠肝脏GRP78、XBP1、FAS、ACC-α、GSK3β mRNA表达水平明显升高(P<0.05);CHOP、SREBP1c和EDEM1 mRNA表达升高,ApoB100 mRNA表达降低,但差异无统计学意义(P>0.05)。与MKR组小鼠比较,MKR高脂组小鼠肝脏内质应激和脂代谢相关基因mRNA表达异常进一步加剧,GRP78、XBP1、CHOP、SREBP1c 、FAS、ACC-α、GSK3β 和EDEM1 mRNA表达水平均显著增加(P<0.01),而ApoB100 mRNA表达水平显著降低(P<0.01)。
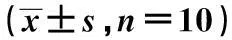
表3 小鼠肝脏ERS相关基因mRNA
与正常对照组比较,1)P<0.05,2)P<0.01;与MKR组比较,3)P<0.05,4)P<0.01
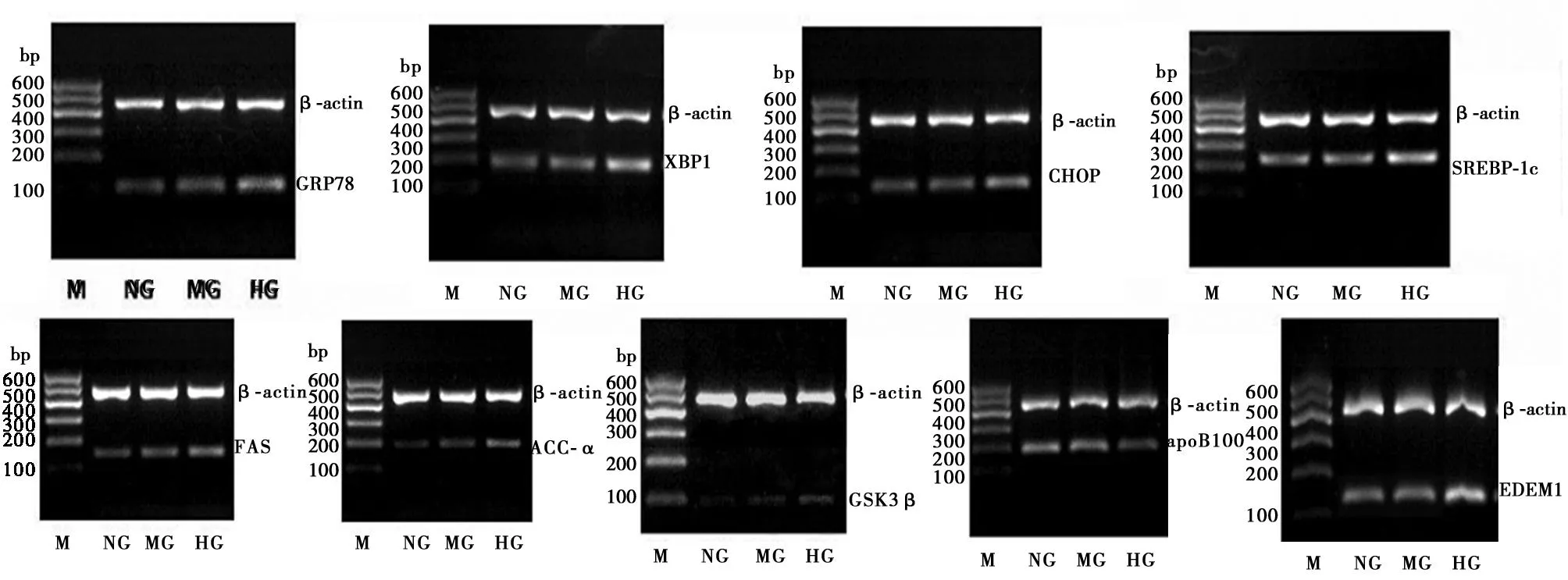
M:电泳Marker;NG:正常对照组;MG:MKR组;HG:MKR高脂组 图2 小鼠ERS相关基因RT-PCR电泳结果
3讨论
肥胖、糖尿病、高脂血症被认为是NAFLD患者脂肪肝发生发展的危险因素〔6〕。本研究所选骨骼肌特异性胰岛素样生长因子1受体功能缺失鼠(MKR鼠)在出生5 w左右即可表现为显著的肌肉、肝脏、脂肪组织胰岛素抵抗及高血糖、胰岛β细胞功能紊乱等情况〔7,8〕。尽管MKR鼠肝脏TG及FFA水平较FVB/N野生鼠有升高趋势,但差异没有统计学意义,且肝脏组织形态学未见病理改变。而高脂饮食MKR鼠肝脏TG及FFA水平则显著升高,光镜及电镜下更可见大泡和小泡混合性肝细胞脂肪变性明显,表明该2型糖尿病合并NAFLD动物模型建立成功。
内质网是蛋白质合成、折叠、运输以及储存钙的主要场所,对各种刺激极为敏感。当机体功能紊乱时,错误折叠和未折叠的蛋白在腔内聚集且细胞内钙平衡紊乱的状态称为ERS〔9〕。近年来,研究表明ERS介导了肥胖、T2DM以及NAFLD等病变生理过程〔3,4,10〕。一方面,细胞通过非折叠蛋白反应(UPR)来适应ERS。位于内质网的肌醇需要酶(IRE)1、双链RNA活化蛋白激酶样内质网激酶(PERK)和活化转录因子(ATP)6是UPR反应的信号转导蛋白。当内质网内非折叠或错误折叠蛋白积累时,GRP78与上述3种信号转导蛋白解离并激活它们。激活的IRE1则催化转录调节蛋白XBP1 mRNA剪切表达〔11〕。XBP1+/-小鼠肝脏中ERS反应增强,同时胰岛素信号传导效率降低,在高脂饮食诱导的条件下容易产生IR和2型糖尿病〔10〕。早期ERS通过激活UPR及时有效逆转内质网的内环境增强细胞存活能力,但ERS持续存在,凋亡势必为最终结果。CHOP是一种ERS特异转录因子,当各种应激情况出现后表达显著增加,影响细胞的存活。Oyadoman等〔12〕发现CHOP基因敲除后可增强细胞对抗ERS所致凋亡的能力,阻止2型糖尿病的发生。因此,GRP78、XBP1和CHOP被广泛视为ERS的标志性分子。本实验结果揭示,MKR小鼠肝脏GRP78、XBP1 mRNA表达水平较FVB/N野生鼠明显升高,表明MKR鼠体内已开始诱发ERS。而高脂饮食MKR小鼠肝脏上述3种基因的mRNA表达水平较MKR鼠进一步升高,表明高脂饮食MKR小鼠肝脏ERS程度加剧。
ERS还直接通过影响脂代谢相关基因,导致肝细胞脂肪合成增多,在2型糖尿病并发脂肪肝中具有重要作用〔5,13〕。ERS时可激活内质网上的膜连接蛋白SREBP1c作为转录因子进入胞核,调控靶基因包括脂肪合成酶如ACC-α、FAS等的表达〔14〕。当SREBP-1c表达上调至超过机体的自我调节及适应能力时,则引起其靶基因过度表达,FFA合成异常增多,肝脏脂质代谢障碍,更易导致NAFLD的发生〔15〕。 李小山等〔16〕高脂喂养大鼠12 w后,肝脏ACC-α、FAS基因在 mRNA和蛋白质水平上表达均显著升高,形成NAFLD。ERS还能调节肝脏中ApoB100合成和分泌,通过减少VLDL形成来减少肝脂肪输出,加剧肝细胞中脂肪堆积〔17〕。另外,ERS可以通过JNK(c-JUN NH2 terminal kinase)途径激活GSK3β的表达,激活下游胆固醇/甘油三酯合成和摄取相关基因表达,促进肝细胞内FFA和胆固醇的积累〔18〕。本实验中,MKR鼠肝脏脂肪酸合成相关基因仅FAS、ACC-ɑ以及GSK3β mRNA表达水平较FVB/N野生鼠明显升高,而高脂喂养的MKR小鼠肝脏SREBP1c、FAS、ACC-ɑ以及GSK3β mRNA表达水平较MKR鼠均显著增加,ApoB100表达则显著下降,表明ERS加剧了脂代谢紊乱。
EDEM1是通过XBP1作用产生的一种α-甘露糖苷酶样应激蛋白,能促进ERS时产生的不完全折叠或错误折叠蛋白的降解,是内质网相关性降解途径的标志分子之一〔19〕。研究发现高脂饮食T2DM小鼠在18周龄时肝脏EDEM1 mRNA表达显著增加,可能影响了2型糖尿病小鼠肝脏ApoB100和VLDL合成和分泌,加速了脂肪肝的形成〔4〕。本实验中,高脂喂养的MKR小鼠肝脏较FVB/N野生鼠、MKR小鼠同样EDEM1m RNA表达明显升高,这进一步表明高脂饮食MKR鼠ERS增加了肝脏脂质积累,更易导致脂肪肝。
综上所述,高脂喂养的MKR鼠,从生化及组织形态学上均显示肝脏存在脂肪性变。同时,研究结果表明2型糖尿病MKR鼠肝脏内存在ERS,导致少数脂代谢相关基因FAS、ACC-ɑ以及GSK3β mRNA表达水平升高,但在实验期间暂未形成脂肪肝;以高脂喂养的MKR鼠肝脏脂代谢相关基因SREBP1c 、FAS、ACC-ɑ、GSK3β、ApoB100和EDEM1 mRNA表达均异常增加,说明高脂饮食加剧了MKR鼠肝脏ERS,ERS进而又促进肝脏脂类合成,抑制肝脏脂类输出,从而参与肝脏脂肪性变。肝脏ERS和脂代谢相关基因蛋白表达的差异有待进一步研究。因此,本研究可为T2DM合并NAFLD的治疗提供新靶点。
4参考文献
1周慧,王刚,郭丽萍.2型糖尿病患者非酒精性脂肪肝患病率的回顾性分析〔J〕.河北医药,2010;32(5):583-84.
2成细华,喻嵘,明霞,等.2型糖尿病合并非酒精性脂肪肝动物模型的建立〔J〕.胃肠病学和肝病学杂志,2011;20(1):77-80.
3Le AH,Scapa EF,Cohen DE,etal.Regulation of hepatic lipogenesis by the transcription factor XBP1〔J〕.Science,2008;320(5882):1492-6.
4毛刘峰,姜小伟,秦艳,等.内质网应激对2型糖尿病小鼠脂肪肝发生的影响〔J〕.世界华人消化杂志,2009;17(1):4-10.
5陆金来,陈金联,陈明祥,等.肝脏脂肪酸在高脂饮食大鼠非酒精性脂肪性肝病模型中的代谢〔J〕.世界华人消化杂志,2008;16(16):1728-33.
6McClain CJ,Mokshagundam SP,Barve SS,etal.Mechanisms of non-lcoholic steatohepatitis〔J〕.Alcohof,2004;34(1):67-79.
7喻嵘,成细华,胡伟,等.骨骼肌特异性胰岛素样生艮因子l及胰岛素双受体功能缺失鼠糖尿病发病及其相关炎症因子的变化〔J〕.中国组织工程研究与临床康复,2007;11(45):9075-8.
8Kim H,Penni8i P,Zhao H,etal.MKR mice are resistant to the metaboIic actions of both insulin and adiponectin:discordance between insulin resistance and adiponectin responsiveness〔J〕.Am J Physiol Endocrinol Metab,2006;291(2):E298-305.
9Lai E,Reodoro T,Volchuk A.Endoplasmic reticulum stress:signaling the unfolded protein response〔J〕.Physiology(Bethesda),2007;22(3):193-201.
10Ozcan U,Yilmaz E,Ozcan L,etal.Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes〔J〕.Science,2006;313(5790):1137-40.
11Malhi H,Kaufman RJ.Endoplasmic reticulum stress in liver disease〔J〕.J Hepatol,2011;54(4):795-809.
12Oyadoman S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress〔J〕.Cell Death Differ,2004;11(4):381-9.
13Ota T,Gayet C,Ginsberg HN.Inhibition of apoliporotein B100 secetion by lipid-induced hepatic endoplasmic reticulum stress in rodents〔J〕.J Clin Invest,2008;118(1):316-32.
14Raghow R,Yellaturu C,Deng X,etal.SREBPs:the crossroads of physiological and pathological lipid homeostasis〔J〕.Trends Endocrinol Metab,2008;19(2):65-73.
15 Ahmed MH,Byrne CD.Modulation of sterol regulatory element binding proteins(SREBPs)as potential treatments for non-alcoholic fatty liver disease(NAFLD)〔J〕.Drug Discov Today,2007;12(17-18):740-7.
16李小山,何松.ChREBP及其靶基因在高脂大鼠非酒精性脂肪肝中的表达〔J〕.重庆医学,2011;40(21):2125-27.
17Su Q,Tsai J,Xu E,etal.Apoliporotein B100 acts a molecular link between lipid-induced endoplasmic reticulum stress and hepatic insulin resistance〔J〕.Hepatology,2009;50(1):77-84.
18Kim AJ,Shi Y,Austin RC,etal.Valproate protects cells from ER stres-induced lipid accumulation and apoptosis by inhibiting glycogen synthase kinase-3〔J〕.J Cell Sci,2005;118(Pt1):89-99.
19Sundar Rajan S,Srinivasan V,Balasubramanyam M,etal.Endoplasmic reticulum(ER)stress and diabetes〔J〕.Indian J Med Res,2007;125(3):411-24.
〔2013-07-18修回〕
(编辑徐杰)
