一种手性甾体酰胺化合物的蛋白结合特征研究
2015-12-28
(荆楚理工学院化工与药学院,湖北荆门448000)
甾体化合物有较强的细胞穿透性和良好的膜接受性,在动植物生命活动中发挥着重要作用[1]。研究发现,甾体酰胺类化合物大都表现出良好的抗肿瘤、抗菌、抑制5α-还原酶等生物活性,且甾体结构的微小变化可能引起此类化合物生理活性的巨大改变[2]。因此,通过对甾体母核或支链结构进行修饰、研究其构效关系,以得到具有更高生物活性或特殊生理功能的甾体化合物,已成为化学和生命科学领域的热点课题之一[3]。目前,越来越多新的甾体酰胺化合物被合成出来,其中许多已被证实具有重要的药理活性,3β-乙酰氧基-17-氮杂-D-homo-5-雄甾烯-17-酮(3β-acetoxy-17-aza-D-homo-5-androsten-17-one,AHAO)便是其中的一种。AHAO 是具有手性的甾体酰胺化合物,对Hela细胞有很好的抑制作用[4],表现出了较为理想的抗癌活性,但其具体的药理活性机制尚不明确。
鉴于此,作者参照文献合成了化合物AHAO,并利用光谱技术研究了AHAO 与人血清白蛋白(HSA)的相互作用,获取了AHAO 与HSA 的结合位点、结合作用力强弱、结合反应的热力学性质等方面的信息,有助于深入理解AHAO 在人体内的运输过程、吸收效率、活性机理。
1 实验
1.1 试剂与仪器
磷酸盐缓冲溶液(pH=7.40,NaCl 0.15 mol·L-1);2.0×10-4mol·L-1HSA 工作液,美国Sigma公司;2.0×10-5mol·L-1AHAO 工作液(纯度>99%),自制。
LS-55型荧光分光光度计,Perkin Elmer;YB12型超级恒温水浴锅,Prima;J-810 型圆二色谱仪,Jasco;AUY220型电子分析天平,Shimadzu。
1.2 AHAO 的合成路线(图1)
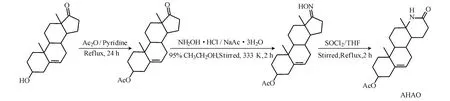
图1 AHAO 的合成路线Fig.1 The synthetic route of AHAO
1.3 方法
向10mL比色管中加入适量HSA 工作液,然后加入一定量的AHAO 工作液,以磷酸盐缓冲溶液定容,充分混合均匀后置于超级恒温水浴锅中静置30 min。设定单色器激发狭缝宽度、发射狭缝宽度分别为15nm、4nm,以290nm 的紫外光照射样品,在300~420nm 波长范围内扫描并记录HSA-AHAO 体系的发射光谱。
2 结果与讨论
2.1 AHAO 对HSA 的荧光光谱的影响
HSA 分子含有带芳香性侧链的不饱和氨基酸残基,能够吸收紫外辐射诱发价电子跃迁;若激发态价电子以非辐射的形式失活,则可发射出荧光。药物分子在与蛋白质作用时,可能因为种种原因导致蛋白质内源荧光猝灭。
不同浓度AHAO 对HSA 荧光发射光谱的影响如图2所示。

图2 不同浓度AHAO 对HSA荧光光谱的影响Fig.2 Effect of different concentrations of AHAO on fluorescence spectra of HSA
2.2 荧光猝灭机理
导致荧光猝灭的原因很多,如分子碰撞、基态复合物的生成、溶解氧,就猝灭机理而言,主要有动态猝灭和静态猝灭。动态猝灭是激发态分子之间的相互碰撞使得单重电子激发态电子以辐射的形式失活引起的,其热力学性质可以用Stern-Volmer方程描述[5]:

式中:F0为无猝灭剂时蛋白质的荧光强度;F为加入猝灭剂后蛋白质-猝灭剂体系的荧光强度;KSV为动态荧光猝灭常数(L·mol-1),反映了蛋白质与猝灭剂在彼此扩散和相互碰撞达到动态平衡时的量效关系;[Q]为猝灭剂的平衡浓度;Kq为动态荧光猝灭的速率常数(L·mol-1·s-1),反映了体系中分子彼此扩散和碰撞对荧光体荧光寿命衰减速率的影响;τ0为无猝灭剂时荧光分子的平均寿命[6]。
为了判断AHAO 对HSA 的荧光猝灭机理,先以动态猝灭来处理,Stern-Volmer方程拟合的曲线方程如图3所示,根据方程计算得到的不同温度下的动态猝灭常数KSV见表1。
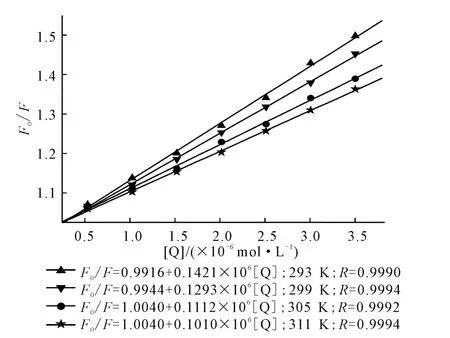
图3 Stern-Volmer曲线及方程Fig.3 Stern-Volmer curves and equations
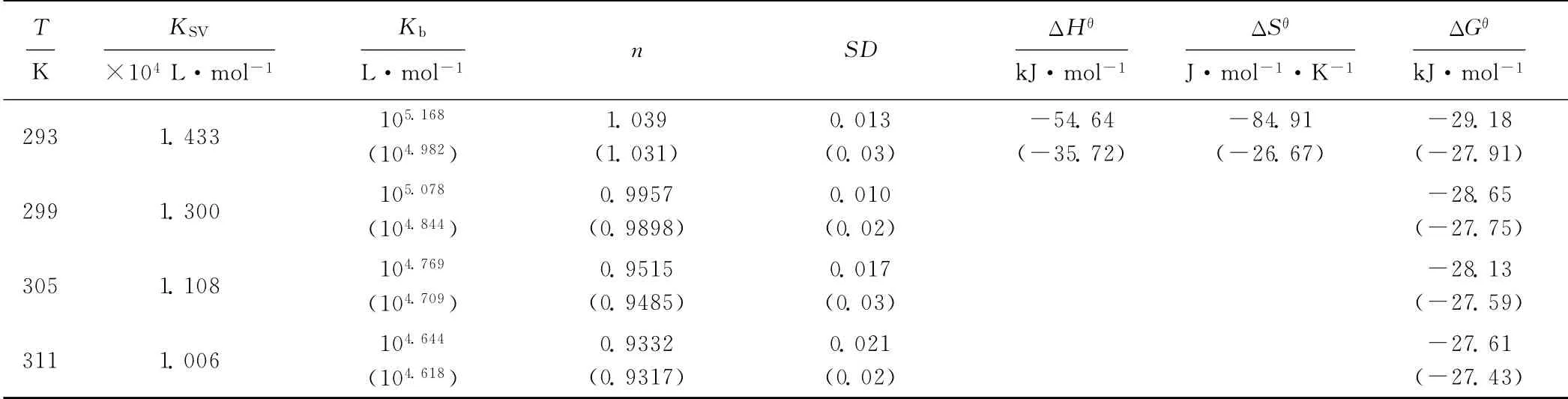
表1 AHAO 与HSA作用的结合常数、结合位点数和热力学常数Tab.1 Binding constants,binding sites and thermodynamics parameters of interaction between AHAO and HSA
动态猝灭是分子间碰撞所致,温度升高将增加分子间有效碰撞次数,加速电子转移和能量传递,从而得到更高的动态猝灭常数[7]。但从表1看出,293K 时的动态猝灭常数KSV为1.433×104L·mol-1,311K时减小到1.006×104L·mol-1,这与动态猝灭的定义并不相符,表明,AHAO 对HSA 的荧光猝灭机理不是动态猝灭,而是静态猝灭。
在静态猝灭中,小分子与生物大分子结合,其结合常数(Kb)和结合位点数(n)可由式(2)计算:

log(F0/F-1)与log[Q]呈线性关系,斜率为结合位点数n,截矩为logKb,如图4所示。
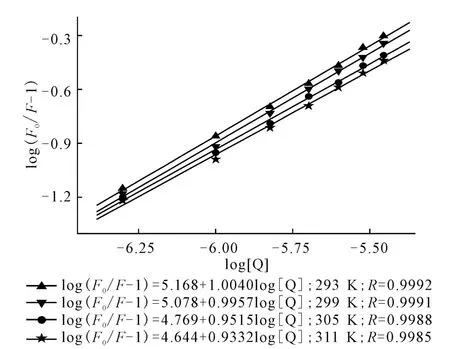
图4 不同温度下的log(F0/F-1)-log[Q]曲线Fig.4 log(F0/F-1)-log[Q]Plots at different temperatures
由图4可看出,线性回归曲线的斜率接近1,这表明在特定条件下,HSA 分子中只有1个与AHAO 具有高亲和力的结合位点;随着温度的升高,AHAO 与HSA 作用的结合常数Kb值减小,结合位点数n也相应减少。
2.3 结合反应的热力学性质
HSA-AHAO 相互作用的焓变和熵变是确定结合机理的重要参数。由于实验是在一个大气压条件下进行,故结合作用的热效应和熵变可以由Van′t Hoff方程求取:以lnK对1/T作图,拟合得到Van′t Hoff方程,如图5所示。

ΔHθ和ΔSθ可根据方程的截矩和斜率作简单变换得到。而吉布斯自由能ΔGθ则由吉布斯-亥姆霍兹方程(式4)求算,结果见表1。

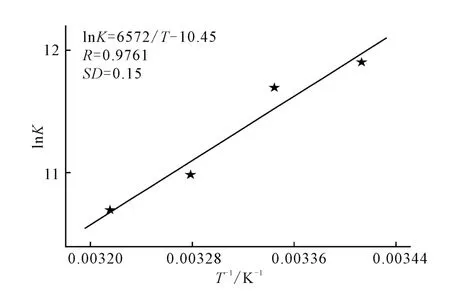
图5 Van′t Hoff方程Fig.5 Van′t Hoff Plot
由表1可看出,ΔHθ和ΔGθ均为负值,说明HSAAHAO 的相互作用是能够自发进行的放热过程;而且与相同条件下的母体酮相比,甾体酰胺化合物AHAO与HSA 反应的自发程度和放热效应都有所增强。
2.4 结合作用力类型
Ross等[8]指出,如果体系的ΔH和ΔS都增大,作用力一般为疏水作用力;若ΔH和ΔS都减小,作用力可能为氢键和范德华力;若ΔH≈0、ΔS>0,一般是静电作用力的特征。可见,氢键和范德华力对于维持HSA-AHAO 复合物的结构起到主要作用。
2.5 AHAO 对HSA二级结构的影响
在一定波长范围内,如果记录下左旋偏振光和右旋偏振光随波长连续变化的情况,并对波长作图,就可以得到该物质的圆二色谱(CD 谱)[9]。HSA 和HSAAHAO 体系的圆二色谱如图6所示。

图6 HSA(a)和HSA-AHAO体系(b)的圆二色谱Fig.6 The CD spectra of HSA(a)and HSA-AHAO system(b)
用计算机程序计算AHAO 作用前后HSA 二级结构中α-螺旋、β-折叠、β-转角、无规卷曲等结构相对含量的变化,结果见表2。
由表2可看出,与AHAO 作用后,HSA 分子中α-螺旋结构减少,而β-折叠、β-转角、无规卷曲结构均有所增加。

表2 HSA二级结构相对含量/%Tab.2 Relative contents of different secondary structures of HSA/%
3 结论
在模拟人体血液离子强度和酸度条件下,甾体酰胺化合物(AHAO)与人血清白蛋白(HSA)依靠氢键和范德华力结合,生成了新的复合物,猝灭HSA 的内源荧光;结合反应的ΔHθ=-54.64kJ·mol-1、ΔSθ=-84.91J·mol-1·K-1,是一个自发进行的放热过程;与相同条件下的母体酮相比,甾体酰胺化合物AHAO 与HSA 反应的自发程度和放热效应都有所增强。AHAO 的结合使HSA 分子中α-螺旋结构减少,β-折叠、β-转角、无规卷曲结构增加,起到调节其生理功能的作用。
[1]BELKHADIR Y,CHORY J.Brassinosteroid signaling:A paradigm for steroid hormone signaling from the cell surface[J].Science,2006,314(5804):1410-1411.
[2]ASSELIN-LABAT M L,VAILLANT F,SHERIDAN J M,et al.Control of mammary stem cell function by steroid hormone signalling[J].Nature,2010,465(7299):798-802.
[3]HUNAG Y,CUI J,ZHONG Z,et al.Synthesis and cytotoxicity of 17a-aza-D-homo-androster-17-one derivatives[J].Bioorg Med Chem Lett,2011,21(12):3641-3643.
[4]HUANG Y,CUI J,CHEN S,et al.Synthesis and antiproliferative activity of some steroidal lactams[J].Steroids,2011,76(12):1346-1350.
[5]SOCHACKA J,SULKOWSKA A,KOWALSKA A.The binding of the sulfur and oxygen purine derivatives with bovine serum albumin[J].Acta Pol Pharm,2008,65(1):169-171.
[6]熊泽云,张华新,王洪林,等.镧(Ⅲ)-芸香甙配合物与人血清白蛋白作用特征的研究[J].化学与生物工程,2014,31(5):24-27.
[7]HU Y J,OUYANG Y,DAI C M,et al.Site-selective binding of human serum albumin by palmatine:Spectroscopic approach[J].Biomacromolecules,2010,11(1):106-112.
[8]ROSS P D,SUBRAMANIAN S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[9]WHITMORE L,WALLACE B A.Protein secondary structure analyses from circular dichroism spectroscopy:Methods and reference databases[J].Biopolymers,2007,89(5):392-400.
