植物内生菌在园艺产品采后保鲜中的研究进展
2015-12-28彭敦洋肖瑶郭经纬陶天龙田丽波商桑黄绵佳
彭敦洋,肖瑶,郭经纬,陶天龙,田丽波,商桑,黄绵佳
(海南大学园艺园林学院,热带作物种质资源保护与开发利用教育部重点实验室,海南海口570228)
园艺产品(果蔬、花卉)采后保鲜现已成为一个令全球农业科研工作者和园艺产品生产者头痛的问题。病理性的(病原微生物入侵、繁殖)、生理性的(自身生理衰退)和物理性的(环境温度和湿度的不适应性、机械摩擦损伤)原因,以及三者协同作用是导致园艺产品采后腐烂的主要因素。新鲜果蔬采后运输中腐烂率在发达国家是10%~30%,而在我国高达30%~50%,每年造成的经济损失逾千亿。目前,仍然是使用化学杀菌剂这一途径来控制园艺产品采后病害,然而长期使用且频繁加高使用化学杀菌剂的浓度导致病菌产生抗性而降低了防效,同时,严重威胁着人类健康与生态环境。因此,发展无公害型生物农药尤其是非化学合成天然的保鲜手段来控制园艺产品采后病害已成为一种新趋势,逐渐成为一个新兴研究热点[1-2]。
植物内生菌,是一类能够定殖生长于植物体内,并且不给植物体带来显著病害的微生物的统称,主要是真菌类、细菌类和放线菌类三类。植物内生菌可以完美地定殖生活于植物体内,并且部分内生菌还能够保护其宿主植物体免受一些病害的威胁,由于其与普通的化学杀菌剂相比,作为生防菌的植物内生菌具有广谱抗菌性和高效的安全性等优势,用其菌体(或其产生的活性物质)作为天然保鲜剂,将是绝佳的选择。笔者从园艺产品采后保鲜所面临的病害种类、植物内生菌的来源、植物内生菌的生防保鲜的机制、保鲜的实际应用等方面进行综述。
1 园艺产品采后所面临的病害种类
园艺产品采后变色、坏死、萎蔫腐烂是其保鲜所面临的主要问题,大多是由于采前或采后贮藏过程中,营养元素不适宜、温度不适宜、水分不适宜、盐碱和有毒害物质或气体、光照过强或过弱及运输途中机械摩擦碰撞等非生物因素导致园艺产品自身调节机能受损,病原微生物(表1),如病毒、菌类等趁机侵染、疯狂繁殖,继而导致这些园艺产品表面发生变色、组织坏死、整体或局部萎蔫及腐烂。这些非生物因素的改变只是为后者(生物因素)提供了入侵的便利条件,假若能够在采后有效地切断这些病原菌的侵染、繁殖途径,那么园艺产品采后保鲜问题即可得以解决。
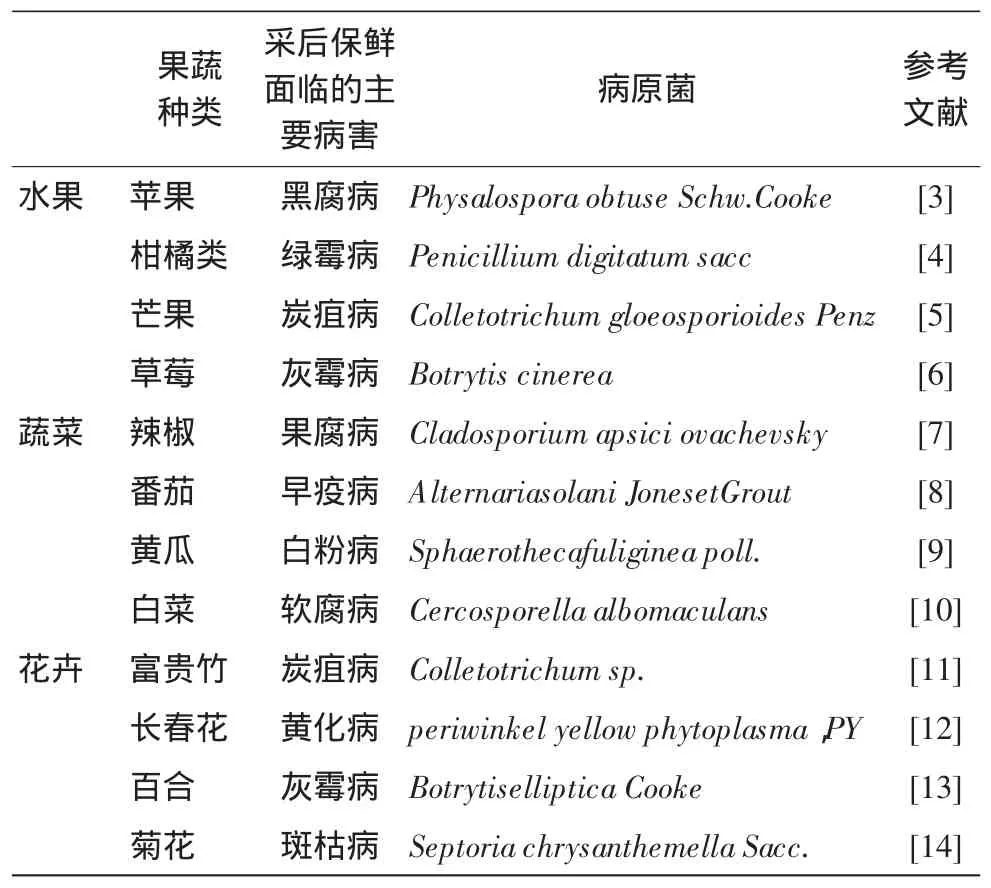
表1 常见园艺产品采后面临的主要病害调查
2 植物内生菌的来源
目前国内外研究的植物内生菌基本上是采用表面消毒剂消毒,无菌水清洗并验证消毒彻底以后,再从植物的根(含根系附属土壤)、茎、叶、花、果实以及种子等部位进行分菌。Tiwari等[15]在分离圣罗勒叶部内生菌时,先用流水冲洗叶片10 min后,将其于NaClO(1%)中浸10 min消毒处理,随后用无菌的磷酸钾缓冲液漂洗干净,漂洗后将漂洗液置于培养基中培养。但从不同地点采集的植物或同一植物不同的部位利用的培养基不同,其分离的内生菌也会有差异。陈萌等[16]应用7种选择性分离培养基分离四川省各个地区川楝样品根、茎、叶、树皮和果实等不同部位中的内生菌,统计显示表皮部位分离到的占总数的36.7%,而从果实部位分离到的占总数的7.6%,分离到的数量最少的是根部,但其有生防效果的菌比例最高。王春等[17]在大豆的不同生育期从其根、茎、叶和种子中分离得到不同的内生菌。
3 植物内生菌的保鲜机制
由于植物内生菌在园艺产品采后保鲜方面应用优势巨大,国内外科研学者在植物内生菌生防方面的报道较多[18-24],但植物内生菌在园艺产品保鲜中作用机制还知之甚少。笔者就国内外近期已有报道的机制研究成果进行归纳,主要保鲜机制有3种,即与病原微生物竞争生态位点、分泌抑菌活性物质控制病原微生物繁殖、通过诱导宿主植物打开主动防御体系等。
3.1 与病原微生物竞争生态位点
植物内生菌定殖在园艺产品体表及内部,通过与病原微生物争夺水分、氧气及各种营养物质等方式与已入侵的病原微生物竞争生态位点,达到控制园艺产品表皮或其内部病原微生物的数量,从而有效的延长了采后园艺产品的保鲜期。Bacon等[25]发现玉米内生菌(枯草芽孢杆菌)能够在玉米体内较为快速的定殖,并且与其病原菌串珠镰孢具有相同的生态位点,通过与其竞争生态位点抑制串珠镰孢的繁殖,削减对玉米的侵害程度。许秀兰等[26]在云杉内生毛壳菌的生防机制研究中发现,毛壳菌株C45与病原菌的对峙培养时,其气生菌丝发达且产生大量子囊果,出现包围病原菌生长的趋势,病原菌则趋向停止生长,抑菌率达60%,该菌株对病原菌的拮抗作用强,在与病原菌的营养竞争过程中占有一定的优势。白丹虹[27]在香蕉枯萎病FJ4的抗菌实验中发现,CS16单独培养能够产生少许抑菌活性物质,但是单独培养产生的活性物质抑菌效果却并不如CS16与病原菌混合培养效果,故CS16的生防机制可能主要为CS16与病原菌之间的营养竞争。
3.2 分泌抑菌活性物质控制病原微生物繁殖
分泌抑菌活性物质来抑制病原微生物的增长、繁殖亦是植物内生菌作为生防菌的又一重要作用机理。植物内生菌在体外培养或在植物体内(但目前大都是在体外离体培养验证)能够产生多种多样的抑菌活性物质,如几丁质酶、生物碱类、抗生素类等。这些物质可以在植物体内循环转化,同时对已入侵的病原有直接或间接的或轻或重的抑制作用,从而使园艺产品保鲜期得到有效的延长。Nally[28]等发现酿葡萄酒的酵母菌通过挥发或分泌活性物质,抑制病原真菌孢子萌发生长并降低芽管长度,以达到抑制病原微生物的繁殖。袁志林等[29]从百山祖冷杉针叶组织中分离出3株能产生强烈的挥发性物质的炭角菌科产气霉属的内生菌,这些活性物质对多种植物病原微生物具有明显的致死或抑制功能。李悦等[30]在烟草灰霉病菌培养时加入不同浓度的菌株Y41和Y11的胞外代谢产物,不同浓度的Y41和Y11胞外代谢产物对灰霉病菌丝的生长的抑制率也不同,Y41和Y11的胞外代谢产物原液抑制率超90%。
3.3 诱导宿主植物体打开主动防御系统
诱导宿主植物主动防御的机制较为复杂,一般地植物在某些物质诱导作用下,能够诱导植物体发生4种反应:第一,诱导某些与防御相关的基因和蛋白的表达;第二,加强细胞壁结构;第三,抑制蛋白质的氧化;第四,诱导寄主产生次生代谢产物。李春玲[31]分离筛选到两株对芒果采后炭疽病菌有显著抑制作用的枯草芽胞杆菌,这两株内生菌能够诱导芒果自身合成多酚氧化酶、过氧化物酶和超氧化物歧化酶3种防御酶,从而提高芒果果实对芒果炭疽病的抗性。Torres等[32]研究发现成团泛菌(pantoe aagglomerans)能够诱导柑橘产生酚类物质,提高果实的抗氧化活性。Duran等[33]表明低浓度的ROS可作为信号传导的小分子,在病原菌入侵植物体的早期时,某些内生菌与其反应能够改变ROS,并能诱导植物体相关抗性蛋白的表达。
4 植物内生菌在采后保鲜中的实际应用
到目前为止,实际应用于生活生产的科研成果转化并不是很多。人们利用内生菌应用于园艺产品生防的途径有2种,一是利用自然存在于园艺产品表面的生防菌,另一种是人为引入生防菌。
4.1 利用生防菌的途径
Chalutz等[34]的洗果实验证明,清洗后贮藏的柑橘比未清洗的反而更易腐烂,而其洗果液接种培养未出现病菌,而稀释后培养基出现病菌,由此可见园艺产品表面自然存在的内生菌还是具有良好的生防效能的。但是,如何有效提高这种自然生防效能却是无法依靠自然控制,还是要依靠人为操控。
人为引入可分在采前引入,也可在采后引入。采前引入是在园艺产品采前,大多采用表面喷施的方法引入生防菌。相比采后引入,其优点是可以防治生长期至采后的病害,减少生长期病害损伤;某些园艺产品(例如樱桃、草莓)采后不宜翻动,显然采前引入生防菌比采后引入要好。采后引入是在园艺产品采后利用喷雾、浸果的方式处理,以达到引入生防菌,这两种方式各有利弊,浸果可以使生防菌布满产品表面,但若有个别已被侵染的产品,则会引起全体交叉感染,同时对生防菌的需求量也较大;而喷雾引入的方式却可以很好的解决交叉感染的问题,减少了内生菌的用量,但喷雾易导致个别园艺产品表面生防菌菌量较低,无法对个别产品进行有效防治。
4.2 近期植物内生菌应用于采后保鲜的科研成果转化
近年来植物内生菌在园艺产品采后保鲜中的应用逐渐成为研究热点,但大都仅限于科研及学术讨论,而将科研成果实际大规模应用到生产中的,除了枯草芽孢杆菌、毕赤氏酵母菌、假丝酵母菌、木霉菌等为数不多的几种外就寥寥无几了。笔者就国内外近期实际应用(专利)进行综述。
Hellwege等[35]已公开其实际应用专利,通过选用包含芽孢chitinosporus AQ746(NRRL Accession No.B-21618),蕈状芽孢杆菌 AQ726(NRRL Accession No.B-21664),芽孢杆菌属,枯草杆菌,苏云金芽孢杆菌,NRRL Accession No.30547等菌种或这些菌株的突变体进行试验,发明了包含涉及一种或至少一种生物抑制剂。并详细介绍使用这种生物抑制剂用于降低植物损伤的方法。此发明的生物抑制剂可用于降低昆虫、螨虫、线虫和植物病原菌对植物部分的或整体的破坏,以及降低园艺产品采后的损失。Andersch等[36]从链霉菌microflavus菌株NRRL B-50550及其突变体菌株产生的活性代谢物中,筛选到了对植物病原菌有抑制功能的生物制剂。使用该生物制剂,可降低植物部分或总体损伤,延长园艺产品采后保鲜期,降低园艺产品采后的损失。Wachendorff-neumann[37]的发明是一种病原菌的生防菌剂,使用这种生防菌剂,可降低植物损伤,延长园艺产品采后保鲜期。Brown[38]提供了芽孢杆菌的新分离的菌株,研发出一种应用于西红柿的生防菌剂。同时也表明TS-15(或其突变体)也可用来抑制植物病原菌,达到延长采后园艺产品保鲜期的效果。Levyt[39]发现了能有效地抵抗各种植物病原菌的生防菌剂Pseudozyma Aphidis,其发明生防菌剂P.Aphidis,可促进植物的生长,提高植物的活力,从而提高植物对病原菌的抗性,并且延长园艺产品的寿命及货架期。
5 问题及展望
植物内生菌是一个集多样性、易接触性于一体的群体,但目前内生菌群体多样性的系统性研究较少,有待科研学者去探索。由于植物内生菌自身也是植物体内的一种微生物,是否会对园艺产品采后生理造成影响,在应用时是我们需要考虑的问题之一;内生菌是一种活体生物,容易受植物体外界及体内环境影响,内外环境因子的变化会影响其保鲜效果;目前,大多数筛选到植物内生菌的保鲜效果实验仅在实验室进行,也只处于一种试用阶段,其成果转化和应用率偏低。由于园艺产品采后面临的生物威胁多种多样,所以具有广谱杀菌效果的植物内生菌也有待去深入研究。
[1]ZHANG S,GAN Y,XU B.Efficacy of Trichoderma longibrachiatum in the control of Heterodera avenae[J].BioControl.2014,59(3):319-331.
[2]HUANGQ,LU N,HE H,et al.Colonization and Promotion Growth of Mangrove Endophytic Bacteria AiL3 in Soybean[J].Soybean Science.2014(2):19.
[3]GRAHOVAC J,GRAHOVAC M,DODICJ,et al.Optimization of cultivation medium for enhanced production of antifungal metabolites by Streptomyces hygroscopicus[J].Crop Protection.2014(65):143-152.
[4]SOTO-MUNOZ L,TEIXIDO N,USALL J,et al.Molecular tools applied to identify and quantify the biocontrol agent Pantoea agglomerans CPA-2 in postharvest treatments on oranges[J].Postharvest Biology and Technology.2015(100):151-159.
[5]SIDDIQUI Y,ALI A.Colletotrichum gloeosporioides(Anthracnose)[J].Postharvest Decay:Control Strategies.2014:337.
[6]CAIZ,YANG R,XIAO H,et al.Effect of preharvest application of Hanseniaspora uvarum on postharvest diseases in strawberries[J].Postharvest Biology and Technology.2015(100):52-58.
[7]BASHAH,RAMANUJAM B.Growth promotion effect of Pichia guilliermondii in chilli and biocontrol potential of Hanseniaspora uvarum against Colletotrichum capsici causing fruit rot[J].Biocontrol Science and Technology.2015,25(2):185-206.
[8]YI Y,LI Y,XIA B,et al.Optimization of medium composition and culture conditions for antifungal activity of a tomato endophytic bacterium[J].Biological Control.2015(82):69-75.
[9]GAFNI A,CALDERON CE,HARRIS R,et al.Biological control of the cucurbit powdery mildew pathogen Podosphaera xanthii by means of the epiphytic fungus Pseudozyma aphidis and parasitism as a mode of action[J].Front.Plant Sci.2015(6):132.
[10]HYAKUMACHI M,TAKAHASHI H,MATSUBARA Y,et al.Recent studies on biological control of plant diseases in Japan[J].Journal of General Plant Pathology.2014,80(4):287-302.
[11]SHARMA K,MERRITT JL,PALMATEER A,et al.Isolation,Characterization,and Management of Colletotrichum spp.Causing Anthracnose on Lucky Bamboo (Dracaena sanderiana) [J].HortScience.2014,49(4):453-459.
[12]NEJAT N,VALDIANI A,CAHILL D,et al.Ornamental Exterior versus Therapeutic Interior of Madagascar Periwinkle(Catharanthus roseus):The Two Faces of a Versatile Herb[J].The Scientific World Journal.2015.
[13]CHIOU AL,WU WS.Formulation of Bacillus amyloliquefaciens B190 for control of lily grey mould(Botrytis elliptica)[J].Journal of Phytopathology.2003,151(1):13-18.
[14]DE AK,SAHA J,SADHUKHAN R,et al.Prediction of intensity and rate of spread of Chrysanthemum leaf blotch disease(Septoria chrysanthemella Sacc.)in relation to weather parameters.[J].Journal of Mycopathological Research.2014,52(2):285-290.
[15]TIWARI R,KALRA A,DAROKAR MP,et al.Endophytic bacteria from Ocimum sanctum and their yield enhancing capabilities[J].Current microbiology.2010,60(3):167-171.
[16]陈萌,李小林,李强,等.川楝内生放线菌的分离及多样性研究[J].微生物学通报,2015,42(2):264-271.
[17]王春,王芊,曹旭.大豆内生菌的分离及菌核病拮抗菌的筛选[J].黑龙江农业科学,2015(4):8.
[18]LEE YS,NGUYEN XH,NAING KW,et al.Role of Lytic Enzymes Secreted by Lysobacter capsici YS1215 in the Control of Root-Knot Nematode of Tomato Plants[J].Indian Journal of Microbiology.2015,55(1):74-80.
[19]BRACK C,MIKOLASCH A,SCHLUETER R,et al.Antibacterial Metabolites and Bacteriolytic Enzymes Produced by Bacillus pumilus During Bacteriolysis of Arthrobacter citreus[J].Marine Biotechnology.2015,17(3):290-304.
[20]ZHOU JY,ZHAO XY,DAI CC.Antagonistic mechanisms of endophytic Pseudomonas fluorescens against Athelia rolfsii[J].Journal of applied microbiology.2014,117(4):1144-1158.
[21]SINGH MJ,PADMAVATHY S.Research article isolation,screening and characterization of endophytic pgpractinomycetes present commonly inneem&tulsi leaves-in vitro study(tomato)[J].International Journal of Resent Scientific Research.2014,3 (5):574-579.
[22]YADAV AK,YANDIGERI MS,VARDHAN S,et al.Streptomyces sp.S160:a potential antagonist against chickpea charcoal root rot caused by Macrophomina phaseolina(Tassi)Goid[J].Annals of Microbiology.2014,64(3):1113-1122.
[23] STAATS CC,JUNGES Â,GUEDES RL,et al.Comparative genome analysis of entomopathogenic fungi reveals a complex set of secreted proteins[J].BMC genomics.2014,15(1):822.
[24]CHAN Z,TIAN S.Interaction of antagonistic yeasts against postharvest pathogens of apple fruit and possible mode of action[J].Postharvest Biology and Technology.2005,36(2):215-223.
[25]BACON CW,YATESIE,HINTON DM,et al.Biological control of Fusarium moniliforme in maize.[J].Environmental Health Perspectives.2001,109(Suppl 2):325.
[26]许秀兰,黄晓丽,张翅,等.云杉内生优势毛壳菌的筛选及其生防机制研究[J].中国生物防治学报.2014,30(4):511-519.
[27]白丹虹.香蕉枯萎病生防菌的筛选、防治作用及生防机制初探[D].福州大学,2010.
[28]NALLY MC,PESCE VM,MATURANO YP,et al.Antifungal modes of action of Saccharomyces and other biocontrol yeasts against fungi isolated from sour and grey rots[J].International journal of food microbiology.2015,204:91-100.
[29]袁志林,陈益存,毛黎娟,等.3株产气内生真菌的水果防腐活性及其气体成分分析[J].林业科学,2013,49(6):83-89.
[30]李悦,陈永珍,周荣金,等.烟草灰霉病菌生防细菌菌株Yll和Y141的鉴定及其生防机制初探 [J].西南农业学报,2014(6):2413-2418.
[31]李春玲.芒果炭疽病拮抗细菌筛选及生防潜能测定[D].山东农业大学,2012.
[32]TORRES R,TEIXID N,USALL J,et al.Anti-oxidant activity of oranges after infection with the pathogen Penicillium digitatum or treatment with the biocontrol agent Pantoea agglomerans CPA-2[J].Biological control.2011,57(2):103-109.
[33]DURAN D,HEIL M.Damaged-self recognition in common bean(Phaseolus vulgaris)shows taxonomic specificity and triggers signalling via reactive oxygen species(ROS)[J].Name:Frontiers in Plant Science.2014(5):414.
[34]CHALUTZ E,WILSON CL.Postharvest biocontrol of green and blue mold and sour rot of citrus fruit by Debaryomyces hansenii.[J].Plant Disease.1990,74(2):134-137.
[35]HELLWEGE E,ANDERSCH W,STENZEL K,et al.Compositions comprising a biological control agent and an insecticide[Z].US Patent,2015.
[36]ANDERSCH W,CURTISD,SHAOHUA G,et al.Compositions comprising a streptomyces-based biological control agent and a fungicide[Z].Google Patents,2014.
[37]WACHENDORFF-NEUMANN U,ANDERSCH W,SPRINGER B,et al.Composition comprising a biological control agent and a fungicide selected from inhibitors of amino acid or protein biosynthesis and inhibitors of cell wall synthesis[Z].US Patent,2014.
[38]BROWN EW,ZHENG J,Enurah A.Paenibacillus alvei strain ts-15 and its use in controlling pathogenic organisms on crops[Z].US Patent,2014.
[39]LWVY M,GAFIN A.Pseudozyma aphidis As A Biocontrol Agent Against Various Plant Pathogens[Z].Google Patents,2014.
