四川省引进外种猪群体的ESR基因PvuⅡ位点多态性分析
2015-12-27张培文巫小倩张顺华
张培文,赵 雪,何 玲,巫小倩,张顺华,朱 砺
(四川农业大学动物科技学院,四川雅安 625014)
四川省引进外种猪群体的ESR基因PvuⅡ位点多态性分析
张培文,赵 雪,何 玲,巫小倩,张顺华,朱 砺*1
(四川农业大学动物科技学院,四川雅安 625014)
采用PCR-RFLPs方法,对四川引进外种猪(杜洛克、长白猪和约克夏)ESR基因的多态性进行研究。并对ESR基因的基因频率和基因型频率进行分析,结果表明:杜洛克出现了AA、AB、BB3种基因型,基因型频率分别为76.32%、18.42%和5.26%,A、B基因频率分别为85.53%和14.47%;长白猪中仅出现AA和AB2种基因型,且基因型频率分别为67.74%和32.26%,其中,等位基因A、B频率分别为83.87%和16.13%;在约克夏中存在AA、AB、BB3种基因型,频率分别为22.22%、61.90%和15.87%,等位基因A与等位基因B频率相当,分别为53.18%和46.82%。
杜洛克;长白猪;约克夏;ESR基因;PCR-RFLP
0 引言
猪是世界上最重要的肉用动物之一,而中国既是养猪大国,也是猪肉消费大国。但在我国养猪业中,处于繁育体系“金字塔”顶端的核心种质群一直处于较为薄弱的状态,对引种的依赖性较强。为了摆脱“引种-退化-再引种”的不良循环,我们应加强对引进种猪的再一次选育[1]。
猪的产仔数是极其重要的经济性状,提高母猪产仔数可增加商品肉猪的产量,给现代养猪业带来非常大的经济效益。目前,关于猪产仔数的研究中,报道了大量的主基因,如雌激素受体(ESR)基因、催乳素受体(PRLR)基因、卵泡促激素β亚基(FSHβ)基因、备解素(OPN)基因等。ESR基因是影响繁殖性能的重要功能基因,且该基因在国内外被广泛研究,并运用于后备种猪的标记辅助选择(MAS)[2-4]。
1994年, 美 国Iowa大 学 的Rothschild等[5-7]发现了猪雌激素受体基因(Estrogen receptor gene, ESR),并确定其是产仔数性状的主效基因或者是与产仔数主效基因紧密连锁的基因,并且找到了将ESR基因酶切为AA、AB、BB3种基因型的多态性位点PvuⅡ,研究发现,BB为优势基因型,且不同基因型的繁殖性能表现为BB>AB>AA的趋势;等位基因B为优势基因。在此之后,大量的对不同猪种的研究得出了相同结论,尽管所研究的这些猪种存在着不同的遗传背景[8-9]。本次试验以319头种猪(包括杜洛克38头、长白猪155头,约克夏126头)的耳组织为样本,提取耳组织中的DNA,采用PCR-RFLP分型技术对ESR基因进行检测,从而分析引进种猪的ESR基因分布情况。
1 材料与方法
1.1 试验材料
试验材料来自四川某猪育种公司核心育种场新引进的种猪耳组织样品(包括杜洛克38头、长白猪155头、约克夏126头)。-20 ℃下75%酒精保存,用于基因组DNA制备。
1.2 试验方法
1.2.1 DNA提取
取火柴头大小的猪耳组织样品,放于75%的酒精中洗净,在1.5 mL的离心管中剪碎,利用TIANGEN DNA提取试剂盒提取DNA,按照试剂盒步骤操作。获取的DNA样品放置于-20℃保存备用。
1.2.2 PCR扩增反应
引物合成。PCR引物序列参照文献[7],引物由华大基因合成:
Forward primer:5’-CCTGTTT TTACAGTGACTTTTACAGAG-3’
Reverse primer:5’-CACTTCGA GGGTCAGTCCAATTAG -3’
ESR基因的扩增,扩增反应总体积为25μL,其中TIANGEN 2×PreMasterMix 12.5μL;上游引物1μL;下游引物1μL;DNA模板2μL;DEPC水8.5μL。ESR基 因反应条件:第1步94℃预变性3min,第2步94℃变性30 s,第3步退火60 ℃ 30 s,第4步72 ℃延伸5 min,重复第2步到第4步35个循环,最后再72℃延伸5 min,于12 ℃保存。PCR产物于2%琼脂糖凝胶电泳检测,紫外检测仪检测照相并分析。
1.2.3 PvuⅡ酶切与电泳检测
利用PvuⅡ酶对反应所得120bpESR基因进行酶切,整个反应体系为15μL,包括酶切反应缓冲液buffer1.5μL;扩增产物溶液10μL;限制性内切酶PvuⅡ0.5μL;加DEPC水至15.0μL。将混合液于37℃条件下水浴过夜(8 h以上)。将酶切后产物利用3%的琼脂糖凝胶电泳检测,紫外灯检测仪检测照相并分析。
2 结果与分析
2.1 ESR的PCR扩增
抽取PCR扩增产物,用2%琼脂糖凝胶电泳检测基因的目的片段,所得片段大小120 bp(图1)。图谱上观测无弥散和拖尾现象,表明扩增目的条带效果良好,与期望结果一致。
2.2 ESR基因的酶切电泳分析
通过限制性内切酶PvuⅡ酶切,可能出现3种结果,分别为AA(120bp/120bp)、AB基 因 型(120bp/65bp、55bp)和BB基因型( 65bp、55bp/65bp、55bp)。本试验中,杜洛克(见图2)、约克夏(见图4)均出现了AA、AB、BB 3种基因型、而长白猪(见图3)仅出现了AA、AB 2种基因型。(本次试验中,由于所用琼脂糖浓度较低,且电泳时间较短,导致55bp与65bp片段未分开)
2.3 ESR基因的群体遗传特性分析
对杜洛克、长白猪、约克夏种猪的ESR基因利用PCR-RFLP技术进行基因分型,根据文献中基因分型的判定标准[6],3个猪种ESR基因的基因型分布以及群体遗传特性分析结果见表1。总样本含量319头,包括杜洛克38头、长白猪155头,约克夏126头。
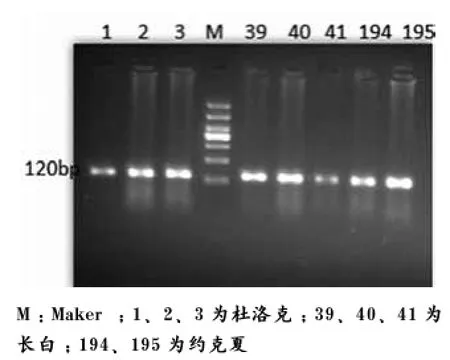
图1 ESR基因PCR产物电泳的结果
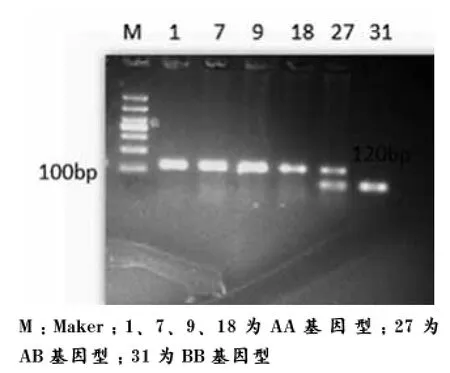
图2 杜洛克ESR基因PCR-RFLPs 3%琼脂糖凝胶电泳

图3 长白猪ESR基因PCR-RFLPs 3%琼脂糖凝胶电泳
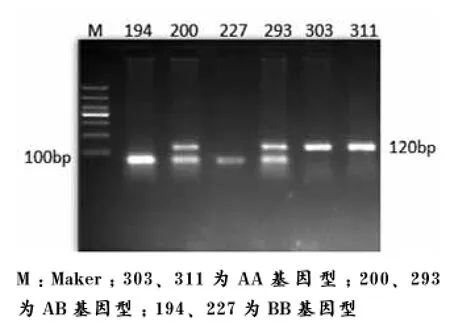
图4 约克夏ESR基因PCR-RFLPs 3%琼脂糖凝胶电泳
由表1可知,杜洛克出现3种基因型,其中AA基因型频率最高,为76.32%,其次为AB型,基因型频率为18.42%,BB基因型仅为5.26%;且其A等位基因频率高达85.53%。长白猪中,仅出现AA和AB 2种基因型,且AA基因型频率为67.74%,AB基因型为32.26%;其中等位基因A的频率为83.87%,等位基因B的频率为16.13%。在约克夏中,基因型频率最高的为AB基因型,频率为61.90%,紧接着为AA基因型,为22.22%,最低的为BB基因型,频率为15.87%,在约克夏中,等位基因A与等位基因B频率相当,分别为53.18%和46.82%。
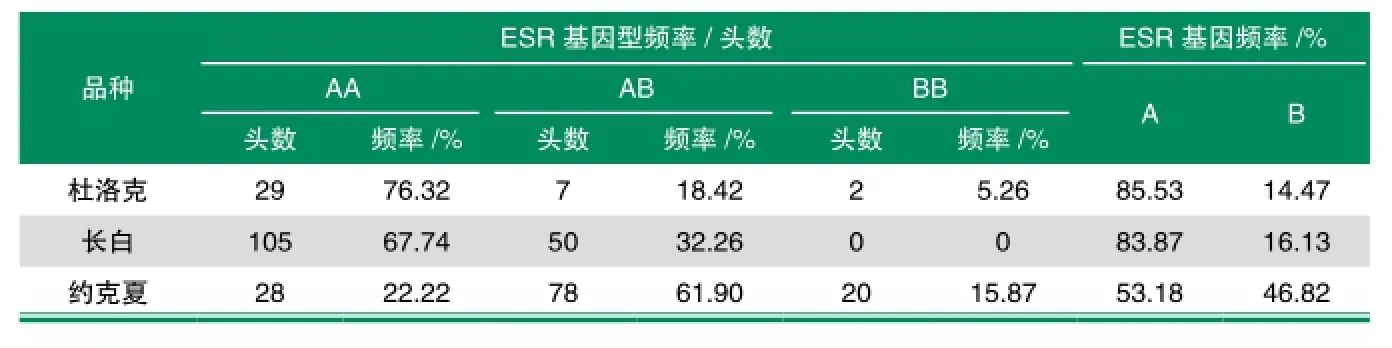
表1 ESR基因的基因频率和基因型频率的分布
3 讨论
本次试验所测得杜洛克等位基因B的频率为14.47%,比田勇等[10]研究的47.06%低,而李凤娥等[11]2000年试验得出杜洛克B基因的频率为0。在对长白猪的研究中,本次试验所得B基因频率为16.13%,之前有大量关于长白猪的研究中分别得出其等位基因B频率为7.69%、19%、10%等[12]。对约克夏的研究中,张淑君等[13]报道了其B基因频率为47.06%,后来田勇等[10]研究得出了相同结果,而本试验中,所得B等位基因频率为46.82%,比前人研究略低。导致这种结果的原因可能是试验猪群以及样本大小存在差异等。
ESR基因是影响猪繁殖性能的主效基因,是目前为止选择产仔数最好的标记。据前人研究得出猪产仔数与ESR基因型之间有BB>AB>AA的趋势[5-7]。刘建华等[14]对杜洛克、长白猪和约克夏ESR基因进行了研究,发现ESR基因对猪头胎产仔数有显著影响,BB和AA纯合子头胎总产仔数与活产仔数分别相差3.361和1.1913,每个等位基因B的加性效应分别是1.680和0.597。田勇等[10]研究发现,在杜洛克中,初产胎次B基因的加性效应为3.56和2.10,在经产胎次中B基因的加性效应为1.90和1.38;在长白猪中,初产胎次B基因的加性效应为2.70和1.25,在经产胎次中B基因的加性效应为1.62和2.24;在杜洛克中,初产胎次B基因的加性效应为2.29和1.92,在经产胎次中B基因的加性效应为0.76和1.15。
在本试验中,在杜洛克、长白以及约克夏3个猪种中BB基因型频率均低,分别为5.26%、0、15.87%;且在杜洛克与长白猪中,AA基因型频率均大于60%;而在约克夏中AB基因型为主要基因型,占到61.90%。通过以上数据,我们可以对引进的这一批种猪的繁殖性能有一个大概的了解。我们应综合种猪的其他性状,并对ESR基因的优势等位基因B进行保留,对引进的种猪进行再一次选育。猪的繁殖性状属于低遗传力性状,非遗传效应对其影响较大。因此,除了坚持遗传标记辅助选择外,还需要注意为种猪提供较好的营养、防疫及饲养环境等其他综合的非遗传条件,以确保种猪的最佳繁殖性能。
[1] 施启顺. 猪的分子标记辅助育种[J]. 国外畜牧学: 猪与禽, 2001( 2): 21-23.
[2] Drogemuller C, Hamann H, Distl O. Candidate gene markers for litter size in different German pig lines[J]. Journal of animal science, 2001,79(10): 2565-2570.
[3] Rybalko V P,Semenov V V,Rachkov I G, et al. Polymorphism of H-FABP and ESR genes and their role in forming productivity of pig meat breeds[J]. Russian Agricultural Sciences, 2012,38(5-6): 393-395.
[4] 张晓东,王恒,丁月云,等.安徽省 4个地方猪种 ESR 和 FSHβ 基因多态性及其与产仔数的关联分析[J]. 安徽农业大学学报, 2014, 41(4): 579-584.
[5] Rothschild M F,Larson R G,Jacobson C et al.Pvu II polymorphisms at the porcineoes trogen receptor locus (ESR)[J].Animal genetics,1991,22(5):448-448.
[6] Rothschild M F, Jacobson C, Vaske D A, et al.A major gene for litter size in pigs[C]//Proceedings of the 5th world congress on genetics applied to livestock production. Guelph, 1994, 21: 225-228.
[7] Short T H, Rothschild M F,Southwood O I, et al. Effect of the estrogen receptor locus on reproduction and production traits in four commercial pig lines[J]. Journal of Animal Science,1997, 75(12):3138-3142.
[8] 陈克飞, 李宁. 猪雌激素受体 (ESR)基因对产仔数性状的影响[J].遗传学报,2000,27(10): 853-857.
[9] 李明洲, 张凯,李学伟,等.中国地方猪种ESR基因PvuⅡ多态性及其与产仔数关系的研究[J]. 四川农业大学学报,2003,21(3):258-262.
[10] 田勇,李学伟,李芳琼,等.四川省外种猪ESR基因对繁殖及生长性状的影响[J]. 黑龙江畜牧兽医,2004 (10):12-14.
[11] 李凤娥,熊远,邓昌彦,等.猪品种间ESR 基因 PCR-RFLP 的初步研究[J].华中农业大学学报,2000,19(1):37-39.
[12] WU Z F,LIU D W,WANG Q L,et al. Study on the Association Between Estrogen Receptor Gene(ESR)and Reproduction Traits in Landrace Pigs[J].Acta Genetica Sinica, 2006,33(8):711-716.
[13] 张淑君,肖森木,夏瑜,等.母猪的二个基因位点的多态性及其与产仔数连锁关系研农业大学学报,2001,19(1):73-76.
[14] 刘建华,曹果清,李步高,等.山西省外种猪雌激素受体基因多态性及其与产仔性状关联性的研究[J].吉林畜牧兽医,2006,27(7):7-9.
2014-02-09)
国家科技支撑计划项目(编号:2013BAD20B07),四川省科技支撑计划项目(编号:2013NZ0041),科技部和四川省科技富民强县项目资助
朱砺,教授,博士生导师,研究方向:猪的遗传育种
