来自鹿粪便中1株芽孢杆菌的鉴定及抗真菌肽发酵条件研究
2015-12-26翟艺梁小波
翟艺,梁小波
(昆明理工大学食品安全研究院,云南昆明 650500)
来自鹿粪便中1株芽孢杆菌的鉴定及抗真菌肽发酵条件研究
翟艺,梁小波
(昆明理工大学食品安全研究院,云南昆明 650500)
以来自鹿粪便中1株芽孢杆菌为试验菌株,在分子水平上通过16S rDNA同源性序列分析、比较、鉴定,并通过形态观察、革兰氏染色、芽孢染色、生理生化实验,初步确定该菌株为枯草芽孢杆菌J-2。分析影响芽孢杆菌J-2产生抗真菌肽的主要因素,通过正交优化实验得出,芽孢杆菌J-2产生抗真菌肽的最佳发酵条件为500 mL的锥形瓶中加入150 mL初始pH为7.0的PDL(200)培养基,接入9%的液体菌种,在温度为37℃条件下发酵24 h。
芽孢杆菌;鉴定;抗真菌肽;发酵
长期以来,农业生产中防治病虫害的方法主要是通过施加或喷洒化学农药来进行[1]。化学农药的滥用或不合理使用一方面对农作物产生了高毒、高残留等诸多问题,严重污染了土壤、水体和大气,甚至破坏了原有的生态平衡[2];另一方面也不断增强了一些病菌和害虫的抗药性,使农药的使用量与使用频度交替上升、恶性循环,农药在农产品中残留量不断增加,极大威胁了人类及牲畜的安全。2012年4月,英国牛津大学、伦敦帝国学院和美国一些大学的科学家在权威科学杂志《Nature》上报道,导致部分动植物物种灭绝的主要原因是传染病,其中70%是由真菌引起。受人类贸易活动、旅行和气候变化影响,真菌对人类食物供应和生物多样性的威胁增大。真菌引起的植物病害现已成为经济农作物稳产、高产、优产的主要障碍,利用有益微生物防治植物病害是有效途径之一[3]。由枯草芽孢杆菌研发的杀菌剂具有较好的综合优势,在安全性、兼容性等方面而更符合有害生物综合治理(IPM)要求。2014年,我们从鹿粪便中分离到1株对多种植物病原菌均具有强烈抗性的菌株,通过形态观察、革兰氏染色、生理生化试验等初步确定该菌株为芽孢杆菌,在分子水平上通过16S rDNA同源性序列分析,比较该菌与枯草芽孢杆菌、解淀粉芽孢杆菌、地衣芽孢杆菌及其它相近菌种的同源性,根据不同菌种之间部分特异性基因序列的差异进行了鉴定,以期为利用其研制环保、节能、高效的生物农药和相关产品提供依据。
1 材料与方法
1.1 供试材料
供试芽孢杆菌由实验室自行分离筛选。病原指示菌为白色念珠菌,鉴定菌种为枯草芽孢杆菌(Bacillus.subtilis AS 1.1159)、解淀粉芽孢杆菌(Bacillus.amyloliquefaciens AS 1.1131)均购自中国普通微生物菌种保藏中心。
1.2 培养基
1.2.1 LB液体培养基向450 mL双蒸水中加入酵母粉2.5 g、胰蛋白胨5.0 g、氯化钠5.0 g,加热至溶解,冷却后经2%氢氧化钠调节pH为7.0,用双蒸水补至1 000 mL,121℃高压灭菌20 min。
1.2.2 LB固体培养基向450 mL双蒸水中加入酵母粉2.5 g、胰蛋白胨5.0 g、氯化钠5.0 g、琼脂5.0 g,加热至溶解,冷却后经2%氢氧化钠调节pH至7.0,用双蒸水补至1 000 mL,121℃高压灭菌20 min。
1.2.3 基础性培养基向450 mL双蒸水中加入磷酸氢二钾0.25 g、硫酸镁0.10 g、胰蛋白胨5.00 g,待其溶解后,经2%氢氧化钠调pH至7.0,补水至1 000 mL,121℃高压灭菌20 min。
1.2.4 PSL培养基(马铃薯蔗糖液体培养基)将200 g马铃薯去皮,切块后煮沸30 min,用4层纱布过滤,向滤液中加入蔗糖20 g,自然pH,补水至1 000 mL,115℃高压灭菌20 min。
1.2.5 PDP培养基(马铃薯葡萄糖胰蛋白胨液体培养基)将200 g马铃薯去皮,切块后煮沸30 min,用4层纱布过滤,向滤液中加入葡萄糖20 g、胰蛋白胨5 g,自然pH,补水至1 000 mL,115℃高压灭菌20 min。
1.2.6 PDL(200)培养基(马铃薯葡萄糖液体培养基)将200 g马铃薯去皮,切块后煮沸30 min,用4层纱布过滤,向滤液中加入葡萄糖20 g,自然pH,补水至1000mL,115℃高压灭菌20min。
1.2.7 PDL(500)培养基(马铃薯葡萄糖液体培养基)
将500g马铃薯去皮,切块后煮沸30 min,用4层纱布过滤,向滤液中加入葡萄糖20 g,自然pH,补水至1000mL,115℃高压灭菌20min。
1.2.8 NB培养基(营养肉汤)向450 mL双蒸水中加入牛肉膏1.5 g、氯化钠2.5 g、胰蛋白胨5.0 g,待其溶解后经2%氢氧化钠调pH至7.0,补水至1 000 mL,121℃高压灭菌20 min。
1.3 试验方法
1.3.1 形态观察与染色利用光学显微镜测量菌体直径、观察形态;参照相关文献进行革兰氏染色、芽孢染色[4]。
1.3.216 S rDNA PCR扩增和序列测定采用Emblye法,对该芽孢杆菌进行16S rDNA扩增反应,根据CTAB法提取芽孢杆菌DNA并将其作为PCR扩增反应的模板[5]。电泳反应30 min,通过凝胶成像系统观察电泳结果并对PCR产物纯化。然后与pUCm-T载体连接,16℃保温桶内连接过夜。将5 μL连接产物与100 μL感受态细胞在温度37℃、摇床转速150 r/min条件下反应1 h,取出后涂布于含1%Amp的LB固体培养基中进行转化,转化后提取质粒并委托测序。将所得1444bp序列放入NCBI中进行同源性分析,利用软件MEGA 5.0构建系统发育树。
1.3.3 形态比较及特异性基因序列分析在同一培养皿上分别对实验菌、枯草芽孢杆菌(Bacillus. subtilis As 1.1159)和解淀粉芽孢杆菌(Bacillus.amyloliquefaciens AS 1.1131)进行划线培养,在温度37℃下培养24 h后,观察形态。根据不同芽孢杆菌基因序列位置不同鉴定。采用CTAB法提取上述3种菌的染色体DNA,并将其作为PCR反应的模板DNA,电泳反应30 min,通过凝胶成像系统观察电泳结果。
1.3.4 芽孢杆菌J-2发酵上清液的获得在LB固体培养基中挑取芽孢杆菌J-2单菌落,接种至100 mLLB液体培养基中(250 mL锥形瓶),在温度37℃、摇床转速150 r/min下发酵24 h,获得菌株J-2的发酵液。
1.3.5 碳源种类的影响将碳源1%的葡萄糖、1%的淀粉加入基础性培养基中,再接种含量7%的芽孢杆菌J-2种子发酵液,在温度37℃、摇床转速150 r/min下发酵24 h,并在温度4℃、转速13 000 r/min条件下离心1 min,取上清液,经0.22 μm孔径的无菌水系滤膜过滤,得到芽孢杆菌J-2无菌发酵上清液,以基础性培养基为对照,采用琼脂打孔扩散法测量其产生的抑菌圈直径[7]。
1.3.6 氮源种类的影响将氮源1%的葡萄糖+1%的硫酸铵、1%的可溶性淀粉+1%的硫酸铵、1%的葡萄糖+1%的氯化铵、1%的可溶性淀粉+1%的氯化铵分别替换基础性培养基中的胰蛋白胨,再接种含量7%的芽孢杆菌J-2种子发酵液,按1.3.5方法得到芽孢杆菌J-2无菌发酵上清液,以碳源培养基为对照,采用琼脂打孔扩散法测量芽孢杆菌J-2产生的抑菌圈直径。
1.3.7 培养基种类的影响将芽孢杆菌J-2种子发酵液按接种量7%接种至150 mL含大量碳源的培养基PDL(500)、PDL(200)、PDP、PSL和含大量氮源的培养基LB、NB中(250 mL锥形瓶),按1.3.5方法得J-2无菌发酵上清液,以基础培养基、碳源培养基、氮源培养基为对照,用琼脂打孔扩散法测量其产生的抑菌圈直径。
1.3.8 培养液初始pH的影响将芽孢杆菌J-2接种至100 mLPDL(200)培养基中发酵培养,初始pH分别调至5.0、6.0、7.0、8.0和9.0,将芽孢杆菌J-2种子发酵液按接种量7%接种至150 mLPDL(200)培养基中(250 mL锥形瓶),按1.3.5方法得到芽孢杆菌J-2无菌发酵上清液,取无菌发酵上清液调pH至7.0,用琼脂扩散法测量其芽孢杆菌J-2产生的抑菌圈直径。
1.3.9 发酵温度的影响将芽孢杆菌J-2接种至100 mL PDL(200)培养基中发酵培养,发酵温度分别取23、30、37、44、51℃。按1.3.5方法得到芽孢杆菌J-2无菌发酵上清液,测量其产生的抑菌圈直径。
1.3.10 发酵时间的影响将芽孢杆菌J-2接种至100 mL PDL(200)培养基中发酵培养,将芽孢杆菌种子发酵液按7%接种量接种至150 mL PDL(200)培养基中(250 mL锥形瓶),在温度37℃、摇床转速150 r/min条件下分别发酵18、24、30、36、42、48、54 h,按1.3.5方法得到芽孢杆菌J-2无菌发酵上清液,以基础性培养基为对照,采用琼脂打孔扩散法测量其产生的抑菌圈直径。
1.3.11 发酵条件正交优化实验结合各单因素实验,选择PDL(200)、PDL(500)、PSL和PDP为培养基的4个水平,培养基初始pH水平为6.0、7.0、8.0、9.0时,选择时间为18、24、30、36 h,装液量定为50、100、150、200 mL(500 mL锥形瓶),接种量水平为3%、5%、7%、9%。对5因素的4个水平分别取值(表1),利用正交表L1645(5因素4水平)实验,温度37℃、摇床转速150 r/min条件下培养芽孢杆菌J-2。收集各发酵条件下的芽孢杆菌J-2无菌发酵上清液,以白色念珠菌为指示菌,用琼脂打孔扩散法分别测量它们产生的抑菌圈直径大小,通过方差分析得到芽孢杆菌J-2产生抗真菌肽的较优条件。

表1 正交实验因素
2 结果与分析
2.1 芽孢杆菌J-2的分类鉴定
2.1.1 个体形态特征及菌落特征如图1所示,菌株J-2在LB培养基上显示为不透明白色、表面粗糙、边缘不规则、不产生色素、短杆状,兼性厌氧,具有运动性。革兰氏染色呈阳性,色均匀,可形成内生芽孢,游离芽孢囊椭圆形膨大,表面不易着色。
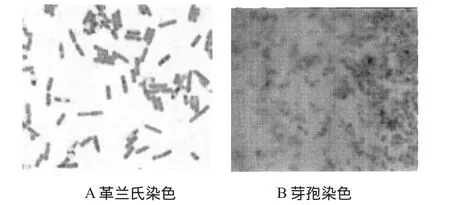
图1 菌株J-2染色形态
2.1.216 S rDNA同源性的鉴定菌株J-2染色体DNA用PCR扩增出单一条带,PCR产物回收纯化后,经DNA测序,序列长度为1444 bp。与多种芽孢杆菌同源性的比较数据(表2)表明,菌株J-2与枯草芽孢杆菌的同源性高达99.62%,与解淀粉芽孢杆菌同源性达到99.23%,初步推断该菌为枯草芽孢杆菌或解淀粉芽孢杆菌。通过构建的系统发育树(图2)可以看出,菌株J-2与B.subtilis位于同一分支、同一种属,与枯草芽孢杆菌、解淀粉芽孢杆菌的同源性均达到99%以上。

表2 J-2与其他相近芽孢杆菌的同源性

图2 以16S rDNA序列为基础的J-2菌系统发育树
2.1.3 与枯草芽孢杆菌和解淀粉芽孢杆菌形态比较将菌株J-2、枯草芽孢杆菌(B.Subtilis AS 1.1159)和解淀粉芽孢杆菌(B.amyloliquefaciens AS 1.1131)在37℃恒温培养箱内培养20 h,可以看出,菌株J-2生长更旺盛,繁殖速度较快,菌株J-2与枯草芽孢杆菌表面较为粗糙,解淀粉芽孢杆菌表面相对光滑(图3),菌株J-2的形态与枯草芽孢杆菌更加相近。

图3 J-2菌与枯草芽孢杆菌和解淀粉芽孢杆菌形态比较
2.1.4 特异性基因序列的分析从图4可以看出,枯草芽孢杆菌和解淀粉芽孢杆菌的部分基因顺序明显不同。在枯草芽孢杆菌中,基因yyaR位于tetB-tetL的下游2003 bp处,而基因yyaO位于tetB(L)的上游并与之相邻。在解淀粉芽孢杆菌中,yyaR位于tetB-tetL的上游并且与之相邻。据此设计两对引物YyaO-F/TetB-R与YyaR-F/TetB-R用于PCR扩增,其中正向引物YyaO-F和YyaR-F分别来自yyaO和yyaR两个基因的3'末端,反向引物TetB-R来自基因tetB的5'末端。OlegN.Reva等已经成功地利用这两对引物对多个可能为枯草芽孢杆菌或解淀粉芽孢杆菌的菌种进行鉴定[6]。扩增产物通过1%的琼脂糖凝胶电泳,经凝胶成像系统成像后的结果如图5所示,当以YyaO-F/TetBR作为引物时,解淀粉芽孢杆菌能够扩增,而该菌和枯草芽孢杆菌不能扩增,可见该菌与解淀粉芽孢杆菌在这一基因区域内,基因序列可能存在明显的差异;以YyaR-F/TetB-R作为引物时,解淀粉芽孢杆菌不能被扩增而该菌和枯草芽孢杆菌均能扩增。表明该菌和枯草芽孢杆菌的这一特异性的基因序列相似。综合分析,确定该菌为枯草芽孢杆菌。

图4 枯草芽孢杆菌与解淀粉芽孢杆菌部分序列的差异
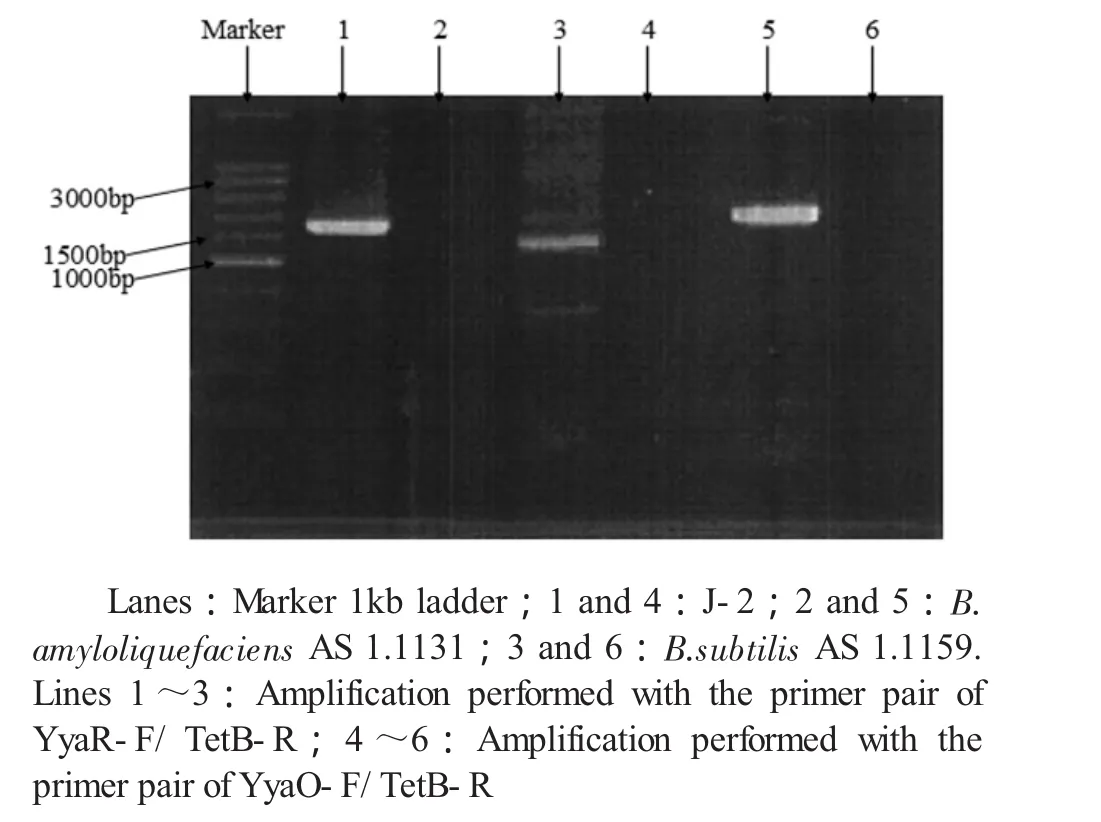
图5 PCR扩增产物的琼脂糖凝胶电泳图
2.2 各条件对芽孢杆菌J-2产生抗真菌肽的影响
2.2.1 碳源种类将芽孢杆菌J-2在不同碳源培养基培养,分别记录12、24 h时芽孢杆菌J-2的生长状况。从表3可以看出,与对照培养基比较,J-2发酵液较黏,抑菌圈直径明显增大。可见增加碳源有利于芽孢杆菌J-2产生抗真菌肽,但碳源的种类对抗真菌肽的产生没有明显影响。在产生抗真菌物质方面,碳氮比减小利于抗真菌物质产生,碳氮比增大更易产生抗真菌肽,原因是芽孢杆菌J-2在代谢过程中糖类的合成利于该抗真菌肽产生。

表3 碳源种类的影响
2.2.2 氮源种类从表4可以看出,氮源几乎不影响抗真菌肽的产生,芽孢杆菌J-2可以利用无机氮源或有机氮源,有利于扩大生产抗真菌肽。

表4 氮源种类的影响
2.2.3 培养基种类从图6可以看出,培养基种类对芽孢杆菌J-2发酵上清液抑菌圈直径有一定的影响。LB、NB和基础培养基氮源丰富,菌株生长良好,稀发酵液利于分离发酵产物,但明显小于碳源培养基丰富条件下的芽孢杆菌J-2发酵上清液产生的抑菌圈直径。芽孢杆菌J-2在碳源物质的PDL(200)、PDL(500)、PSL和PDP培养基中生长状况优于在氮源丰富的培养基,且抑菌圈直径要明显大,所以用含丰富碳源的培养基利于其产生抗真菌肽。合成培养基和碳源天然培养基对芽孢杆菌J-2发酵上清液抑菌圈直径的影响(表5)表明,芽孢杆菌J-2发酵上清液抑菌圈在天然碳源培养基培养直径更大,抗真菌活性更强,利于抗真菌肽的产生,且成本低。综上所述,正交实验的培养基因素的4个水平宜采用含有丰富碳源的天然培养基PDL(200)、PDL(500)、PSL和PDP。
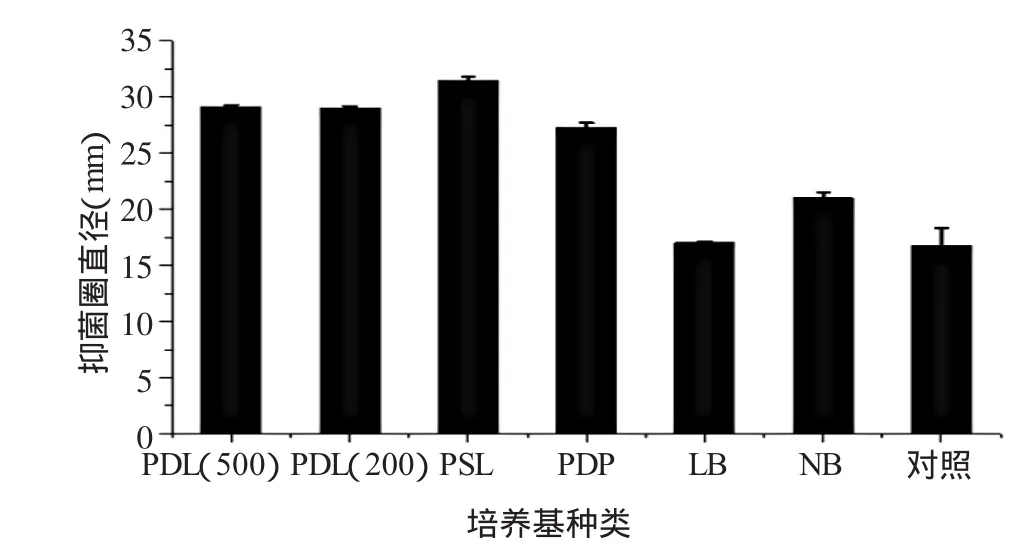
图6 培养基种类对抑菌圈直径的影响

表5 合成培养基与天然培养基对抑菌圈直径影响
2.2.4 培养基初始pH图7表明,培养基初始pH对芽孢杆菌J-2发酵上清液抑菌圈直径有一定的影响。pH为7.0时,芽孢杆菌J-2发酵上清液抑菌圈直径、抗真菌活性均达到最大,此条件有利于抗真菌肽的产生。pH为6.0、8.0、9.0时,芽孢杆菌J-2发酵上清液抑菌圈直径、抗真菌活性无明显的变化。pH为5.0时,抑菌圈直径明显减小,抗真菌活性明显减弱,不利于抗真菌肽的产生。说明培养基初始最佳pH为6.0、7.0、8.0、9.0。

图7 培养基初始pH对抑菌圈直径的影响
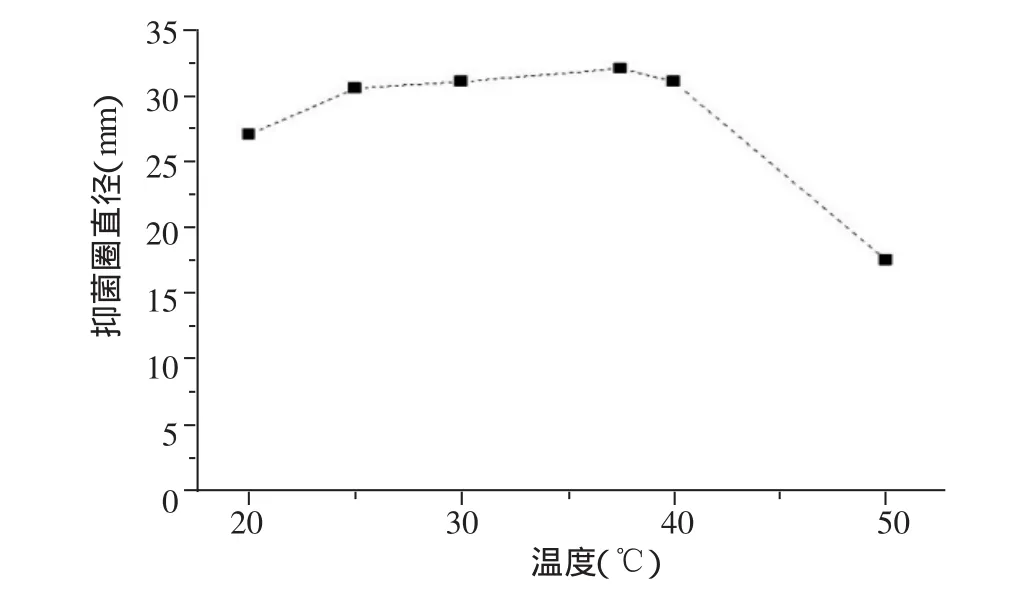
图8 发酵温度对抑菌圈直径影响
2.2.5 发酵温度通过图8可以看出,发酵温度对芽孢杆菌J-2发酵上清液抑菌圈直径的影响不大,温度可以影响酶反应速率,但当培养温度超过40℃时,抑菌圈直径及其抗真菌活性将明显下降,故37℃为最佳发酵温度。
2.2.6 发酵时间从图9可以看出,芽孢杆菌J-2发酵上清液产生的抑菌圈直径在18~30 h时逐渐增大,而后随发酵时间增加而逐渐减小。说明正交实验的发酵时间因素的4水平以18、24、30、36 h为宜。
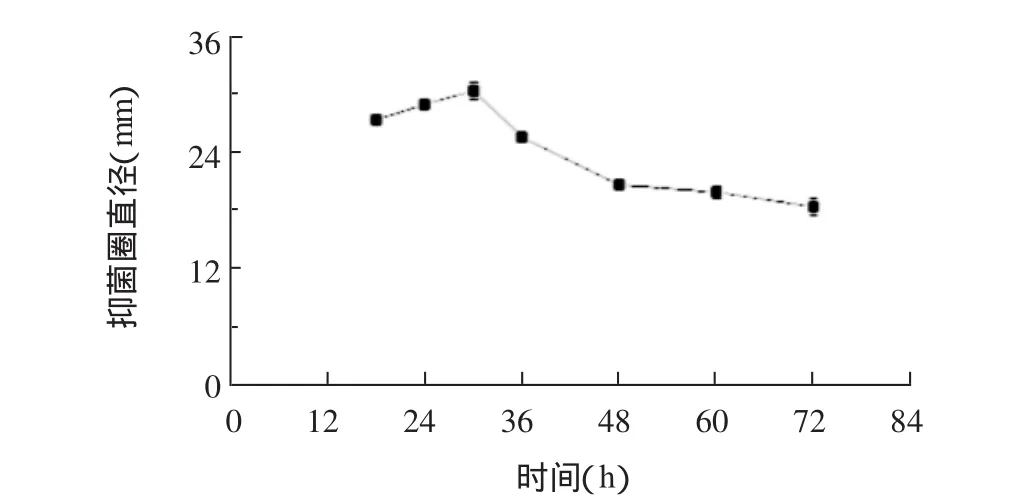
图9 发酵时间抑菌圈直径影响
2.2.7 芽孢杆菌J-2产生抗真菌肽发酵条件优化5因素对芽孢杆菌J-2产抗真菌肽的综合影响及极差分析如表6、表7所示。影响结果由大道小顺序为培养基、装液量、发酵时间、接种量、培养基初始pH。以芽孢杆菌J-2发酵上清液产生的抑菌圈直径大小作为衡量指标,经极差分析,得到关系图(图10),表明培养基为PDL(200)、pH7.0、发酵时间24 h、接种量9%、装液量为150 mL时,所得抑菌圈直径的和较其它水平下大,温度为30~40℃时影响最小。因此抗真菌肽的较佳发酵条件为500 mL的锥形瓶中加入150 mL初始pH为7.0的PDL(200)培养基,接入9%的液体菌种,在37℃条件下发酵24 h。

表6 因素对芽孢杆菌J-2产生抗真菌肽的综合影响

表7 极差分析结果①
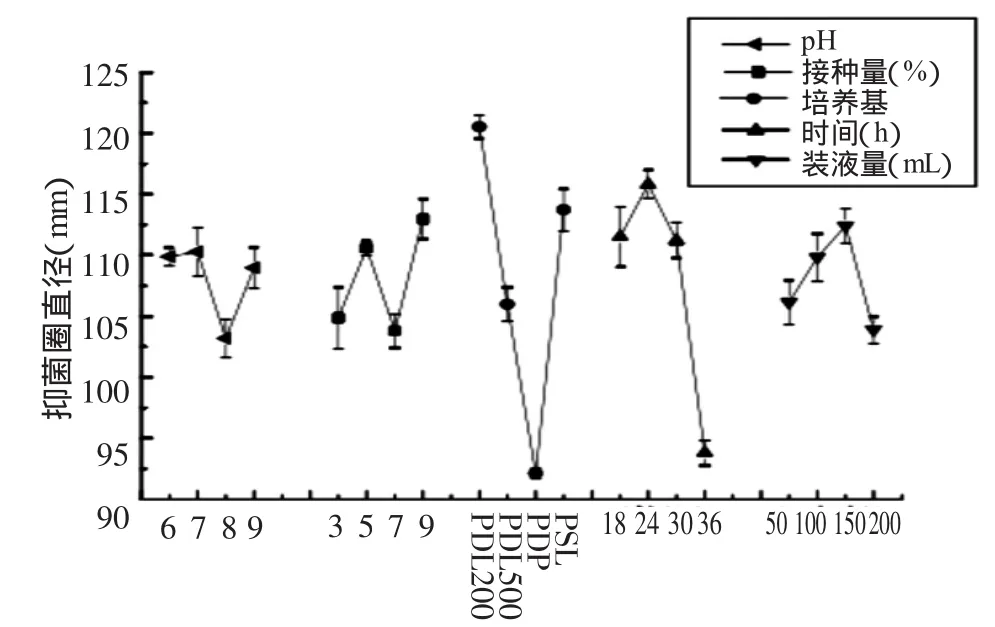
图10 发酵上清液抑菌圈直径总和与各水平之间的关系
3 小结
1)通过形态观察和染色、16SrDNA序列同源性分析等方法鉴定出从鹿粪便中分离出的菌株为枯草芽孢杆菌J-2。通过正交优化实验,得出芽孢杆菌
J-2产生抗真菌肽的水平由多个因素共同决定的,芽孢杆菌J-2抗真菌肽最佳发酵条件为500 mL的锥形瓶中加入150 mL初始pH为7.0的PDL(200)培养基,接入9%的液体菌种,在温度为37℃条件下发酵24 h。
2)本研究是在实验室条件下运用摇床发酵芽孢杆菌产生抗真菌肽,并将其培养基组成和培养发酵条件进行了初步优化,若想得到更优的发酵条件,还需在此基础上进一步优化。
[1]AGRIOS,G.Significance of plant diseases[M].Plant Pathology,1997:25-37.
[2]Al-REZA S M,RAHMAN A,AHMED Y.Inhibition of plant pathogens i vitro and in vivo with essential oil and organic extracts of Cestrum nocturnum L[J].Pesticide Biochemistry and Physiology,2010,96(2):86-92.
[3]刘志恒.现代微生物学[M].北京:科学出版社,2008:265-309.
[4]EMB1EY T M.The liner PCR reaction:a simple and robust method for sequencing amplified rRNA genes[J].Lett Appl Microbiol,1991(13):171-174.
[5]F.奥斯伯,R.布伦特,R.E.金斯顿.精编分子生物学实验指南[M].北京:科学技术出版社,2001:36-39.
[6]戒志梅.生物农药的现状、发展与展望[J].化工科技市场,2002(4):8-11.
[7]张国只,杨天佑.琼脂扩散法测定乳链菌肽效价的优化[J].食品科学,2007(3):175-178.
[8]SINGH N,PATERSON D L.Aspergillus infections in transplant recipients[J].Clinical Microbiology Reviews,2005,18(1):44-69.
[9]WALSH T J,ANAISSIE E J,DENNING D W.Treatment of aspergillosis:clinical practice guidelines of the infectious diseases society of america[J].Clinical Infectious Diseases,2008,46(3):327-360.
[10]ONGENA M,JACQUES P.Bacillus lipopeptides:versatile weapons for plant disease biocontrol[J].Trends in Microbiology,2008,16(3):111-125.
[11]KINSELLA K,SCHULTHESS C P,MORRIS T F. Rapid quantification of Bacillus subtilis antibiotics in the rhizosphere[J].Soil Biology and Biochemistry, 2009,41(2):374-379.
[12]ZHAO Z,WANG Q,WANG K.Study of the antifungal activity of Bacillus vallismortis ZZ185 in vitro and identification of its antifungal components[J].Bioresource technology,2010,101(1):292-297.
[13]LEE H,CHUREY J,WOROBO R.Purification and structural characterization of bacillomycin F produced by a bacterial honey isolate active against Byssochlamys fulva[J].Journal of applied microbiology,2008,105(3):663-673.
[14]郭坚华,李海峰,叶永浩.枯草芽孢杆菌7Ze3环二肽的分离与鉴定[J].江苏农业科学,2010(2):107-109.
[15]XU Z,ZHANG Y,FU H.Antifungal quinazolinones from marine-derived Bacillus cereus and their preparation[J].Bioorganic&medicinal chemistry letters,2011,21(13):4 005-4 007.
[16]刘涛,李占林,王宇.海洋细菌Bacillus subtilis次级代谢产物的研究[J].中国海洋药物,2009,28(5):1-6.
(本文责编:陈伟)
Research on Identification of Bacillus J-2 from Deer Feces and Fermentation Conditions of Antifungal Peptide
ZHAI Yi,LIANG Xiao-bo
(Institute of Food Safety,Kunming University of Science and Technology,Kunming Yunnan 650500,China)
In this study,with a strain of bacillus from deer feces as the test strains,we identified it as Bacillus subtilis J-2 by morphology,gram stain,spore stain,physiological and biochemical experiments,and it is analyzed,compared and identified by 16S rDNA sequence at the molecular level.the major factors which impact Bacillus J-2 generating antifungal peptides is analyzed by orthogonal optimization experiments,the optimum fermentation conditions of Bacillus J-2 generating antifungal peptides is derived,in 500 mL erlenmeyer flask is added 150 mL initial pH 7.0 PDL(200)medium access 9%liquid spawn,at the temperature of 37℃for fermentation.24 h.
Bacillus;Identification;Antifungal peptides;Fermentation
S852.61
A
1001-1463(2015)04-0011-07
10.3969/j.issn.1001-1463.2015.04.004
2015-03-03
国家自然科学基金“Rib蛋白在罗伊氏乳杆菌肠道粘附中的功能研究”(31360022)
翟艺(1990—),女,山东青岛人,硕士,主要从事菌种分离鉴定、发酵条件优化、蛋白纯化及表达研究工作。联系电话:(0)18314341075。E-mail:761671135@qq.com
梁小波(1974—),男,陕西咸阳人,副教授,博士,主要从事细菌细胞表面蛋白的功能研究工作。联系电话:(0)13211649827。E-mail:xbliangkmust@hotmail.com
