紫草提取物对疲劳大鼠的肝组织保护作用
2015-12-26徐小仙熊正英
徐小仙,熊正英
(1.西安石油大学体育部,陕西 西安 710065;2.陕西师范大学运动生物学研究所,陕西 西安 710062)
紫草提取物对疲劳大鼠的肝组织保护作用
徐小仙1,熊正英2
(1.西安石油大学体育部,陕西 西安 710065;2.陕西师范大学运动生物学研究所,陕西 西安 710062)
目的:通过观测耐力训练大鼠力竭和恢复24 h后肝组织及线粒体生化指标的变化,探讨紫草提取物在保肝护肝、提高运动能力、延缓运动疲劳、促进疲劳后恢复方面的生物学机理。方法:选取40 只Sprague-Dawley(SD)雄性大鼠,随机分为5 组,每组8只:训练对照组(A组)、运动力竭组(B组)、力竭恢复组(C组)、加药力竭组(D组)、加药恢复组(E组)。5 组大鼠按照训练模型进行为期6 周的跑台耐力训练,第6周的最后1 d,A组大鼠不进行训练,在安静状态下处死并进行样本处理和指标测定;B、C、D、E组大鼠进行一次性力竭运动后,处死B、D组大鼠并进行样本处理和指标测定;24 h后,处死C、E组大鼠并进行样本处理和指标测定。结果:大鼠在力竭运动后,肝组织抗氧化能力显著下降(P<0.05),一氧化氮合酶(nitric oxide synthase,NOS)活性和NO含量极显著降低(P<0.01),线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase活性显著降低(P<0.05),24 h后,各指标恢复不明显。补充紫草提取物的大鼠在力竭运动后,与运动力竭组大鼠相比,肝组织抗氧化能力、NOS活性和NO含量、线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase活性都显著升高(P<0.05);24 h后,各指标基本恢复到基础水平。结论:外源性补充紫草提取物可以有效调节NO的生成平衡,改善大鼠肝组织自由基清除和代谢水平,保护肝线粒体离子泵的活性和功能,能延缓运动疲劳的产生,促进运动后机体功能恢复。
紫草提取物;保护肝脏;抗疲劳
现代运动医学研究表明,高强度运动后产生过多的自由基可破坏机体细胞和组织以及生物膜系统,引起生物膜发生脂质过氧化反应,导致蛋白质变性、线粒体功能障碍等,造成胞浆中Ca2+堆积、细胞代谢障碍、线粒体呼吸链受损,进而导致肌肉收缩能力下降而产生疲劳感[1-2]。运动疲劳如果不及时消除,将会导致人体机能下降,使运动能力下降,甚至会导致过度疲劳,严重影响身体健康[3-4]。现代中医研究表明,运动疲劳和运动后恢复及五脏的调节密切相关,其根本在于肝脏调节功能的失常[5-6]。通过有针对性地补充外源性营养补剂或者药物活性成分,调节和保护肝脏功能,是延缓运动疲劳和促进运动后恢复的有效途径之一[7-9]。
紫草始载于《神农本草经》,其性寒,味甘、咸,具有凉血、活血、解毒透疹的功效,其富含的萘醌类化合物具有较好的保肝降酶等作用,是一种药用价值很高的植物[10-12]。本实验通过建立高强度跑台动物运动模型,探讨紫草提取物在保肝护肝、延缓运动疲劳、促进疲劳后恢复方面的生物学机理,为紫草作为运动补剂的开发提供实验依据。
1 材料与方法
1.1 动物、材料与试剂
健康雄性Sprague-Dawley(SD)大鼠40 只,体质量180~220 g,由西安交通大学医学院实验动物中心提供。
新疆紫草(Arnebia euchroma(Royle)Johnston)购于新疆参茸药业有限责任公司,经西北濒危药材资源开发国家工程实验室李恒朝教授鉴定为新疆紫草的根。标本号为NO20130827009,保存在陕西师范大学生命科学学院。
实验用标准品:紫草素、β-羟基异戊酰紫草素、异戊酰紫草素 上海纯优生物公司;乙酰紫草素、去氧紫草素、异丁酰紫草素、α-甲基-正丁酰紫草素 上海惠诚生物科技有限公司;β,β-二甲基丙烯酰紫草素 东京化成工业株式会社。以上所有对照品纯度都在95%以上。
石油醚、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、蔗糖 西安化学试剂厂;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、巯基(mercapto group,—SH)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、一氧化氮合酶(nitric oxide synthase,NOS)试剂盒、一氧化氮(nitric oxide,NO)试剂盒、Na+/K+-ATPase试剂盒、Ca2+/Mg2+-ATPase试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
旋转蒸发仪 上海亚荣生化仪器厂;752B型分光光度计 上海第三分析仪器厂;Agilent 1200型高效液相色谱仪 美国安捷伦公司;DD5低温高速离心机 湖南凯达科学仪器有限公司。
1.3 方法
1.3.1 紫草提取物的制备
参照文献[13]的方法,取紫草用臼杵研磨成粗粉,95%乙醇30 倍量(V/m)超声提取1 h,利用旋转蒸发仪低温回收溶剂,得浸膏并用水混悬后用30 倍量(V/m)的石油醚萃取3 次,回收溶剂得紫草提取物浸膏,出膏率为1.57%。临用前以生理盐水混悬,配成相应剂量。
1.3.2 紫草提取物有效成分测定[14]
采用高效液相色谱法(high performance liquid chromatography,HPLC)分析测定紫草提取物主要化学成分及含量,色谱条件:色谱柱为Scienhome Kromasil C18(4.6 mm×200 mm,5 μm)及预柱,流动相为乙腈(A)-0.3%磷酸(B),梯度洗脱,检测波长为274 nm,柱温为30 ℃,流速为1.0 mL/min。并取标准品制备对照溶液,经HPLC测定标准品溶液和紫草提取物悬混液,通过对比分析确定紫草提取物主要化学成分和含量。
1.3.3 动物分组
SD大鼠自由饮食、饲养温度(23±5) ℃、相对湿度40%~70%,照明随同自然变化。将大鼠随机分为5 组,每组8 只:训练对照组(A组)、运动力竭组(B组)、力竭恢复组(C组)、加药力竭组(D组)、加药恢复组(E组)。分笼适应性饲养7 d后进行实验。
1.3.4 运动模型的建立
5 组大鼠同时进行6 周的跑台训练,训练方案采用Bedford等[15]的跑台训练模型(表1),每周训练6 d,每天训练前以15 m/min的速率做5 min适应性运动后开始正式训练。取适量紫草提取物混悬于生理盐水中搅匀,每次运动训练结束后按照800 mg/(kg·d)[16]对大鼠进行灌胃(以体质量计,下同),灌胃剂量为2 mL。D、E两组灌胃紫草提取物,A、B、C 3 组灌胃等量生理盐水。在第6周最后1 d,A组大鼠不进行训练,在安静状态下处死,作为长时间训练的对照组;B、D组大鼠按照第6周强度运动至力竭并立即处死,作为力竭对照组;C、E组大鼠按照第6周强度运动至力竭并恢复24 h后处死,作为恢复对照组。
1.3.5 取材及样品制备
所有大鼠在处死前禁食12 h,处死后立即进行样本采集、处理和指标测定。
肝组织线粒体及匀浆的制备[17]:大鼠断头处死后,迅速取出肝脏,用预冷的缓冲液(含250 mmol/L蔗糖、1 mmol/L EDTA、10 mmol/L Tris-HCl(pH 7.5))洗净血液,剪去黏连的组织,用滤纸轻轻吸干表面水分,称取0.3 g肝脏转入小烧杯中,在冰浴中剪碎肝脏,制成10%的肝匀浆,4 ℃、2 000 r/min离心10 min,弃去沉淀部分,再将上清液10 000 r/min离心15 min,所得沉淀物即为肝脏线粒体。线粒体采用超声波法裂解。裂解后线粒体均用考马斯亮蓝法测定蛋白质含量。取肝左叶相同部位称质量后用生理盐水制备5%的匀浆,2 000 r/min离心10 min取上清液,备用。
1.3.6 指标测定方法
力竭时间测定:B、C、D、E组大鼠按照第6周强度运动至力竭,并记录力竭时间。力竭判断标准[18]:运动过程中大鼠跟不上预定速率,臀部压在笼具后壁,后肢随转动皮带后拖达30 s,毛刷刺激驱赶无效即为力竭。大鼠力竭行为特征表现为呼吸急促、精神疲倦,俯卧位垂头,刺激后无反应。
—SH、MDA、NO含量及SOD、GSH-Px、NOS、Na+/K+-ATPase、Ca2+/Mg2+-ATPase活力等指标测定均严格按照试剂盒说明书方法进行。
1.4 数据处理
数据用SPSS 12.0软件包处理进行分析,组间比较采用t检验,实验数据用±s表示。
2 结果与分析
2.1 紫草提取物中萘醌的含量
经HPLC测定标准品溶液和紫草提取物悬混液,通过对比分析确定紫草提取物主要化学成分为紫草素(1)、β-羟基异戊酰紫草素(2)、乙酰紫草素(3)、去氧紫草素(4)、异丁酰紫草素(5)、β,β-二甲基丙烯酰紫草素(6)、α-甲基-正丁酰紫草素(7)和异戊酰紫草素(8)。以上8 种萘醌类化合物在紫草提取物中含量为65.73 mg/100 mg,在紫草生药中含量为0.368 mg/100 mg,具体数据见表2,由此可知紫草提取物中主要化学成分为萘醌类化合物。

表2 紫草提取物中8 种萘醌类成分的含量Table 2 Contents of eight naphthoquinone in gromwell root extract mg/100 mg
2.2 紫草提取物对大鼠力竭和恢复24 h后肝组织抗氧化能力的影响
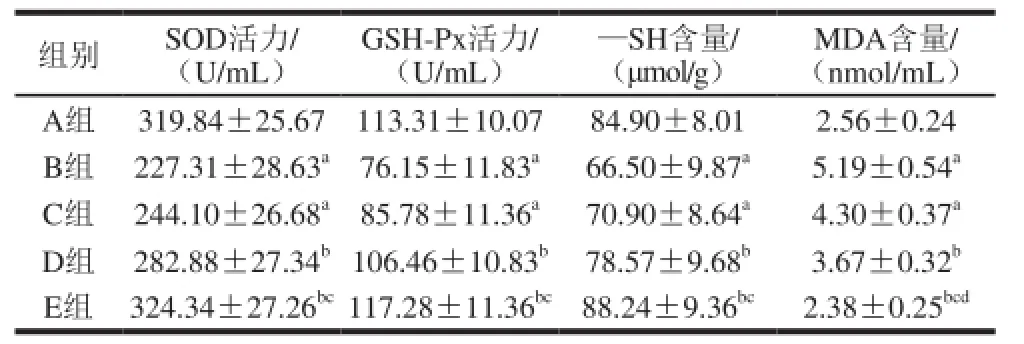
表3 各组大鼠肝组织抗氧化能力的比较(x±s,n=8)Table 3 Antioxidant capacity of hepatic tissue in the rats from each group (x±s,n= 8)
由表3可知,力竭运动后,B组大鼠肝组织SOD、GSH-Px活力和—SH含量显著低于A组(P<0.05),MDA含量显著高于A组(P<0.05)。C组大鼠肝组织SOD、GSH-Px活力和—SH含量显著低于A组(P<0.05),MDA含量显著高于A组(P<0.05)。D组大鼠肝组织SOD、GSH-Px活力和—SH含量显著高于B组(P<0.05),MDA含量显著低于B组(P<0.05)。E组大鼠肝组织SOD、GSH-Px活力和—SH含量显著高于B组和C组(P<0.05),MDA含量显著低于B、C、D组(P<0.05)。
2.3 紫草提取物对耐力训练大鼠肝组织NO-NOS体系和肝线粒体ATPase活性的影响

表4 各组大鼠肝组织NO-NOS和肝线粒体ATPase活性的比较(x±s,n=8)Table 4 NO-NOS in hepatic tissue and ATPase activity in hepatic mitochondria of rats (x±s,n= 8)
由表4可知,耐力训练大鼠在力竭运动后(B组),肝组织NOS活力和NO含量、肝线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase活力显著或极显著降低(P<0.05或P<0.01);恢复24 h后(C组),肝组织NOS活力和NO含量、肝线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase活力有所恢复,但仍显著低于A组(P<0.05)。补充紫草提取物的大鼠在力竭运动后(D组),肝组织NOS活力和NO含量、线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase活力显著低于A组(P<0.05),线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase活力显著高于B组(P<0.05);恢复24 h后(E组),肝组织NOS活力、NO含量和线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase活力都基本上恢复到训练对照组水平,与B组比较极显著升高(P<0.01),与C、D组比较显著升高(P<0.05)。
2.4 紫草提取物对耐力训练大鼠跑台运动力竭时间的影响

表5 大鼠运动力竭时间比较(x±s,n=16)Table 5 Exhaustive exercise time in rats (x±s,n=16)
由表5可知,加药力竭组+加药恢复组(D组+E组)16 只补充紫草提取物的大鼠力竭运动时间显著高于运动力竭组+力竭恢复组(B组+C组)的16 只大鼠,平均力竭时间延长了19.45%,具有统计学意义(P<0.05)。
3 讨 论
3.1 紫草提取物对耐力训练大鼠力竭和恢复24 h后肝组织抗氧化能力的影响
SOD及GSH-Px是机体内两类重要的抗氧化酶,通过催化抗氧化反应清除自由基。—SH是维持机体功能的活性基团,可以防止代谢过程中产生的氧自由基对组织细胞的损伤。MDA是自由基作用于脂质发生过氧化反应的终产物,其含量则是反映机体脂质过氧化水平和细胞损伤程度的重要指标[19]。本实验结果显示,高强度耐力训练大鼠在力竭运动后,肝组织抗氧化酶(SOD、GSH-Px)活性和巯基(—SH)含量显著下降,脂质过氧化产物(MDA)含量显著升高,恢复24 h后,各项指标恢复不明显,说明大鼠在高强度力竭运动中,肝脏的抗氧化能力下降,肝组织自由基过度堆积,且其氧化损伤在短时间内很难恢复。外源性补充紫草提取物的大鼠在力竭运动后,肝组织抗氧化酶的活性和巯基含量显著高于运动力竭组(P<0.05),MDA含量也显著低于运动力竭组(P<0.05),恢复24 h后,各抗氧化指标基本恢复到训练对照组水平。说明紫草提取物可以延缓运动导致的氧化损伤,也可促进运动后氧化损伤的功能修复。其机制可能与紫草提取物中富含萘醌类化合物,具有5、8位酚羟基有关,且氢醌结构很不稳定,极易向外传递电子和质子,可以终止生物膜中不饱和脂肪酸的自由基链式反应,具有较强的抗氧化能力[20-21],能有效延缓高强度运动中自由基的过渡堆积,保护抗氧化酶活性和对运动强度的耐受适应能力,促进了高强度运动后机体功能的恢复。
3.2 紫草提取物对训练大鼠力竭和恢复24 h后肝组织NOS活性和NO含量的影响
NO作为内源性抗通透因子,可以舒张血管、增加组织血液供给、改善微循环和组织代谢状况。同时,运动提高了血流对血管壁产生的剪切应力,增加了NO的生成与释放,有利于运动过程中营养物质的输送和代谢产物的清除。NOS是NO生成的关键限速酶,运动训练对NOS的影响随运动强度和时间的变化而不同[22]。
本实验结果表明,力竭运动即刻肝组织NOS活性和NO含量极显著降低(P<0.01),恢复24 h后,NOS活性和NO含量仍处于较低水平。其原因可能是机体的一种保护性抑制,抑制NOS活性,防止NO生成过度所引起的毒性作用,且在较短时间的恢复期内,肝脏仍处于较高的氧化应激水平,NOS活性受到抑制,NO合成不足。本实验结果还显示,外源性补充紫草提取物的大鼠在力竭运动后,肝组织NOS活性和NO含量显著高于运动力竭组(P<0.05),研究表明,紫草提取物可以通过调节肝脏的NO水平,保护酒精和四氯化碳对肝脏的诱导损伤[16,23-24]。本实验结果也说明紫草提取物可以延缓高强度运动对大鼠NO-NOS系统的抑制作用,其机制可能是紫草富含抗氧化成分,保护了抗氧化酶的活性,减轻了自由基对内皮细胞的损伤,进而维护了NO-NOS系统的生理功能;但肝组织NOS活性和NO含量还低于训练对照组,说明加药组大鼠在力竭运动后,肝脏仍然处于氧化应激状态,对NO-NOS系统也起到了一定的抑制作用。在恢复24 h后,补充紫草提取物组大鼠肝组织NOS活性和NO含量基本恢复到基础水平,说明紫草提取物有利于促进高强度运动后大鼠NO-NOS系统的功能恢复。其机制可能是紫草中的萘醌类化合物的抗氧化性能降低了运动中肝脏氧化应激水平,保护肝组织细胞结构和功能的完整性,促进了NO-NOS系统的功能恢复和NO的生成平衡;外源性补充紫草提取物,有利于运动机体的肝脏NO-NOS系统产生对抗性适应,降低NOS各亚型的诱导表达和NO的毒性作用,促进了NO-NOS系统的生理性恢复。
3.3 紫草提取物对训练大鼠力竭和恢复24 h后肝线粒体ATPase活性的影响
线粒体是维持细胞生命活动的生物能合成和供应的“能源供应中心”。肝细胞含有1 000~2 000 个线粒体,这些线粒体可占到肝细胞总体积的1/5。氧化应激环境下,自由基可攻击线粒体膜,引起细胞能量代谢障碍甚至凋亡。Na+/K+-ATPase、Ca2+/Mg2+-ATPase镶嵌于线粒体内膜,是维持线粒体膜流动性正常的关键酶,当这两种酶的活性下降时,线粒体钠泵功能发生障碍,导致线粒体内膜水肿,线粒体膜流动性下降,从而致使线粒体氧化磷酸化功能障碍,ATP合成不足,又直接降低了ATPase的活力,二者互为因果,构成恶性循环[25]。
大鼠力竭运动后,肝线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase活性显著下降(P<0.05),说明肝组织在缺血缺氧状态下,自由基攻击细胞膜发生脂质过氧化反应,使存在于细胞膜上的Na+/K+-ATPase、Ca2+/Mg2+-ATPase活性下降。恢复24 h后,大鼠肝线粒体ATPase活性仍然较低,说明肝组织细胞离子跨膜运转障碍和能量代谢的紊乱,长时间高强度运动造成的线粒体损伤在短时间内很难修复。外源性补充紫草提取物的大鼠在力竭运动后,肝线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase活性显著高于运动力竭组(P<0.05),且24 h后基本恢复基础水平。这说明紫草提取物可以保护长时间高强度运动大鼠肝线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase的活性和运动后的恢复,其机制可能与紫草中的萘醌类化合物降低了运动大鼠肝组织细胞的氧化应激水平,防止自由基对肝细胞线粒体膜的攻击,维护细胞形态结构和功能,保护Na+/K+-ATPase、Ca2+/Mg2+-ATPase活性有关。
3.4 紫草提取物对耐力训练大鼠力竭时间的影响及其机制
本实验结果显示,加药组大鼠与训练对照组大鼠相比较,力竭运动时间延长了19.45%,表明补充紫草提取物可以提高大鼠的运动能力,延缓运动疲劳的产生。其机制主要与紫草中富含萘醌类化合物,具有抗炎镇痛、抗氧化、免疫调节等多重药理作用有关。外源性补充紫草提取物可以提高运动过程中大鼠肝脏对氧化应激水平的适应能力,促进NO的生成平衡和生理功能发挥,防止自由基对细胞膜的攻击,保护肝组织抗氧化酶和线粒体膜上离子泵的活性和功能,保证运动过程中大鼠肝组织细胞的离子代谢、能量代谢和物质代谢功能的正常运转,从而保证运动过程中机体的“能源供应”,提高机体的运动能力,延长运动时间。
4 结 论
长期补充紫草提取物能够有效保持高强度运动大鼠肝组织抗氧化酶的活性,调节运动过程中NO的生成平衡,改善肝组织自由基清除能力和代谢水平;保护肝线粒体Na+/K+-ATPase、Ca2+/Mg2+-ATPase活性,有助于调节运动过程中肝线粒体内外的离子平衡和维持细胞的正常生理功能;最终发挥抗氧化、抗自由基,保护肝细胞、抗肝损伤和延缓运动疲劳、提高运动能力的作用。其作用机理有待于进一步深入研究。
[1] 张蕴琨, 丁树哲. 运动生物化学[M]. 北京: 高等教育出版社, 2011: 125-128.
[2] 邓树勋, 王健, 乔德才. 运动生理学[M]. 北京: 高等教育出版社, 2013: 233-235.
[3] 张钧, 张蕴琨. 运动营养学[M]. 北京: 高等教育出版社, 2012: 23-30.
[4] 汤长发, 周婕. 运动与细胞凋亡[J]. 北京体育大学学报, 2004, 27(1): 68-70.
[5] 杜朝辉, 韦会平. 抗运动性疲劳中药研究现状[J]. 中国运动医学杂志, 2008, 27(2): 130-135.
[6] 顿耀山, 石月, 彭晓庐, 等. 中药运动营养补剂作用机制的研究进展[J]. 食品科学, 2013, 34(15): 415-423. doi: 10.7506/spkx1002-6630-201315079.
[7] 池爱平, 李虹, 康琛喆, 等. 富硒茶多糖的提取及其对运动疲劳恢复的影响[J]. 食品科学, 2014, 35(13): 240-244. doi: 10.7506/spkx1002-6630-201413047.
[8] 张婧, 熊正英. 迷迭香对运动大鼠肝脏组织脂质过氧化损伤保护作用的研究[J]. 天然产物研究与开发, 2011, 23(2): 365-368.
[9] 王新军, 王一民, 熊正英. 杜仲提取物对运动训练大鼠肝组织氧化损伤的保护作用[J]. 西北农林科技大学学报: 自然科学版, 2013, 41(2): 41-45.
[10] 李时珍. 本草纲目(中册)[M]. 北京: 人民卫生出版社, 1999: 683.
[11] 宋艳华, 孙晖, 张爱华, 等. 紫草的研究进展[J]. 中医药学报, 2013, 41(4): 123-125.
[12] HAN Jie, WENG Xinchu, BI Kaishun. Antioxidants from a Chinese medicinal herb: Lithospermum erythrorhizon[J]. Food Chemistry, 2008, 16(1): 2-10.
[13] 谈静, 方芳, 郑琰, 等. 紫草提取工艺研究[J]. 中药与临床, 2013, 4(6): 12-13.
[14] 郝鹤, 李鹏跃, 叶和春, 等. 新疆紫草7种萘醌类成分的同时测定[J].中国实验方剂学杂志, 2013, 19(18): 108-112.
[15] BEDFORD T G, TIPTON C M, WILSON N C, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. Journal of Applied Physiology, 1979, 47(6): 1278-1283.
[16] 买尔旦·马合木提, 刘燕, 古丽仙·胡加, 等. 新疆紫草提取物对小鼠急性酒精性肝损伤的保护作用[J]. 中国药物与临床, 2007, 7(4): 284-286.
[17] 宋葆华, 刘月霞, 韩志强. 蒙药德都红花-7味散对衰老大鼠肝线粒体脂质过氧化的影响[J]. 中国中医药科技, 2011, 18(5): 425-426.
[18] 毛雁, 韩晓燕, 熊正英, 等. 黄精提取物对耐力训练大鼠骨骼肌组织NO-NOS体系影响的实验研究[J]. 北京体育大学学报, 2008, 31(9): 1225-1227.
[19] 熊正英. 运动自由基生物学研究[M]. 北京: 科学出版社, 2010: 14-25.
[20] ASSIMOPOULOU A N, BOSKOU D, PAPAGEORGIOU V P. Antioxidant activities of alkannin, shikonin and Alkanna tinctoria root extracts in oil substrates[J]. Food Chemistry, 2004, 87: 433-438.
[21] GONG Ke, LI Wenhua. Shikonin, a Chinese plant-derived naphthoquinone, induces apoptosis in hepatocellular carcinoma cells through reactive oxygen species: a potential new treatment for hepatocellular carcinoma[J]. Free Radical Biology and Medicine, 2011, 51(12): 2259-2271.
[22] 张离, 冯连世. 一氧化氮与运动[J]. 中国运动医学杂志, 2001, 20(3): 295-298.
[23] 刘燕, 买尔旦·马合木提, 尼加提·热合木. 新疆紫草提取物对小鼠急性四氯化碳性肝损伤的保护作用[J]. 时珍国医国药, 2006, 17(9): 1676-1678.
[24] 冯文文, 谭勇, 李国玉, 等. 紫草提取物对小鼠急性肝损伤保护作用的研究[J]. 农垦医学, 2010, 32(2): 108-111.
[25] 尹刚, 王贵林, 余万桂, 等. 肉苁蓉对感染性休克大鼠肝线粒体能量代谢的影响[J]. 中药药理与临床, 2008, 24(3): 69-71.
Hepatoprotective Effect of Gromwell Extract in Fatigue Rats
XU Xiaoxian1, XIONG Zhengying2
(1. Department of Physical Education, Xi’an Shiyou University, Xi’an 710065, China; 2. Institute of Sports Biology, Shaanxi Normal University, Xi’an 710062, China)
Purpose: To observe changes in hepatic and mitochondrial biochemical parameters in rats previously undergoing exhaustive exercise after 0 and 24 hours of recovery, and subsequently to explore the biological mechanisms of orally administered gromwell root extract (GRE) for protecting the liver, improving exercise performance, mitigating exercise fatigue and accelerating recovery from fatigue in rats. Methods: Totally 40 rats were divided into 5 groups including exercise control group (group A), exhaustive exercise group (group B), exhaustive exercise followed by 24 h recovery group (group C), exhaustive exercise with GRE treatment group (group D), exhaustive exercise followed by 24 h recovery group with GRE treatment (group E). The rats from each group were subjected to exercise training for 6 weeks. On the last day of the experimental period, the rats from group A (without exercise training), B and D (immediately after exercise training) were sacrificed, while those from group C and E were sacrificed at 24 h after exercise training, and samples were collected for the measurement of biochemical parameters. Results: After the exhaustive exercise, the antioxidant capacity of hepatic tissue (P < 0.05), the activity of nitric oxide synthase (NOS) and the content of NO in hepatic tissue (P < 0.01), and the activities of Na+/K+-ATPase and Ca2+/Mg2+-ATPase in hepatic mitochondria were significantly decreased (P < 0.05), but these indicators were not significantly restored after subsequent recovery for 24 hours. Compared with group B, the antioxidant capacity of hepatic tissue in rats receiving oral administration of GRE was significantly improved (P < 0.05), and NOS activity, NO content and the activities of Na+/K+-ATPase and Ca2+/Mg2+-ATPase in hepatic mitochondria were also enhanced significantly (P < 0.05); after 24 hours of recovery, these indicators were restored to the basal levels. Conclusion: Oral supplementation of gromwell root extract can regulate the balance of NO generation, improve the balance of free radical metabolism, protect the activities and functions of ionic pumps, prolong the exhaustive time of endurance-trained rats, and enhance functional recovery from exercise fatigue.
gromwell extract; hepatoprotection; anti-fatigue
G804.7
A
1002-6630(2015)21-0238-05
10.7506/spkx1002-6630-201521044
2014-12-08
陕西师范大学创新基金项目(SD1307)
徐小仙(1979—),女,讲师,硕士,研究方向为运动营养的中药资源开发。E-mail:xuxiaoxian0108@163.com
