芫荽酸性磷酸酶的提取、纯化及酶学性质研究
2015-12-26唐云明
王 丹,万 骥,傅 婷,唐云明
(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
芫荽酸性磷酸酶的提取、纯化及酶学性质研究
王 丹,万 骥,傅 婷,唐云明*
(西南大学生命科学学院,淡水鱼类资源与生殖发育教育部重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
采用硫酸铵分级沉淀、CM-Sepharose离子交换层析、Superdex-200凝胶过滤层析法,从新鲜芫荽中分离纯化出电泳纯的酸性磷酸酶(acid phosphatase,ACP)。该酶的酶活回收率为14.20%、纯化倍数为238.60、酶比活力为295.87 U/mg、亚基分子质量约为53.8 kD;芫荽ACP酶学性质研究结果表明:该酶的最适反应温度为55 ℃,在50 ℃以下时较稳定,因此该酶对温度较敏感;该酶的最适反应ph值为5.8,在ph 4.0~7.0之间较稳定,表明该酶耐受于酸性环境;芫荽ACP的对硝基苯酚磷酸二钠Km值为0.63 mmol/L,表明该酶与底物对硝基苯酚磷酸二钠具有较高的亲和力;甲醇、乙醇、异丙醇、抗坏血酸、草酸、Cu2+、Pb2+、Ag+对该酶具有强烈的抑制作用;Mg2+、Mn2+、Ba2+、K+对该酶具有一定的激活作用。
芫荽;酸性磷酸酶;分离纯化;酶学性质
芫荽(Coriandrum sativum L.),俗称香菜,是伞形科一年生或二年生草本植物,常用作调味品,具有药用价值和丰富的营养价值[1]。酸性磷酸酶(acid phosphatase,ACP)是一类在酸性条件下催化磷酸单酯水解生成无机磷酸的巯基酶,广泛存在于动植物、微生物体内以及人类的肝脏、前列腺等器官中[2],是调控生物体中磷代谢的重要酶类[3]。ACP不仅参与了生物体的生长与代谢调节、信号转导途径,也可增强植物对缺磷、干旱、低温、水分、盐分等逆境的抗性;该酶可作为检测土壤重金属污染度的指标,重金属汞、铜、锌引起酶分子色氨酸、酪氨酸残基微环境产生变化,使酶活性中心的构象发生改变,进而对酶的催化活性产生影响[4-5];该酶还可以作为食品及饮料的添加剂[6];ACP也可以用来检测蛋白质类食品中的微生物指标,通过对食品中ACP活性的变化判断其被细菌污染的程度,从而保障食品安全[7]。因此,该酶在多个领域中均具有应用价值。目前,已有关于不同来源ACP的研究报道,江琰等[8]从意大利蜂工蜂体内分离提纯出ACP,并对其氨基酸组成成分进行了分析;杨立红等[9]从草鱼肝脏中提取出ACP,并研究了多种金属离子对其酶活性的影响;张国庆等[10]以树状多节孢为材料,研究了ACP的理化性质及生物学特性。本实验选取芫荽为材料,从中分离纯化出ACP,并对其酶学性质进行研究,旨在为从植物中提取ACP提供理论参考,为进一步对农作物进行遗传改良奠定基础。
1 材料与方法
1.1 材料与试剂
新鲜芫荽,购于重庆北碚永辉超市。
Superdex-200、CM-Sepharose、蛋白质十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gelelectrophoresis,SDS-PAGE)标准品与凝胶过滤分子质量标准品 美国GE Healthcare公司;甲叉双丙烯酰胺、丙烯酰胺 瑞士Fluka公司;考马斯亮蓝R-250 美国Bio-Rad公司;牛血清白蛋白 美国Sigma公司;对硝基苯酚磷酸二钠(p-nitrophenyl phosphate disodium salt hexahydrate,PNPP) 美国Amresco公司;其余试剂均为国产分析纯。
1.2 方法
1.2.1 芫荽ACP粗酶液的制备
取新鲜芫荽嫩叶,用去离子水洗净,用吸水纸擦干,称取45 g并剪碎,按1∶3(m/V)的比例加入预冷的50 mmol/L醋酸-醋酸钠缓冲液(ph 5.0,内含2 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、10 mmol/L β-巯基乙醇、5 mmol/L MgSO4,下同),匀浆后,4 ℃冰箱中静置抽提3 h,经纱布过滤后滤液在4 ℃条件下10 000 r/min离心40 min,收集上清液,即为芫荽ACP粗酶液。
1.2.2 硫酸铵分级沉淀
向芫荽ACP粗酶液中加入硫酸铵至30%饱和度,4 ℃冰箱中静置3 h,10 000 r/min离心40 min,收集上清液,再向其中加入硫酸铵至60%饱和度,4 ℃冰箱中静置3 h,10 000 r/min离心40 min,弃上清液;沉淀用50 mmol/L醋酸-醋酸钠缓冲液完全溶解,于4 ℃条件下透析24 h后3 000 r/min离心10 min,收集上清液即为初步纯化的芫荽ACP酶液。
1.2.3 CM-Sepharose离子交换层析
CM-Sepharose离子交换层析柱经50 mmol/L醋酸-醋酸钠缓冲液(ph 5.0,内含10 mmol/L β-巯基乙醇)平衡后,取10 mL初步纯化后的芫荽ACP酶液上样,用0~1 mol/L的NaCl溶液(由50 mmol/L醋酸-醋酸钠缓冲液配制,ph 5.0,内含10 mmol/L β-巯基乙醇)进行线性梯度洗脱,流速为0.5 mL/min,每管收集5 mL,紫外检测波长为280 nm。测定各管ACP的酶活力和蛋白质含量,收集活性较高的酶液。
1.2.4 Superdex-200凝胶过滤层析
Superdex-200凝胶层析柱经50 mmol/L醋酸-醋酸钠缓冲液(ph 5.0,内含10 mmol/L β-巯基乙醇)平衡后,取经离子交换层析后所收集的活性较高的酶液上样,每次5 mL,用50 mmol/L醋酸-醋酸钠缓冲液(ph 5.0,内含10 mmol/L β-巯基乙醇)进行洗脱,流速为0.5 mL/min,每管收集3 mL。测定各管ACP的酶活力和蛋白质含量,收集活性较高的酶液,4 ℃条件下透析24 h,冷冻干燥后,得到ACP纯品,置于-20 ℃冰箱保存,用于电泳及酶学性质研究。
1.2.5 芫荽ACP纯度鉴定及分子质量测定
通过SDS-PAGE对凝胶过滤层析后获得的ACP进行纯度鉴定,分别制备质量分数为5%的浓缩胶和12%的分离胶,上样量为10 μL,经SDS-PAGE和凝胶过滤层析分别测定芫荽ACP的亚基分子质量和全酶分子质量[11]。
1.2.6 芫荽ACP活力的测定
芫荽ACP活力测定方法参照文献[12]略有改进:体系包含1 mL 5 mmol/L PNPP、1 mL 10 mmol/L MgSO4、3 mL 0.2 mol/L醋酸-醋酸钠缓冲液(ph 5.2,内含5 mmol/L β-巯基乙醇)、100 μL酶液;混匀后,于35 ℃条件下反应10 min后加入2.5 mL 0.2 mol/L NaOH终止反应。以灭活的酶液代替原酶液做为对照调零,在420 nm波长处测定吸光度。根据对硝基苯酚(p-nitrophenol,PNP)标准曲线[12]计算产物生成量。酶活力单位(U)定义为在以上反应条件下,每10 min催化底物PNPP水解生成1 μmol对硝基苯酚所需的酶量为一个酶活力单位。
1.2.7 芫荽ACP蛋白质含量测定
采用紫外分光光度法和考马斯亮蓝染色法(Bradford法)对芫荽ACP的蛋白质含量进行测定[11]。
1.2.8 芫荽ACP酶学性质研究
1.2.8.1 最适反应ph值和ph值稳定性
将反应体系中的缓冲液替换为不同ph值(3.0、4.0、5.0、5.2、5.4、5.6、5.8、6.0、7.0、8.0)的缓冲液,其他条件均保持一致,测定芫荽ACP酶活力,以酶活力最高值为100%,计算其他各ph值条件下的相对酶活力,以确定芫荽ACP的最适反应ph值。将纯化后的芫荽ACP酶液分别置于不同ph值(3.0、4.0、5.0、5.2、5.4、5.6、5.8、6.0、7.0、8.0)的缓冲液中静置4 h后,测定芫荽ACP的酶活力,以酶活力最高值为100%,计算其他各ph值条件下的相对酶活力,以研究该酶的ph值稳定性。
1.2.8.2 最适反应温度与热稳定性
在不同反应温度 (20、25、30、35、40、45、50、55、60、65、70、75、80、85 ℃)条件下,其他条件均保持一致,测定芫荽ACP的酶活力,以酶活力最高值为100%,计算其他温度条件下的相对酶活力,以确定芫荽ACP的最适反应温度。将纯化后的芫荽ACP酶液分别置于不同温度(20、30、40、50、60、70 ℃)条件下保温不同时间后,测定芫荽ACP的酶活力,以酶液不保温时的酶活力为100%,计算不同反应温度条件下的相对酶活力,以研究该酶的热稳定性。
1.2.8.3 米氏常数(Km)的测定
配制不同浓度(0.1、0.2、0.3、0.4、0.5、0.6 mmol/L)的PNPP,在55 ℃、ph 5.8的条件下测定芫荽ACP的酶活力,采用Lineweaver-Burk双倒数作图法[13]计算出芫荽ACP的Km值。
1.2.8.4 不同有机溶剂对芫荽ACP活性的影响
将体积分数为10%、20%、30%、40%、50%的甲醇、乙醇、异丙醇和纯化后的芫荽ACP酶液等体积混合,于4 ℃冰箱中静置1 h,测定酶活力,以酶液中不加有机溶剂时的活力为100%,计算在不同条件下,芫荽ACP的相对酶活力。
1.2.8.5 不同金属离子对芫荽ACP活性的影响
将11 种不同浓度(1.0、2.0、3.0、4.0、5.0 mmol/L)的金属离子溶液和纯化后的芫荽ACP酶液等体积混合后,于4 ℃冰箱中静置1 h,测定酶活力,以酶液中不加金属离子时的活力为100%,计算在不同条件下芫荽ACP的相对酶活力。
1.2.8.6 不同化合物对芫荽ACP活性的影响
将不同浓度(10、20、30、40、50 mmol/L)的EDTA、草酸、尿素、抗坏血酸和纯化后的芫荽ACP酶液等体积混合,于4 ℃冰箱中静置1 h,测定酶活力,以酶液中不加化合物时的活力为100%,计算在不同条件下,芫荽ACP的相对酶活力。
2 结果与分析
2.1 芫荽ACP的分离纯化结果

图1 芫荽ACP的CM-Sepharose离子交换层析结果Fig.1 CM-Sepharose ion-exchange chromatography of ACP from cilantro
芫荽ACP粗酶液经CM-Sepharose离子交换层析以及Superdex-200凝胶过滤层析后,结果如图1、2所示,经过CM-Sepharose离子交换层析后,酶活性较高的峰主要集中在第38~46管,其中第42管的酶活力最高;由图2可知,经过Superdex-200凝胶过滤层析后,酶活性较高的峰主要集中在第31~37管,其中第33管酶活力最高;收集酶活性较高的各管酶液;经透析、冷冻干燥及浓缩后上样SDS-PAGE检测,显示为单一条带(图3),表明芫荽ACP达到了电泳纯;该酶的整个纯化过程及其结果如表1所示,最终得到芫荽ACP纯品的酶比活力为295.87 U/mg、酶活回收率为14.20%、纯化倍数为238.60 倍。
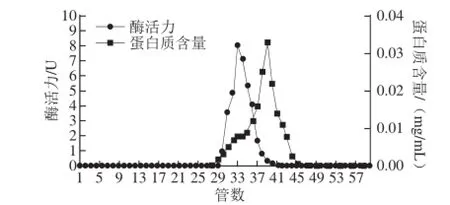
图2 芫荽ACP的Superdex-200凝胶过滤层析结果Fig.2 Superdex-200 chromatography of ACP from cilantro

图3 芫荽ACP的SDS-PAGE图Fig.3 SDS-PAGE of ACP from cilantro

表1 芫荽ACP的纯化结果Table 1 Purification of ACP from cilantro
2.2 芫荽ACP的分子质量
经过SDS-PAGE测得芫荽ACP的亚基分子质量约为53.8 kD,经过Superdex-200凝胶层析测得其全酶分子质量约为56.2 kD(图4),由此可推测芫荽ACP为单亚基酶。

图4 Superdex-200凝胶过滤层析测得芫荽ACP全酶分子质量Fig.4 Molecular weight estimation of ACP by Superdex-200 gel filtration chromatography
2.3 芫荽ACP的酶学性质
2.3.1 芫荽ACP的最适反应ph值和ph值稳定性
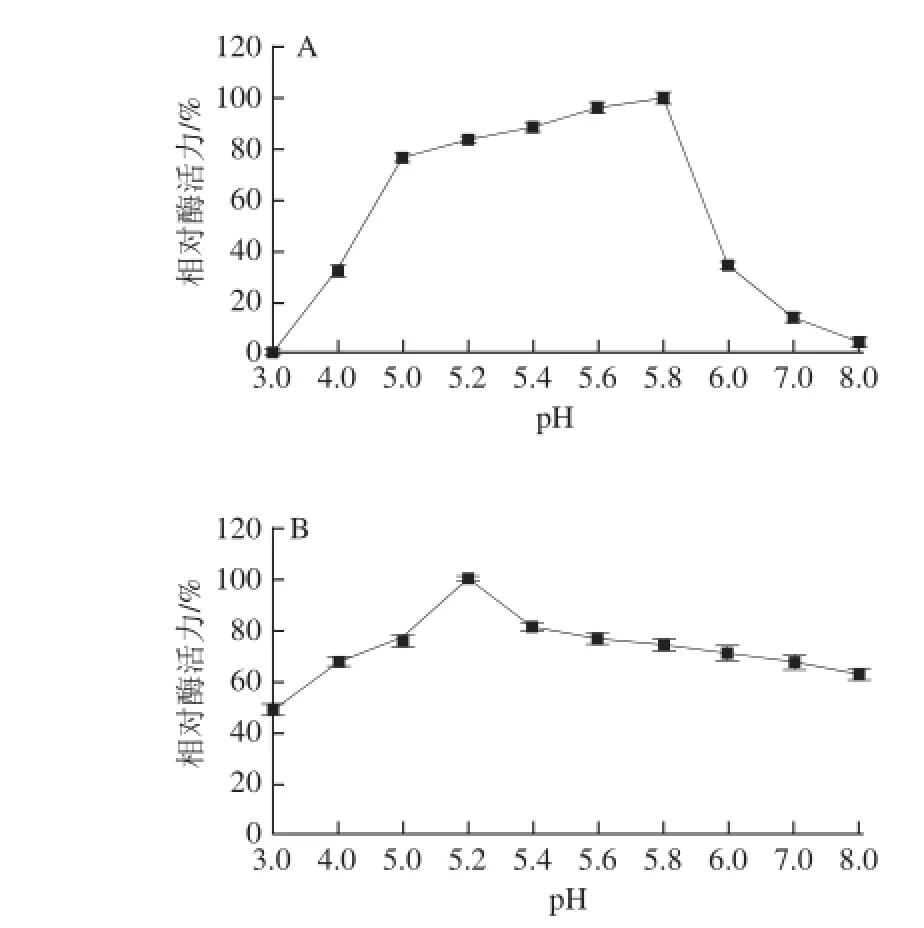
图5 芫荽ACP的最适pH值和pH值稳定性Fig.5 Effect of pH on the activity of ACP from cilantro and its pH stability
如图5A所示,在ph 5.0~6.0之间,芫荽ACP具有较高的活力,当ph值为5.8时,芫荽ACP活力最高,因此,该酶的最适ph值为5.8;当ph值小于3.0和大于8.0时,芫荽ACP几乎完全失活。其原因可能是过高或过低的ph值会影响酶分子侧链上极性基团以及带电状态,从而导致该酶活性中心构象发生改变;影响酶与底物的结合,因为当酶催化底物反应时,底物分子上的某些基团需处于一定的解离状态,而ph值的改变抑制了这些基团的解离,从而使酶的催化速率急剧降低[14]。如图5B所示,芫荽ACP在ph 4.0~7.0范围内放置4 h后,依然保持了较高的活性,这表明芫荽ACP耐受酸性环境。
2.3.2 芫荽ACP的最适反应温度与热稳定性
如图6A所示,芫荽ACP在20~55 ℃之间,酶活力随着温度的升高而增大,当温度为55 ℃时,芫荽ACP活力最高,当温度高于55 ℃后,酶活力逐渐降低,因此,该酶的最适反应温度为55 ℃,在50~70 ℃范围内,芫荽ACP活力均保持较高水平(90%左右)。如图6B所示,将芫荽ACP在不同的温度体系中保温不同时间,随着保温时间的延长,芫荽ACP均表现出活力减小的趋势,在20~50 ℃范围内,保温2 h后芫荽ACP活力均保持在50%以上;在60 ℃体系中保温2 h后,芫荽ACP活力几乎完全丧失;当温度超过60 ℃时,芫荽ACP活力急剧下降,1 h之内活力完全丧失。原因是该酶在适当的温度条件下会降低反应的活化能,从而提高反应速率,然而酶的本质是具有催化功能的蛋白质,所以过高的温度会使酶蛋白分子的天然构象被破坏,导致酶分子变性,从而催化功能丧失[15],由此可推断,该酶对温度较敏感,在50 ℃以下时较稳定。
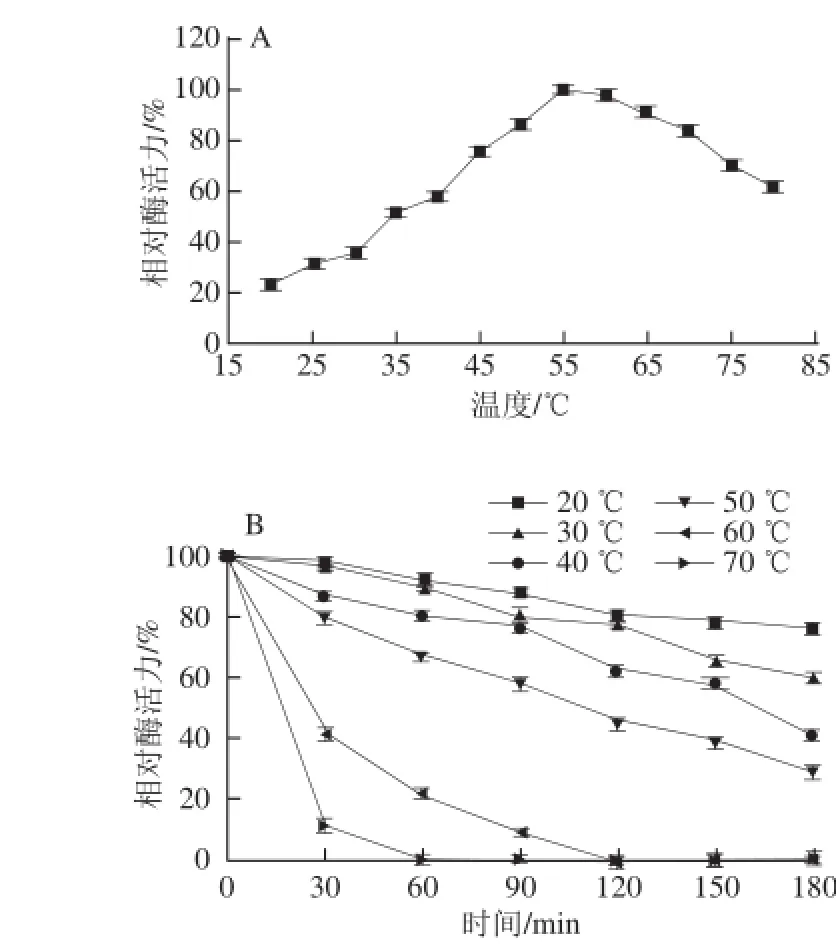
图6 芫荽ACP的最适温度和热稳定性Fig.6 Effect of temperature on activity of ACP from cilantro and its thermal stability
2.3.3 芫荽ACP的米氏常数

图7 双倒数法测得芫荽ACP的米氏常数Fig.7 Kmof ACP from cilantro estimated by Lineweaver-Burk plot
如图7所示,芫荽ACP的Km值为0.63 mmol/L,表明该酶在反应过程中,与底物PNPP具有较高的亲和力。
2.3.4 不同有机溶剂对芫荽ACP活性的影响

图8 不同有机溶剂对芫荽ACP活力的影响Fig.8 Effects of various organic solvents on the activity of ACP from cilantro
如图8所示,随着有机溶剂甲醇、乙醇、异丙醇体积分数的增加,芫荽ACP活力均出现下降趋势,主要原因可能是芫荽ACP与底物的接触受到扩散限制的影响;酶分子的构象主要由静电作用力、范德华力、疏水作用以及氢键构成一个复杂的网络来维持,有机溶剂缺乏提供多种氢键的能力,而且由于它们的低介电常数往往会导致蛋白质带电基团之间更强的静电作用,因而酶在有机溶剂中活性较低[16]。
2.3.5 不同金属离子对芫荽ACP活性的影响
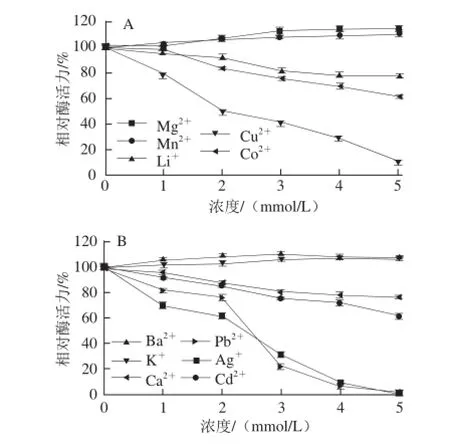
图9 不同金属离子对芫荽ACP活力的影响Fig.9 Effects of various metal ions on the activity of ACP from cilantro
如图9所示,在不同浓度条件下,同一种金属离子和不同金属离子对芫荽ACP均表现出不同的作用结果。Mg2+、Mn2+、Ba2+、K+对该酶具有一定的激活作用,且随着浓度的增加,激活作用越显著,主要原因可能是这4 种金属离子在酶与底物之间起到了桥梁的作用,形成了酶-金属离子-底物的三元复合物,从而更有利于底物与酶活性中心的结合;Li+、Co2+、Ca2+、Cd2+随着其浓度的增加,对该酶的抑制作用越显著,主要原因可能是这些金属离子影响了酶的空间结构,从而使酶活性降低;Cu2+、Pb2+、Ag+对该酶具有强烈的抑制作用,原因可能是这3 种重金属离子破坏了酶的二级结构或者与酶形成了络合物,从而导致该酶变性失活。
2.3.6 不同化合物对芫荽ACP活性的影响
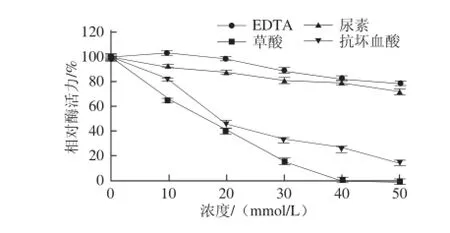
图10 不同化合物对芫荽ACP活力的影响Fig.10 Effects of various compounds on the activity of ACP from cilantro
如图10所示,低浓度的EDTA对芫荽ACP活性具有激活作用,但当EDTA浓度超过10 mmol/L时,对该酶开始表现出抑制作用,原因可能是EDTA是一种金属螯合剂,高浓度时会螯合对该酶的催化活性具有促进作用的Mg2+,从而导致芫荽ACP活性的降低;尿素对该酶的抑制作用较弱;抗坏血酸对该酶具有较强的抑制作用;草酸对该酶具有强烈的抑制作用,当浓度达到40 mmol/L时,该酶的活性已经完全丧失。
3 讨 论
本实验选取的材料为新鲜芫荽,经过一系列的纯化过程从中分离纯化出了ACP。在纯化过程中,由于经过CM-Sepharose离子交换层析后所收集到的酶液活性较高,未经冷冻干燥即可直接上Superdex-200凝胶过滤层析柱,实验步骤更为简便,同时减少了酶活力的损失,酶活回收率达到14.20%,高于绿豆(4%)[12]、韭菜(10.5%)[17]及甘薯叶(3.5%)[18]中的ACP酶活回收率;纯化倍数达238.60,高于绿豆(156.3 倍)[12],甘薯叶(169.07 倍)[18]中的ACP纯化倍数。
芫荽ACP的亚基分子质量为53.8 kD,与斑玉蕈(65 kD)[19]、韭菜(58.97 kD)[17]中的ACP亚基分子质量相接近,但低于海参(147.9 kD)[20]、蚯蚓(113 kD)[21]和意大利蜂工蜂(135 kD)[8]中的ACP亚基分子质量,这表明来源不同的ACP分子结构具有物种特异性;芫荽ACP对PNPP的Km值为0.63 mmol/L,高于草鱼(0.232 mmol/L)[9]与甘薯叶(0.258 mmol/L )[18]中ACP的Km值,接近于韭菜(0.896 mmol/L)[17]和背角无齿蚌(0.73 mmol/L)[22]中ACP的Km值,这表明不同来源的ACP对底物的亲和力具有一定的差异性,可能是因为生物体为了更好地适应环境以及满足生长代谢的需求,从而产生出了多种ACP同工酶[17]。
芫荽ACP的最适反应ph值为5.8,与绿豆和甘薯叶(ph 5.2)[12,18]、洋葱(ph 5.7)[23]、韭菜(ph 5.4)[17]、麦芽(ph 5.0)[24]中的ACP最适反应ph值相近,高于刺参(ph 4.4)[25]、背角无齿蚌(ph 4.8)[22]和树状多节孢(ph 3.0)[10]中的ACP最适反应ph值,这表明不同来源的ACP对ph值的适应性具有一定的差异,且通过对芫荽ACP的ph值稳定性研究发现其对酸碱具有较广的耐受范围;该酶的最适反应温度为55 ℃,低于韭菜和甘薯叶(65 ℃)[17-18]中ACP的最适反应温度,高于绿豆(40 ℃)[12]、草鱼和刺参(45 ℃)[9,25]、背角无齿蚌(50 ℃)[22]中的ACP最适反应温度,且通过对芫荽ACP的热稳定性研究发现其对温度的敏感性较强。
本研究表明,不同的金属离子对芫荽ACP的活性有不同的影响:Mg2+、Mn2+、Ba2+、K+对芫荽ACP具有一定的激活作用,与文献报道中草鱼ACP[9]、仿刺参ACP[26]以及甘薯叶ACP[18]一致;Li+、Co2+、 Ca2+、Cd2+对该酶的具有一定的抑制作用;Cu2+、Pb2+、Ag+对该酶具有强烈的抑制作用,且在低浓度时就已导致该酶完全失活,与斑玉蕈ACP[19]以及海参ACP[20]相符;而在关于洋葱[23]和黑绿豆[27]ACP的报道中,Mg2+对其具有抑制作用,这表明同一种金属离子对不同物种来源的ACP活性有着不同的影响。
通过对芫荽ACP与来源于不同动植物组织中的ACP进行比较后,发现ACP在酶学性质上存在一定的差异性,可能是因为不同物种中的ACP会随着生物体组织器官代谢环境的变化而变化,以满足不同的生长代谢需求以及更好地参与动植物体内生理功能的调节过程,这是生物体在自然选择过程中基因选择性表达的结果。
[1] 刘香荣, 鲁海波, 朱海泉, 等. 芫荽的研究进展[J]. 中国调味品, 2012, 37(6): 17-19.
[2] SCHENK G, GUDDAT L W, GE Y, et al. Identification of mammalian-like puple acid phosphatases in a wide range of plants[J]. Gene, 2000, 250(1/2): 117-125.
[3] MACDONALD K. The hydrolysis of phenyl phosphate by mouseliver acid phosphatase[J]. Biochemical Journal, 1961, 80(1): 154-161.
[4] MILLER S S, LIU J, ALLAN D L, et al. Moleular control of acid phosphatase secretion into the rizosphere of proteoid roots from phosphorus-stressed white lupin[J]. Plant Physiology, 2001, 127(2): 594-606.
[5] 徐冬梅. 土壤酸性磷酸酶性质及汞、铜、锌对其影响的机理研究[D].杭州: 浙江大学, 2003: 16-19.
[6] 吴应文. 大麦芽中酸性磷酸酯酶的分离[J]. 甘肃科学学报, 1991(4): 69-71.
[7] 吴信法. 酶和食品品质的指示[J]. 肉品卫生, 1994(11): 30-31.
[8] 江琰, 刘克武, 杨守忠, 等. 意蜂工蜂酸性磷酸酶的分离纯化及动力学研究[J]. 四川大学学报: 自然科学版, 2001, 38(5): 776-780.
[9] 杨立红, 肖波, 王晓洁, 等. 草鱼酸性磷酸酯酶的性质及金属离子对其活性的影响[J]. 中国水产科学, 2010, 17(5): 970-976.
[10] 张国庆, 王有志, 王守现, 等. 树状多节孢酸性磷酸酶的分离纯化与性质研究[J]. 菌物学报, 2011, 30(5): 753-759.
[11] 李建武, 余瑞元. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1994: 71-223.
[12] 高亚鹏, 苏茉, 梁建荣, 等. 绿豆酸性磷酸酶的分离纯化和部分性质研究[J]. 中国粮油学报, 2011, 26(5): 92-96.
[13] 陈钧辉, 陶力, 朱婉华, 等. 生物化学实验[M]. 北京: 科学出版社, 2004: 92-93.
[14] SUDhARShAN E, SRINIVASULU S, RAO A G A. ph-induced domain interaction and conformational transitions of lipoxygenase-1[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2000, 1480(1/2): 13-22.
[15] 何立超, 赵见营, 田甜, 等. 樱桃谷鸭胸肉脂肪氧合酶的分离纯化及其酶学特性研究[J]. 食品科学, 2013, 34(7): 166-170. doi: 10.7506/ spkx1002-6630-201307035.
[16] 彭立凤. 有机溶剂对酶催化活性和选择性的影响[J]. 化学进展, 2000, 12(3): 296-304.
[17] 孙芳, 任美凤, 胡瑞斌, 等. 韭菜酸性磷酸酶的分离纯化及酶学性质[J].食品科学, 2013, 34(17): 187-191. doi: 10.7506/spkx1002-6630-201317040.
[18] 李星, 王洁, 王红扬, 等. 甘薯叶酸性磷酸酶的分离纯化及部分性质和功能基团的研究[J]. 食品科学, 2015, 36(3): 152-157. doi: 10. 7506/spkx1002-6630-201503029.
[19] 杨立红, 高兴喜, 缪静, 等. 斑玉蕈酸性磷酸酯酶的酶学性质研究[J].菌物学报, 2011, 30(5): 744-752.
[20] ZHU Beiwei, YU Jianwei, ZHANG Zongshen, et al. Purification and partial characterization of anacid phosphatase from the body wall of sea cucumber Stichopus japonicus[J]. Process Biochemistry, 2009, 44: 875-879.
[21] STUBBERUD H E, HØNSI T G, STENERSEN J. Purification and partial characterisation often tatively classified acid phosphatase from the earthworm Eisenia veneta[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2000, 126: 487-494.
[22] 魏炜, 张洪渊, 石安静. 背角无齿蚌酸性磷酸酶的分离、纯化及部分性质研究[J]. 四川大学学报, 1999, 36(3): 570-572.
[23] GUO Jie, ThOMAS C. Purification and characterization of an acid phosphatase from the bulb of Allium cepa L. var. sweet spanish[J]. Journal of Plant Physiology, 1997, 151: 520-527.
[24] 陆珊. 麦芽酸性磷酸酶的部分性质研究[D]. 成都: 四川大学, 2006: 9. [25] 杨立红, 孙振兴, 王晓洁, 等. 刺参酸性磷酸酯酶的分离纯化及部分性质研究[J]. 食品科学, 2008, 29(10): 441-442.
[26] 于建伟, 李冬梅, 李吉龙, 等. 仿刺参酸性磷酸酶的提取及粗酶性质研究[J]. 水产科学, 2009, 28(1): 6-7.
[27] ASADUZZAMAN A K M, RAHMAN H M, YEASMIN T. Purification and characterization of acid phosphatase from a germinating black gram (Vigna mungo L.) seedling[J]. Archives of Biological Sciences, 2011, 63(3): 747-756.
Isolation, Purification and Characterization of Acid Phosphatase from Cilantro
WANG Dan, WAN Ji, FU Ting, TANG Yunming*
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Key Laboratory of Freshwater Fish Reproduction and Development, Ministry of Education, School of Life Science, Southwest University, Chongqing 400715, China)
Electrophoresis-purity acid phosphatase (ACP) from cilantro was obtained by homogenization, buffer solution extraction, ammonium sulfate fractional precipitation, CM-Sepharose ion exchange chromatography and Superdex-200 gel filtration. The results showed that after purification the recovery rate of ACP activity was 14.20% with a purification fold of 238.60, and the specific activity of ACP was 295.87 U/mg. The subunit molecular mass of the enzyme was approximately 53.8 kD. The characterization of ACP illustrated that the optimal reaction temperature was 55 ℃, and it was stable in the range of 20–50 ℃. Therefore, the enzyme was sensitive to temperature. The optimal reaction pH was 5.8, and it was relatively stable in the range of pH 4.0–7.0. The enzyme showed tolerance to acidic environment. Its Kmwas 0.63 mmol/L towards p-nitrophenyl phosphate disodium salt hexahydrate, indicating high affinity between the enzyme and the substrate. The enzyme activity of ACP could be strongly inhibited by methanol, ethanol, isopropanol, ascorbic acid, oxalic acid and Cu2+, Pb2+and Ag+, while it could be enhanced to some extent by Mg2+, Mn2+, Ba2+and K+.
cilantro; acid phosphatase; isolation and purification; enzymatic properties
Q946.5
A
1002-6630(2015)21-0162-06
10.7506/spkx1002-6630-201521031
2014-12-23
重庆市科委重点攻关项目(CSTC, 2011AB1027)
王丹(1991—),女,硕士研究生,主要从事蛋白质与酶工程研究。E-mail:wdswu911@163.com
*通信作者:唐云明(1960—),男,教授,博士,主要从事蛋白质与酶工程研究。E-mail:tbright@swu.edu.cn
