大鼠孕期甲状腺功能及自身抗体变化的研究
2015-12-26乔潇张媛王帆乔欣梁钰涵陈钊谭丽褚晨晨孙盟朝林来祥
乔潇 张媛 王帆 乔欣 梁钰涵 陈钊 谭丽 褚晨晨 孙盟朝 林来祥
大鼠孕期甲状腺功能及自身抗体变化的研究
乔潇 张媛 王帆 乔欣 梁钰涵 陈钊 谭丽 褚晨晨 孙盟朝 林来祥
目的 观察Wistar大鼠正常孕期不同阶段甲状腺功能及自身抗体的变化规律。方法SPF/VAF级健康成年雌性Wistar大鼠64只,按随机数字法分为对照组、孕早期组、孕中期组、孕晚期组,每组各16只。后3组雌鼠与雄鼠合笼成功交配后,分别于孕7 d、14 d、20 d对雌鼠采用代谢笼收集尿液、股动脉放血处死,对照组与孕中期组同批处理。采用过硫酸铵消化-砷铈催化分光光度法测定尿碘浓度,化学发光免疫分析法测定总T3、总T4、游离T3、游离T4、促甲状腺激素(TSH)水平,放射免疫分析法测定甲状腺球蛋白(Tg)、甲状腺球蛋白抗体(TgAb)、甲状腺过氧化物酶抗体(TPOAb)水平。结果 4组间尿碘水平差异无统计学意义(χ2=2.798,P>0.05)。孕早期组总T3水平高于对照组,而孕中期组、孕晚期组总T3水平低于孕早期组(F=3.775,P<0.05)。与对照组相比,孕早期组总T4水平升高,而孕中期组及孕晚期组水平依次降低(P<0.05)。游离T3、游离T4水平有随孕期延长而逐渐下降的趋势,且孕中期组、孕晚期组与其余两组相比差异有统计学意义(F=34.718,41.715,P均<0.01)。游离T3/游离T4比值随孕期延长逐渐升高。与对照组相比,孕早期组、孕中期组、孕晚期组TSH水平依次升高,且孕中期组、孕晚期组差异有统计学意义(χ2=16.101,P<0.01)。Tg、TgAb、TPOAb水平在各组间差异均无统计学意义(P均>0.05)。结论 Wistar大鼠甲状腺功能在孕期不同阶段存在动态变化,与人体孕期变化规律基本一致,但大鼠孕期未显示甲状腺自身抗体的明显改变,提示大鼠有可能用于人类孕期实验研究。
孕期;甲状腺功能;自身抗体;大鼠
甲状腺是人体最大的内分泌腺,其合成和分泌的甲状腺激素具有促进机体、尤其是骨骼和中枢神经系统正常生长发育和组织分化的作用。碘是合成甲状腺激素的重要元素,孕期碘缺乏可影响母体甲状腺功能,即使是轻度的甲状腺功能减退症(甲减)、亚临床甲减也可能干扰妊娠结局。甲状腺自身抗体中的甲状腺球蛋白抗体(TgAb)和甲状腺过氧化物酶抗体(TPOAb),同样与先兆早产、流产、胎儿宫内发育迟缓、新生儿Apgar评分降低、子代出生缺陷等不良妊娠结局相关,也是产后甲状腺功能紊乱的重要危险因素和预示指标。因此,孕妇的碘营养、甲状腺功能及自身免疫状态的正常维持至关重要,在甲状腺疾病监测和干预中应给予特殊关注[1]。国内、外专业学会及其指南均推荐,各地区、实验室或医院应建立各自妊娠期特异性甲状腺功能正常参考值范围,并提倡对诊断为妊娠期亚临床甲减伴TPOAb阳性及临床甲减的孕妇给予左甲状腺素(LT4)替代治疗[2-3]。虽然有研究表明,孕期适量的LT4替代疗法对子代安全、有效,但目前国际尚无统一的干预方法、起始时间、剂量及持续时间等治疗标准[2-4]。针对以上问题的人群研究仍有一定的伦理局限性,这就需要更多的动物实验数据来支持。但应用何种动物模型更为适宜,还需更多探索。因此,笔者研究孕期大鼠甲状腺功能和自身抗体的变化规律、并与人体相对比,以期探讨大鼠能否作为动物模型而成为以上相关问题的研究载体。
1 材料与方法
1.1 实验动物与分组 选用体重220~260 g的健康成年雌性Wistar大鼠64只,雄性16只。购自中国人民解放军军事医学科学院实验动物中心,许可证号:SCXK-(军)2012-0004,属SPF/VAF级动物。大鼠在天津医科大学动物中心[编号:SYXK(津)2004-0001]饲养,雌、雄分开,置于不锈钢笼具内,饲养于温度和湿度恒定的动物室内,室内平均温度26℃,平均湿度50%,光照与黑暗时间各为12 h,定期对笼具进行清洗和室内消毒,动物自由进食和饮水。大鼠均饲以普通鼠饲料(平均碘含量为300 μg/kg)、自来水(碘含量为10μg/L)。根据大鼠平均进食量(20g/d)及饮水量(30ml/d)计算平均总碘摄入量为6.3μg/d。适应性喂养10 d后,将雌鼠以随机数字法分为4组:对照组、孕早期组、孕中期组、孕晚期组,每组各16只。后3组雌鼠与雄鼠1:1合笼交配(对照组雌鼠不参与交配,留作非孕期正常对照),次日晨查到阴栓记为孕0d,后 3 组雌鼠分别饲养至孕 7 d、14 d、20 d,采用代谢笼收集尿液、股动脉放血处死,对照组与孕中期组同批处理。股动脉血静置1 h,3000 r/min(r=16 cm)离心15 min,分离血清。取材标本于-80℃保存备用。
1.2 检测指标 过硫酸铵消化-砷铈催化分光光度法测定大鼠尿碘浓度。采用化学发光免疫分析法及德国Bayer试剂盒,测定大鼠血清总T3、总T4、游离T3、游离 T4、促甲状腺激素(TSH)浓度,样品测定及数据读取处理由德国拜尔公司自动化学发光分析系统完成。采用放射免疫分析法测定甲状腺球蛋白(Tg)浓度、TgAb(P-N)/T比值、TPOAb P/T%比值,试剂盒购自北京北方生物技术研究所。
1.3 统计学处理 采用SPSS16.0统计软件包进行数据统计与分析。符合偏态分布,用中位数表示,组间比较采用非参数检验(Kruskal-Wallis H test),进一步组间两两比较采用Mann-Whitney U及Wilcoxon W检验;符合正态分布,用±s表示,组间均数比较采用单因素方差分析(One-Way ANOVA),进一步组间两两比较采用LSD检验 (方差齐时)或Tamhane's T2检验(方差不齐时)。P<0.05为差异有统计学意义。
2 结果
2.1 尿碘水平 与对照组相比,孕早期组尿碘水平无明显变化,孕中期组、孕晚期组有升高趋势,但4组间差异无统计学意义(P>0.05),见表1。
2.2 甲状腺功能 孕早期组大鼠血清总T3水平高于对照组(P<0.05),孕中期组、孕晚期组低于孕早期组(P<0.05),但与对照组无明显差异。与对照组相比,孕早期组总T4水平升高,而孕中期组、孕晚期组依次降低,4组间两两比较差异均有统计学意义(P均<0.05)。血清游离T3、游离T4水平有随孕期延长而逐渐下降的趋势,且孕中期组的游离T4水平、孕晚期组游离T3、游离T4水平明显低于对照组(P均<0.05),孕中期组游离T3、孕晚期组游离T3、游离T4明显低于孕早期组(P均<0.05),孕晚期组游离T3、游离T4低于孕中期组(P均<0.05);游离T3/游离T4比值随孕期延长逐渐升高。与对照组相比,孕早期组、孕中期组、孕晚期组TSH水平依次升高,且孕中期组、孕晚期组差异有统计学意义(P均<0.05),见表1。
2.3 Tg及甲状腺自身抗体水平 Tg、TgAb、TPOAb水平在各组间差异均无统计学意义(P均>0.05),但孕期Tg存在升高趋势,见表1。
表1 各组大鼠尿碘、血清甲状腺激素、Tg及甲状腺自身抗体水平比较(±s)
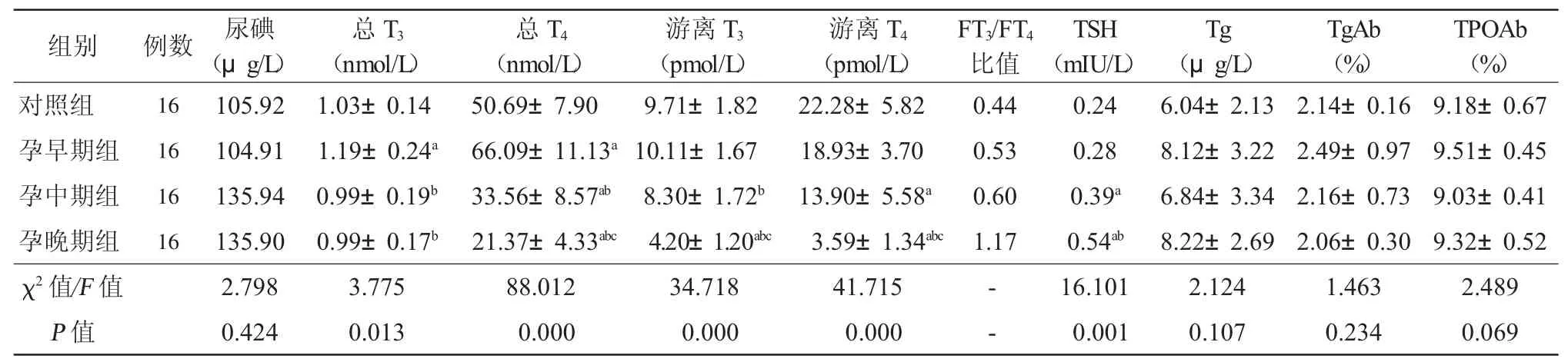
表1 各组大鼠尿碘、血清甲状腺激素、Tg及甲状腺自身抗体水平比较(±s)
注:尿碘及TSH以中位数表示;与对照组相比,aP<0.05;与孕早期组相比,bP<0.05;与孕中期组相比,cP<0.05;Tg:甲状腺球蛋白;FT3:游离T3;FT4:游离 T4;TSH:促甲状腺激素;TgAb:甲状腺球蛋白抗体;TPOAb:甲状腺过氧化物酶抗体
?
3 讨论
甲状腺激素对于胎儿生长发育、尤其是神经系统发育非常重要。在人类,孕11周以前胎儿甲状腺功能尚未建立,主要通过胎盘从母体获得甲状腺激素;孕12周以后,胎儿的下丘脑、垂体开始产生TSH释放激素和TSH,甲状腺开始摄碘并分泌甲状腺激素;孕26周以后,胎儿甲状腺功能完整建立。对应于大鼠,相当于胎鼠甲状腺在孕16 d开始具有摄碘功能,孕17.5~18 d后才开始合成甲状腺激素,孕20 d甲状腺功能完整建立。孕期母体容易发生甲状腺功能异常尤其是甲减,不仅对其本身造成不良影响,而且会增加胎儿的危险[5]。早期诊断和治疗临床甲减和亚临床甲减,能够降低妊娠不良结局和后代神经智力发育损害的风险。动物实验亦表明,低碘大鼠随着孕期延长,死胎、流产、畸形发生率增加[6]。孕期母鼠甲状腺激素缺乏可影响仔鼠脑发育,尤其是大脑皮质和海马的发育[7]。对于孕期母鼠亚临床甲减,孕13 d之前进行LT4治疗可促进仔鼠体重正常发育、学习和记忆能力恢复。女性在妊娠期体内激素和代谢将发生许多改变,包括母体循环血容量、肾血流量以及肾小球滤过率增加,因此,尿量增加的同时也使血浆碘经肾脏的清除率增加1.3~1.5倍。本实验中,4组大鼠尿碘浓度的差异在统计学上虽不显著,但孕中期组、孕晚期组均为对照组的1.28倍,与人体一致。在人体,由于孕期高水平的雌激素刺激肝脏合成甲状腺结合球蛋白(TBG)增加,加上N-乙酰半乳糖胺的糖基化增加,导致TBG半衰期延长、代谢清除率减慢,使血浆TBG水平从妊娠6~10周开始升高、8~12周时达到非妊娠时的2~3倍,并持续妊娠的全过程。此外,为了满足母体代谢和胎儿发育所需足够的游离T3、游离T4,母体必须合成更多的总T3、总T4。目前,对妊娠期血清总T3、总T4水平变化的认识比较统一,即妊娠各期均较孕前显著升高,且总T4更为明显,妊娠16周时总 T4水平约为非孕期的 1.27~1.50 倍[2,8]。本实验中,孕早期组总T3、总T4分别为对照组的1.16倍、1.30倍,但孕中期组、孕晚期组总T3轻微降低、总T4显著低于对照组并依次降低,分析其原因为:(1)大鼠总T3、总T4对TBG的反应可能不及人类明显。(2)在妊娠后半期,胎盘Ⅲ型3,5脱碘酶含量显著增加,使T4脱碘成为反 T3,导致了血清低 T3、低T4。(3)本实验过程中,孕期母鼠所食用的是普通鼠饲料而非繁殖期鼠饲料,直接导致孕期母鼠碘摄入相对不足而使甲状腺激素合成受限,这也印证了人体孕期需碘量相对增多,若按照普通成人碘营养标准对孕妇补碘会导致其碘摄入相对不足,从而影响孕母及胎儿的甲状腺功能[3]。虽然本实验结果显示尿碘水平在大鼠孕期有升高趋势,但正如前述,这并不真正反映大鼠体内碘水平,而主要是由血浆碘经肾脏的清除率增加所致。人绒毛膜促性腺激素(hCG)于妊娠第9~11周达高峰,然后开始下降,第18周后稳定在较低水平[9]。hCG与TSH有相同的α亚单位、相似的β亚单位和受体亚单位,其与游离T4水平呈正相关、与TSH水平呈镜像关系。至孕晚期,hCG比孕早期明显下降,不足以继续维持游离T3、游离T4处于较高水平。因此,人体孕早期游离T3、游离T4高于非孕对照组,孕中、晚期低于对照组并依次降低[10-11]。而TSH在孕早期达到最低谷,随后于孕中、晚期慢慢升高但仍不及正常水平或至产前达到孕前水平甚至超过正常水平[2,9-11]。另一方面,孕期基础代谢率增加、尿碘经肾脏的排泄增加以及胎儿快速生长发育对碘的需求增多,以上因素导致母体在碘摄入不增加的情况下,碘储备的消耗加快,更容易使甲状腺激素合成不足。因而,另有研究发现,游离T3、游离T4从孕早期即低于对照组并随孕周增加而逐渐降低[2]。此类研究结果之所以略有差异,可能与各地区碘营养状况、实验室、检测方法以及研究对象的样本量、年龄、体重、妊娠时间、种族等因素有关[2,12]。但是,总体趋势都遵循在孕期内随着孕周延长,游离T3、游离T4逐渐降低,TSH逐渐升高的规律。笔者前期动物实验亦发现,正常碘营养水平的Wistar大鼠孕20 d血清游离T3、游离 T4、总 T3、总 T4均较孕 16 d 时降低,TSH、游离T3/游离T4比值均升高;胎鼠羊水游离T3、游离T4降低,游离T3/游离T4比值升高[13]。本实验结果同样表明,大鼠随孕期延长有游离T3、游离T4逐渐下降、TSH依次升高的趋势,以孕中期组、孕晚期组为著,此动态变化与人体相同。此外,本实验大鼠血清游离T3/游离T4比值随孕期延长逐渐升高,显示大鼠孕期处于甲状腺功能减退的代偿状态。其原因可能为食用普通鼠饲料的Wistar大鼠孕期相对缺碘时,甲状腺中优先合成一碘甲腺原氨酸,而二碘甲腺原氨酸相对减少,即最终合成T4减少、T3相对增多,从而维持体内有生物活性的、基本的T3浓度[14]。支持了孕妇对碘的需要量比普通人群增大、以及把妊娠妇女纳入到碘缺乏病及甲状腺功能筛查常规监测人群的观点[15]。
Tg是由正常甲状腺滤泡上皮细胞合成的大分子碘化糖蛋白。在母体致病因素作用下,甲状腺滤泡被破坏,Tg从中溢入血液,使血清Tg水平升高,并作为抗原产生甲状腺自身抗体,从而造成孕期母体各种自身免疫性甲状腺疾病。另一方面,Tg在一定程度上也可反映碘营养状态,如碘缺乏的孕期母体TSH水平升高,刺激Tg的合成与水解,使其本身和T3、T4释放入血均增加[16]。本实验中与对照组相比,大鼠孕期Tg的变化均无统计学意义,但在孕期存在升高趋势,与前述孕鼠因碘摄入相对缺乏而导致TSH水平升高相符。甲状腺特异性抗体是机体免疫功能紊乱的标志。其中,TgAb和TPOAb不仅与甲状腺组织的损伤、功能异常有密切关系,也与自发性流产、早产有关[17-18]。TPOAb属IgG型抗体,可自由透过胎盘并对子代的智力、听力发育及甲状腺功能造成不良影响。在人体,正常情况下,妊娠期TgAb、TPOAb滴度或阳性率降低,母体的免疫抑制在妊娠前半期最强,妊娠后半期处于免疫抑制平台期[19]。本实验中,各孕期TgAb、TPOAb与对照组相比,差异均无统计学意义。
总之,Wistar大鼠甲状腺功能在孕期不同阶段存在动态波动,其变化规律与人体基本一致,甲状腺自身抗体未显示明显改变。因此,可以考虑将大鼠作为动物模型,用于探究孕期甲状腺功能的异常是否应予以干预,以及为探索干预手段和方法提供动物实验基础。
[1]Sarapatkova H,Sarapatka J,Frysak Z.What is the benefit of screening for thyroid function in pregnant women in the detection of newly diagnosed thyropathies?[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2013,157(4):358-362.
[2]Yan YQ,Dong ZL,Dong L,et al.Trimester-and method-specific reference intervals for thyroid tests in pregnant Chinese women:methodology,euthyroid definition and iodine status can influence the setting of reference intervals[J].Clin Endocrinol(Oxf),2011,74(2):262-269.
[3]中华医学会内分泌学分会,中华医学会围产医学分会.妊娠和产后甲状腺疾病诊治指南[J].中华内分泌代谢杂志,2012,28(5):354-371.
[4]JayaramanM,VermaA,HarikumarKV,etal.Pregnancy outcomes with thyroxine replacement for subclinical hypothyroidism:rRole of thyroid autoimmunity[J].Indian J Endocrinol Metab,2013,17(2):294-297.
[5]Teng W,Shan Z,Patil-Sisodia K,et al.Hypothyroidism in pregnancy[J].Lancet Diabetes Endocrinol,2013,1(3):228-237.
[6]刘丽香,申红梅,董瑞强等.碘对妊娠期大鼠甲状腺形态变化及妊娠结局的影响研究[J].中国地方病防治杂志,2014,29(1):1-4.
[7]Ausó E,Lavado-Autric R,Cuevas E,et al.A moderate and transient deficiency of maternal thyroid function at the beginning of fetal neocorticogenesis alters neuronal migration[J].Endocrinology,2004,145(9):4037-4047.
[8]Chang DL,Pearce EN.Screening for maternal thyroid dysfunction in pregnancy:a review of the clinical evidence and current guidelines[J].J Thyroid Res,2013,2013:851326.
[9]Li C,Shan Z,Mao J,et al.Assessment of thyroid function during first-trimester pregnancy:what is the rational upper limit of serum TSH during the first trimester in Chinese pregnant women?[J].J Clin Endocrinol Metab,2014,99(1):73-79.
[10]Aguayo A,Grau G,Vela A,et al.Urinary iodine and thyroid function in a population of healthy pregnant women in the North of Spain[J].J Trace Elem Med Biol,2013,27(4):302-306.
[11]Ekinci EI,Lu ZX,Sikaris K,et al.Longitudinal assessment of thyroid function in pregnancy[J].Ann Clin Biochem,2013,50(Pt 6):595-602.
[12]Haddow JE,Craig WY,Palomaki GE,et al.Impact of adjusting for the reciprocal relationship between maternal weight and free thyroxine during earlypregnancy[J].Thyroid,2013,23(2):225-230.
[13]孙毅娜.不同碘营养对母-胎碘代谢、甲状腺功能、胎脑发育及胎盘调控机制的实验研究[D].天津:天津医科大学研究生院,2009:1-122.
[14]Lavado-Autric R,Calvo RM,de Mena RM,et al.Deiodinase activities in thyroids and tissues of iodine-deficient female rats[J].Endocrinology,2013,154(1):529-536.
[15]Velasco I,Martín J,Gallego M,et al.Maternal-fetal thyroid function at the time of birth and its relation with iodine intake[J].Thyroid,2013,23(12):1619-1626.
[16]Ma ZF,Skeaff SA.Thyroglobulin as a biomarker of iodine deficiency:a review[J].Thyroid,2014,24(8):1195-1209.
[17]Meng F,Zhao R,Liu P,et al.Assessment of iodine status in children,adults,pregnant women and lactating women in iodine-replete areas of China[J].PLoS One,2013,8(11):e81294.
[18]Mehran L,Tohidi M,Sarvghadi F,et al.Management of thyroid peroxidase antibody euthyroid women in pregnancy:comparison of the American Thyroid Association and the Endocrine Society guidelines[J].J Thyroid Res,2013,2013:542692.
[19]WHO/UNICEF/ICCIDD.Assessmentofiodine deficiency disorders and monitoring their elimination:A guide for programme managers.3rd edition.Geneva:WHO Press,2008.
Changes of thyroid function and autoantibodies during the pregnancy of rats
Qiao Xiao*,Zhang Yuan,Wang Fan,Qiao Xin,Liang Yuhan,Chen Zhao,Tan Li,Chu Chenchen,Sun Mengzhao,Lin Laixiang.*The Institute of Endocrinology,Tianjin Medical University,Key Laboratory of Hormones and Development,Ministry of Health,Tianjin 300070,China
Lin Laixiang,Email:linlaixiang2005@126.com;Zhang Yuan,Email:zhangy@tijmu.edu.cn
ObjectiveTo study the changes of thyroid function and autoantibodies in each trimester of pregnancy in Wistar rats.MethodsSixty-four healthy female adult SPF/VAF weaning Wistar rats were divided into 4 groups according to a random number table:control group,the 1st trimester group,the 2nd trimester group and the 3rd trimester group,with 16 rats in each group.Rats in the latter 3 groups were mated with male rats.Urine frompregnant rats were collected with metabolismcages and blood samples were collected by exsanguination from femoral artery at the 7th,14th and 20th day of their pregnancy,respectively.Rats in control group and rats in the 2nd trimester group were treated at the same time.Urinary iodine concentration(UIC)was determined by As3+-Ce4+catalytic spectrophotometry using ammonium persulfate digestion.Serum total triiodothyronine(TT3)and thyroxine(TT4),free triiodothyronine(FT3)and thyroxine(FT4),and thyroid stimulating hormone(TSH)were measured by chemiluminescence immunoassay.Serum thyroglobulin(Tg),thyroglobulinantibody(TgAb)andthyroidperoxidaseantibody(TPOAb)weredetermined byradioimmunoassay.ResultsUIC of all groups showed no significant differences(χ2=2.798,P>0.05).TT3level of the 1st trimester group was increased compared with control group,but were decreased later in the 2nd and 3rd trimester group(F=3.775,P<0.05).Compared with control group,TT4was higher in the 1st trimester group but were lower in the 2nd and 3rd trimester group with TT4decreased more in the 3rd trimester group(P<0.05).FT3and FT4had a trend to decrease after pregnancy and the differences between the 1st and the 2nd trimester group and the other two groups were significant(F=34.718,41.715,allP<0.01).FT3/FT4ratiogradually increased throughout pregnancy.Compared with control group,TSH in the 1st,2nd and 3rd trimester group were progressively increased,and in the 2nd and 3rd trimester group,the differences were significant(χ2=16.101,P<0.01).There was no significant difference of Tg,TgAb,TPOAb among all groups(allP>0.05).ConclusionThyroid function is different in different trimester of pregnancy in Wiatar rats,which is similar tohuman.But there is noalteration ofthyroid autoantibodies duringpregnancyofrats.Rat maybe a useful model tostudyhuman pregnancy.
Pregnancy;Thyroid function;Autoantibodies;Rats
(Int J Endocrinol Metab,2015,35:80-83)
10.3760/cma.j.issn.1673-4157.2015.02.003
国家自然科学基金资助项目(30671816);国家级大学生创新创业训练计划项目(201310062003)
300070 天津医科大学内分泌研究所,卫生部激素与发育重点实验室(乔潇,孙盟朝,林来祥);基础医学院临床七年制(乔潇,王帆,乔欣,梁钰涵,陈钊);临床五年制(谭丽,褚晨晨);生理教研室(张媛)
林来祥,Email:linlaixiang2005@126.com;张媛,Email:zhangy@tijmu.edu.cn
2014-10-24)
