1株大熊猫肠道纤维素降解菌的分离鉴定及其酶学性质
2015-12-26吕雯婷宋亮丽张海峰孙小琴颜其贵
赵 珊, 吕雯婷, 刘 杰, 宋亮丽, 张海峰, 孙小琴, 颜其贵,2*
(1.四川农业大学 动物医学院,四川 雅安 625014;2.四川农业大学 动物疫病与人类健康四川省重点实验室,四川 雅安 625014)
1株大熊猫肠道纤维素降解菌的分离鉴定及其酶学性质
赵 珊1, 吕雯婷1, 刘 杰1, 宋亮丽1, 张海峰1, 孙小琴1, 颜其贵1,2*
(1.四川农业大学 动物医学院,四川 雅安 625014;2.四川农业大学 动物疫病与人类健康四川省重点实验室,四川 雅安 625014)
以羧甲基纤维素钠为唯一碳源,利用刚果红染色法,从大熊猫粪便内筛选具有降解纤维素能力的菌株,并研究其酶学特性。分离获得1株酶活力较高的菌株A1,通过形态学和BD PhoenixTM-100全自动细菌鉴定仪鉴定为蜡样芽胞杆菌(Bacilluscereus)。菌株A1最适生长条件和酶活力测定表明,其最适生长温度为37 ℃,NaCl浓度为0.5%,pH值为7.0,内切葡聚糖苷酶、外切葡聚糖苷酶、β-葡萄糖苷酶和总酶活的最大值分别为0.139、0.074、0.126、0.108 5 IU/mL。丰富了大熊猫肠道纤维素降解菌的种类,为后续研究大熊猫如何消化利用竹纤维提供了菌源。
大熊猫;纤维素降解菌;蜡样芽胞杆菌
大熊猫(Ailuropodamelanoleuca)是我国特有的珍稀野生动物,1984年被列入世界10种濒危物种之一。10月龄左右的亚成年体大熊猫,食性开始由母乳等高蛋白食物逐渐转变为以竹子为主食的高纤维食物[1]。成年后,每只大熊猫平均每天摄取竹类物质高达12.5 kg[2],大熊猫除了能消化利用竹子中的营养物质外,还能利用其中8%的纤维素及27%的半纤维素[3]。大熊猫基因组序列显示[4],大熊猫具有食肉类消化系统的相关消化酶类基因,但并没有相关纤维素酶类的基因。朱立峰等[5]通过宏基因组学研究,发现大熊猫肠道菌群的纤维素酶及半纤维素酶相关基因。大熊猫肠道内的共生细菌帮助其消化利用竹纤维并参与重要营养物质的代谢。大熊猫的消化系统与食肉类相似,肠道分为小肠和大肠,没有盲肠,肠道短,含氧量较高,所以推测大熊猫肠道更适合需氧或兼性厌氧的细菌生长。目前国内外对大熊猫肠道菌群的研究多集中于致病菌方面[6-7],对大熊猫肠道纤维素降解菌的研究较少。本实验从四川卧龙自然保护区的新鲜大熊猫粪便中分离鉴定出1株酶活较高的好氧纤维素降解菌A1,并对其生长条件及产酶性质进行了初步研究,为后续研究大熊猫肠道菌群及纤维素的有效利用提供一些基础资料。
1 材料与方法
1.1 材料
1.1.1 样品 采集自四川卧龙自然保护区的10份健康大熊猫的新鲜粪便。
1.1.2 培养基 ①选择培养基:羧甲基纤维素钠10.0 g,胰蛋白胨2.5 g,酵母浸出物0.5 g,NaCl 5 g,KH2PO41 g,MgSO40.2 g,(NH4)2SO41 g,琼脂20 g,蒸馏水1 000 mL,pH 7.0;②扩大培养基:羧甲基纤维素钠10.0 g,胰蛋白胨2.5 g,酵母浸出物0.5 g,NaCl 5 g,KH2PO41 g,MgSO40.2 g,(NH4)2SO41 g,蒸馏水1 000 mL,pH 7.0;③产酶液体培养基:1 cm×6 cm新华牌滤纸条,胰蛋白胨2.5 g,酵母浸出物0.5 g,NaCl 5 g,KH2PO41 g,MgSO40.2 g,(NH4)2SO41 g,蒸馏水1 000 mL,pH 7.0。
1.1.3 主要试剂及仪器 胰蛋白胨、酵母浸出物等试剂购自Sigma公司,其余试剂均为国产分析纯;BD PhoenixTM-100全自动细菌鉴定仪购自美国BD公司,V-1100D型可见分光光度计购自上海美谱达仪器公司,Thermo 481型恒温/制冷摇床购自THERMO FORMA公司。
1.2 方法
1.2.1 纤维素降解菌的筛选 无菌条件下从粪便样品内部取5 g样品,用无菌生理盐水进行系列稀释。用L棒将200 μL稀释后的样品液均匀涂布于CMC-Na选择培养基上,有氧条件下37 ℃培养48 h。菌落长出后,用1 mg/mL的刚果红染液对平板染色15 min,然后用1 mol/mL NaCl脱色15 min,挑选菌落周围有明显水解圈的单个菌落在CMC-Na平板上反复划线纯化培养,保存菌种备用[8]。用无菌牙签挑取各样品平板上的单菌落点种到含1 mg/mL刚果红的CMC-Na选择培养基上,待菌落长出后,测量各菌株的菌落直径C(cm)和水解圈直径H(cm),每株菌株设置3个平行试验组。根据H/C值选出酶活较强的菌株[9]。
1.2.2 纤维素降解菌的形态观察 对细菌进行革兰染色后,在显微镜下观察菌体的形态。
1.2.3 纤维素降解菌的鉴定 依照国家标准GB/T 4789.14-2003,针对革兰染色结果,利用BD PhoenixTM-100全自动细菌鉴定仪对筛选出的纤维素降解菌进行鉴定[10]。
1.2.4 菌株扩大培养 用接种环取A1单个菌落1环,接种于盛有50 mL CMC-Na扩大培养基的250 mL血清瓶中,37 ℃、220 r/min培养30~48 h。
1.2.5 菌株A1最适生长条件的研究 ①培养基起始pH值对菌株生长的影响:按4%的接种量将发酵液分别接种于pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0的50 mL CMC-Na扩大培养基中,37 ℃、220 r/min培养48 h,分别取样测OD600值;②培养基起始NaCl浓度对菌株生长的影响:按4%的接种量将发酵液分别接种于NaCl浓度为0%、0.5%、1.0%、2.0%、5.0%、8.0%和11.0%的50 mL CMC-Na扩大培养基中,37 ℃、220 r/min培养48 h,分别取样测OD600值;③不同培养温度对菌株生长的影响:按4%接种量接种后的CMC-Na扩大培养基,于5、20、30、37、50 ℃,220 r/min培养48 h,分别取样测OD600值;④培养时间对菌株生长的影响:以优化后的培养条件对菌株进行连续培养120 h,每隔12 h取样测定发酵液OD600值。
1.2.6 菌株A1纤维素酶活性的测定 绘制DNS(3,5-二硝基水杨酸)试剂测还原糖量的葡萄糖标准曲线[11]。以优化后的培养条件对菌株A1进行培养,在培养6、12、24、36、48、60、72、84、96、120 h后分别取样,将发酵液4 000 r/min离心15 min后收集上清液,即得粗酶液[12]。分别取1 mL粗酶液加入以1% (质量与体积比) CMC-Na、1%微晶纤维素、1%水杨苷、50 mg滤纸为底物的1.5 mL柠檬酸缓冲液中,于37 ℃下反应1 h(测外切酶和总酶活时反应2 h),加2 mL DNS试剂,煮沸5 min,冷却定容至25 mL,以失活酶为对照组调零,在540 nm波长下测定吸光值。利用葡萄糖标准曲线,分别计算出内切葡聚糖苷酶(EG)、外切葡聚糖苷酶(CBH)、β-葡萄糖苷酶(BG)和总纤维素酶活力(FPA)[13-15]。酶活力单位定义:每分钟降解底物释放1 μmol葡萄糖所需的酶量为一个酶活力单位(IU)。
1.2.7 滤纸降解率的测定 用以滤纸为唯一碳源的产酶液体培养基分别培养A1菌株7、14、28 d,准确称量降解前后的滤纸条干重,利用差重法计算滤纸降解率[16]。
2 结果与分析
2.1 纤维素降解菌的筛选
经过反复纯化筛选,在有氧条件下获得3株水解圈较明显的菌株A1、A2和A3,3株菌株的H(cm)/C(cm)值见表1,以H/C值最大的A1作为后续研究菌种,A1水解圈照片见图1。
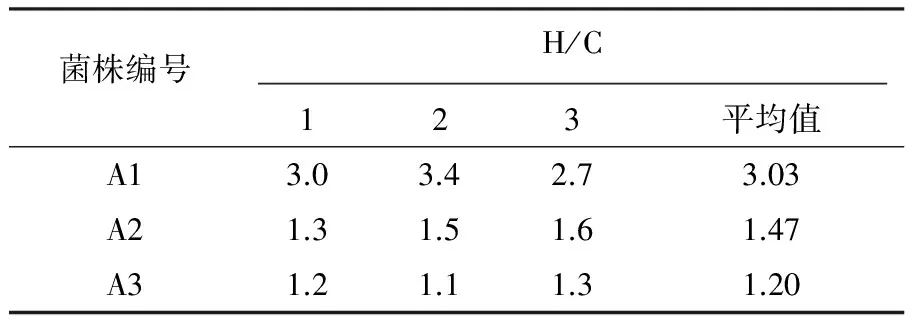
表1 纤维素降解菌株的刚果红染色结果

图1 菌株A1的水解圈照片Fig.1 The Hydrolysis circle photo of strain A1
2.2 菌株A1的形态观察
菌株A1培养48 h后,菌落近似圆形,扁平,乳白色且表面较粗糙。革兰染色为阳性,菌体呈长杆状,中生圆柱形芽胞。菌体形态见图2。

图2 菌株A1的显微形态Fig.2 The microcosmic modality of strains A1
2.3 菌株A1的鉴定
BD PhoenixTM-100全自动细菌鉴定仪鉴定菌株A1为蜡样芽胞杆菌,生理生化试验结果见表2。

表2 菌株A1生理生化试验结果
注:“+”阳性; “-”阴性;“ND”:无数据
2.4 菌株A1的最适生长条件
各因素对菌株A1生长的影响见图3。由图3可知,12~24 h为菌株A1的生长调整期,24 h后进入生长指数期,72 h达到峰值,72 h后为衰亡期。培养基初始pH值对菌株A1生长的影响较大,当pH值为7.0时菌株A1生长最好,pH值为6.0~9.0时生长较好,说明菌株A1对碱性环境有一定的耐受性。设置不同NaCl浓度的发酵液培养菌株,结果表明菌株A1在0.5% NaCl时生长最好,且随着NaCl浓度增大,生长能力降低。不同细菌的生长需要不同的培养温度,人们通过采集各种环境温度的样品以期获得不同嗜温性的细菌[17-18]。本研究中,菌株A1在37 ℃时生长最好,温度高于45 ℃后菌株几乎不生长。故后续研究菌株A1产纤维素酶活性时,培养基初始pH调为7.0,NaCl浓度调为0.5%,培养温度为37 ℃。
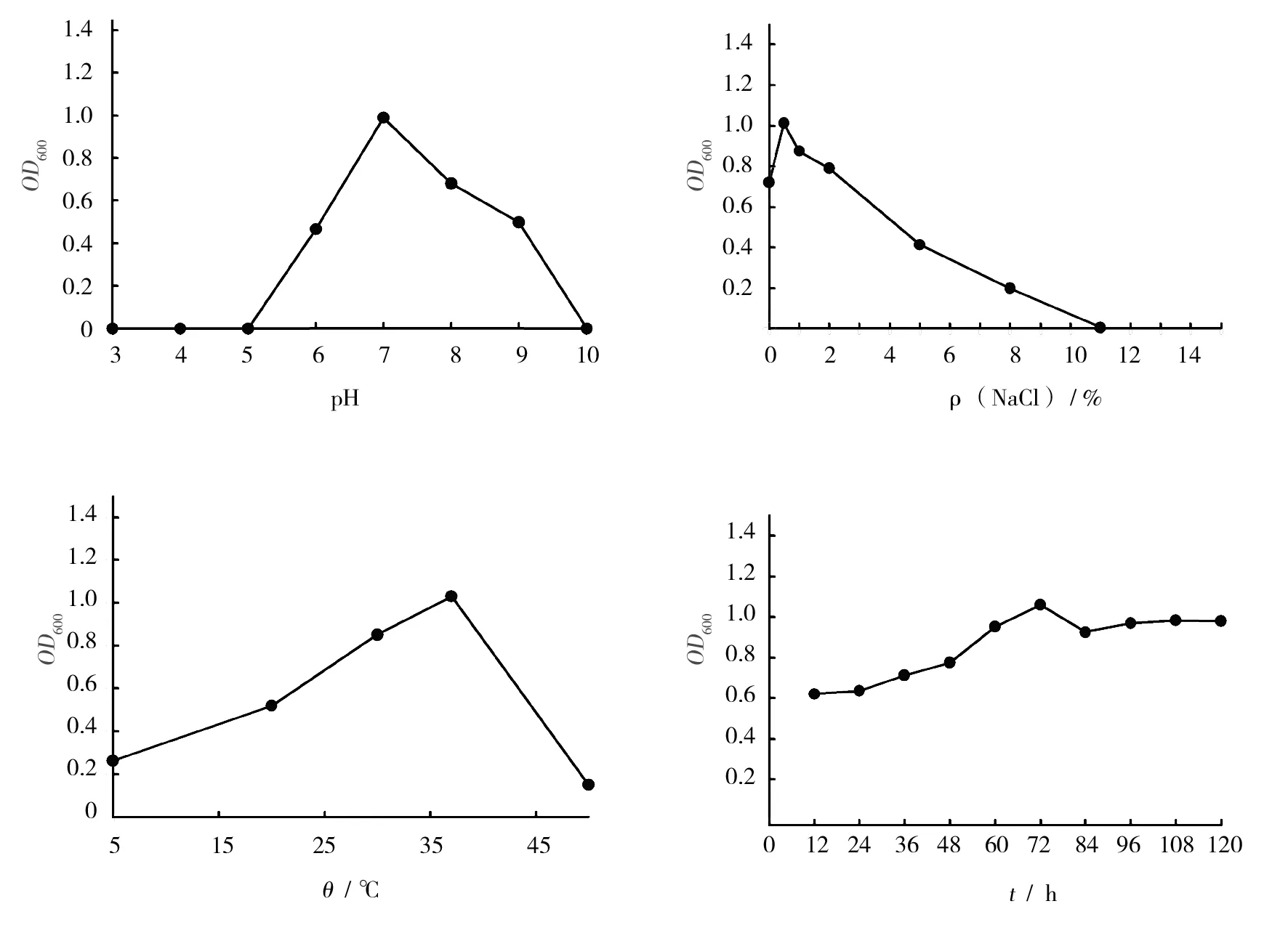
图3 各因素对菌株A1生长的影响Fig.3 Effect of various factors on the growth of strain A1
2.5 菌株A1的纤维素酶活性
纤维素的生物降解过程涉及到一组复合的纤维素酶,一般认为包括3种,分别为内切葡聚糖苷酶,简称内切酶;外切葡聚糖苷酶,简称外切酶;β-葡萄糖苷酶,也称纤维二糖酶[19]。以滤纸为底物培养菌株A1,连续测定不同时间的纤维素酶总酶活和各组分酶活力,试验结果见图4。由图4可知,菌株A1的纤维素酶系包括以上3种酶,培养48 h后外切葡聚糖苷酶活性(CBH)和滤纸酶活性(FPA)达到最大值,分别为0.074、0.108 5 IU/mL;培养60 h后β-葡萄糖苷酶活性(BG)达到最大值为0.126 IU/mL;培养72 h后内切葡聚糖苷酶活性(EG)达到最大值为0.139 IU/mL。各组分酶达到最大值的时间均在细菌生长指数期内(见图3),表明细菌生长较快,代谢活动旺盛,产胞外纤维素酶的活性也较强。4条纤维素酶活力变化曲线走向非常相似,很好地表明了纤维素复合酶系的协同作用[20]。
2.6 菌株A1的滤纸降解率
滤纸降解率试验结果见图5,菌株A1对滤纸有一定的降解能力,但其降解率并不高[21]。
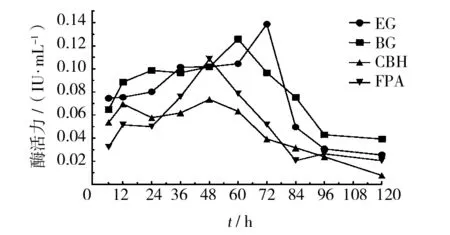
图4 菌株A1产纤维素酶活力变化曲线Fig.4 Cellulase production changes of strains A1
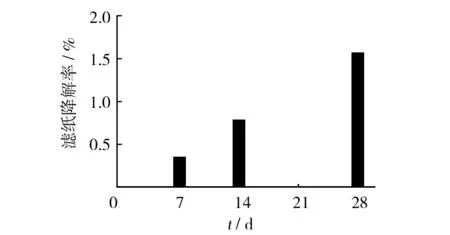
图5 菌株A1滤纸降解率试验结果Fig.5 The result of filter paper degradation rate test of strain A1
3 讨 论
大熊猫如何消化和利用竹纤维一直都是研究的热点。本研究利用筛选培养基,从大熊猫的新鲜粪便中成功筛选出1株酶活力较高的好氧纤维素降解菌A1,经BD PhoenixTM-100全自动细菌鉴定仪鉴定为蜡样芽胞杆菌(Bacilluscereus)。菌株A1能够在pH范围为6.0~9.0内生长(最适pH为7.0),对碱性环境有一定的耐受能力;最适生长温度为37 ℃,最适NaCl浓度为0.5%。与以往同类研究相比,本次实验利用BD PhoenixTM-100全自动细菌鉴定仪准确且快速鉴定了菌种种类,同时首次分离出大熊猫肠道内具有降解纤维素能力的蜡样芽胞杆菌。菌株A1具有完整的3种纤维素酶,以滤纸为碳源测定纤维素酶活力时,总酶活最大值为0.108 5 IU/mL,虽然与国内已有报道的高酶活蜡样芽胞杆菌的酶活力相比还比较低[22],但这也说明了大熊猫消化与利用竹纤维不只依赖细菌,还与胃内纤毛虫有密切关系[23]。菌株A1的分离鉴定丰富了大熊猫肠道菌群种类,为以后研究大熊猫肠道内降解纤维素的机制提供了菌源。菌株A1对碱性环境有一定的耐受能力,后续研究中可以通过适当添加纤维素酶激活剂[24]或通过诱变、优化培养条件和基因工程手段等提高产酶量,使其在实际生产中有更加广阔的应用前景。
[1] 熊焰,李德生,王印,等.卧龙自然保护区大熊猫粪样菌群的分离鉴定与分布研究[J].畜牧兽医学报,2000,31(2):165-170.
[2] Johnson K G, Schaller G B, Jinchu H. Comparative behavior of red and giant pandas in the Wolong Reserve, China[J]. Journal of mammalogy, 1988: 552-564.
[3] Dierenfeld E S, Hintz H F, Robertson J B. Utilization of Bamboo by the Giant Panda1[J]. J. Nutr,1982,112: 636-641.
[4] Li R, Fan W, Tian G, et al.The sequence and de novo assembly of the giant panda genome[J].Nature,2009, 463(7279):311-317.
[5] Zhu L, Wu Q, Dai J, et al. Evidence of cellulose metabolism by the giant panda gut microbiome[J]. Proceedings of the National Academy of Sciences,2011,108(43):17714-17719.
[6] 彭广能,熊焰.大熊猫肺炎克雷伯氏菌的研究现状[J].四川畜牧兽医,2000,27(B07): 86-87.
[7] 王旭,颜其贵,陈世界,等.大熊猫源停乳链球菌类马亚种的分离与鉴定[J].中国兽医科学,2011,41(5): 464-469.
[8] 朱军莉,韩剑众,励建荣.纤维素分解菌 BSX5 的分离、鉴定及产酶条件[J].食品与生物技术学报,2006,25(3):15-18.
[9] Teather R M, Wood P J. Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen[J].Applied and environmental microbiology,1982,43(4):777-780.
[10]江玉姬,邓优锦,刘新锐,等.一株能高效降解几种有机磷农药的菌株JS018的鉴定[J].微生物学报,2006,46(3):463-466.
[11]管斌.还原糖测定方法的规范[J].无锡轻工大学学报:食品与生物技术,1999,18(3):74-79.
[12]钱林,郑巧利,付瑾,等.一株高效纤维素降解菌株的分离鉴定及其酶学性质[J].微生物学通报,2010,37(4):524-528.
[13]Ghose T K. Measurement of cellulase activities[J]. Pure Appl Chem,1987,59(2):257-268.
[14]Coward-Kelly G, Aiello-Mazzari C, Kim S, et al. Suggested improvements to the standard filter paper assay used to measure cellulase activity[J].Biotechnology and bioengineering,2003,82(6):745-749.
[15]Lv W, Yu Z. Isolation and characterization of two thermophilic cellulolytic strains ofClostridiumthermocellumfrom a compost sample[J].Journal of applied microbiology,2013,114(4):1001-1007.
[16]周俊强,邱忠平,韩云平,等.纤维素降解菌的筛选及其产酶特性[J].环境工程学报,2010,(3):705-708.
[17]陈红漫,孙玉辉,阚国仕,等.产耐热纤维素酶菌株的分子鉴定及产酶条件优化[J].食品与发酵工业,2011, 37(7):28-33.
[18]Sizova M V, Izquierdo J A, Panikov N S, et al. Cellulose-and xylan-degrading thermophilic anaerobic bacteria from biocompost[J].Applied and environmental microbiology,2011,77(7):2282-2291.
[19]Kansoh A L, Essam S A, Zeinat A N. Biodegradation and utilization of bagasse with Trichoderma reesie[J]. Polymer degradation and stability,1999,63(2):273-278.
[20]Henrissat B, Driguez H, Viet C, et al. Synergism of cellulases fromTrichodermareeseiin the degradation of cellulose[J].Nature Biotechnology,1985,3(8):722-726.
[21]刘占英,侯先志,刘玉承,等.一株分解纤维素的肠球菌的分离鉴定[J].内蒙古大学学报:自然科学版, 2008,39(2):166-171.
[22]燕红,杨谦.蜡样芽胞杆菌对稻草的降解作用[J].哈尔滨工业大学学报,2008,40(8):1242-1246.
[23]费立松,杨光友,张志和,等.大熊猫胃内纤毛虫检测初报[J].动物学报,2005,51(3):526-529.
[24]张启先.纤维素和纤维素酶[J].微生物学通报,1976,3(2):31.
Isolation of Cellulose Degradable-Bacteria from Giant Panda′s Intestines and Its enzymatic Characterization
ZHAO Shan1, LV Wen-ting1, LIU Jie1, SONG Liang-li1,ZHANG Hai-feng1, SUN Xiao-qin1, YAN Qi-gui1,2
(1.Coll.ofVet.Med., 2.KeyLab.ofAnimalDis. &HumanHealthofSichuanProv.,SichuanAgric.Uni.,Ya’an625014)
Using sodium carboxymethylcellulose as unique carbon source and Congo red staining method, cellulose degradable bacterial strains were isolated from giant panda′s fecal samples, and studied on their enzymatic characteristics. Strain A1 with high enzyme activity was isolated, it was identified asBacilluscereusmorphologically and through BD PhoenixTM-100 full-automatic bacteria identification instrument. Growth condition and enzymatic activity tests showed that the optimal growth temperature of the strain was 37 ℃. 0.5%NaCl and pH at 7.0 the maximum activity of endo-glucanase was at 0.139 IU/mL, exo-glucanase 0.074 IU/mL, beta-glucosidase 0.126 IU/mL and the total ernzymatic activity was 0.108 5 IU/mL respectively. This research enriched the species of cellulose degrading-bacteria in giant panda′s intestines and strain A1 provided strain source for the following up study on how the giant panda digest and utilize bamboo fiber.
giant panda; cellulose degradable bacteria;Bacilluscereus
国家级创新创业训练计划项目(201310626009);四川省检验检疫局课题(SK201305)
赵珊 女,本科。研究方向为微生物及免疫。E-mail:zhaoshan419@163.com
* 通讯作者。男,教授,博士生导师。研究方向为动物传染病病原分子生物学。E-mail:yanqigui@126.com
2014-04-02;
2014-04-25
Q93;Q781
A
1005-7021(2015)01-0073-06
10.3969/j.issn.1005-7021.2015.01.014