钩栗ISSR-PCR反应体系的建立与优化
2015-12-26田艳伶李志辉杨模华
田艳伶,李志辉,杨模华,张 斌
(中南林业科技大学 林学院,湖南 长沙 410004)
钩栗ISSR-PCR反应体系的建立与优化
田艳伶,李志辉,杨模华,张 斌
(中南林业科技大学 林学院,湖南 长沙 410004)
本研究以钩栗叶片为实验材料,采用单因素和L16(45)正交实验探讨了DNA模板用量、Mg2+浓度、引物用量、Taq DNA 聚合酶、dNTP用量以及不同退火温度对钩栗ISSR-PCR扩增的影响,建立了钩栗ISSR-PCR反应体系。研究结果显示,优化后的最佳反应体系为,20 µL反应总体系中,含30 ng模板DNA,3 mmol/L Mg2+,0.4 mmol/L dNTPs,0.75 U Taq DNA聚合酶,0.3 µmol/L引物;对钩栗DNA样品材料进行ISSR-PCR扩增体系的检测结果显示,该优化体系扩增的产物条带清晰,稳定性高,本研究为钩栗种质ISSR分子标记遗传结构分析提供技术基础。
钩栗;ISSR-PCR;正交设计;单因素试验;优化
钩栗Castanopsis tibetana Hance又名钩锥,钩栲,别名槠栗、大叶钩栗、大叶锥栗(浙江)、大叶槠、巴栗、假板栗、野板栗(广西)、猴栗、钩栲,为常绿阔叶高大乔木,高达30 m,胸径可达1.5 m,树皮灰褐色,粗糙;其木材的心边材分明,心材红褐色,边材色较淡,年轮分明,材质坚重,耐水湿,适作坑木,梁,柱,建筑及家具材,属红锥类,是长江以南常见的主要用材树种,也是具有重要开发前景的珍贵用材树种,常生于海拔1 500 m以下山地杂木林中较湿润地方或平地路旁或寺庙周围,有时成小片纯林,主要分布在浙江、安徽二省南部、湖北西南部、江西、福建、湖南、广东、广西、贵州、云南东南部等10省区,分布广泛[1-3]。目前,关于钩栗方面的研究还比较少见,仅限于钩栗种群生态及生命表分析[4-6]、种子特性[7]与播种育苗[8-9]等方面。对钩栗种群生态研究的结果表明,现存的钩栗常散生于常绿阔叶林中,其天然更新长期停留在幼苗阶段, 钩栗在常绿阔叶林中有种群衰弱趋势[4,6,9],一个物种的生态适应性大小与其遗传度多样性水平的丰富度密切相关,因此,研究不同钩栗种群遗传结构及其遗传多样性,揭示钩栗种群的遗传结构特征,可为钩栗珍贵用材林的营建、应用和推广提供必要的理论依据。
简单重复序列区间扩增多态(inter-simple sequence repeat,ISSR)分子标记简称ISSR,基于SSR 的特点,用于检测2个SSR之间一段DNA 序列上的多态性[10-12]。与其他分子标记相比,ISSR具有操作方便、模板用量少、稳定性高、成本低廉、结果重复性高等优点,常被用于林木种质资源遗传结构与遗传多样性分析。建立一个稳定的ISSRPCR体系是进行ISSR分子标记遗传结构分析的基本前提,本研究针对钩栗种质资源ISSR遗传结构分析的要求,对影响 ISSR-PCR反应体系的各因素进行试验,旨建立适合钩栗ISSR-PCR扩增的最佳反应体系和扩增程序,为利用ISSR 分子标记技术研究钩栗种质遗传多样性奠定技术基础。
1 材料和方法
1.1 供试材料与试剂
对收集到的分别来自湖南、湖北、福建等3省区的钩栗种质资源,于2013年在湖南省汨罗市玉池国有林场建立钩栗种质资源收集圃。对要用于种质资源遗传结构分析的样本,野外采取集幼嫩叶片,装于编号的锡箔纸中,再将锡箔纸包好放于硅胶中干燥封存,运回实验室后放于-70℃冰箱保存,提取DNA备用。
钩栗DNA提取采用植物DNA提取试剂盒(TINGEN)提取,琼脂糖凝胶电泳法(4~5 V/cm,3~35 min)检测DNA提取质量和浓度(Bio-Rad紫外凝胶成像仪),PCR扩增在GeneAmp PCR System 9700扩增仪上进行;所用试剂分别为Taq DNA聚合酶、Mg2+、dNTPs (购自TINGEN),标准分子量Marker ,DS2000,琼脂糖等(由东盛公司提供),液氮购自长沙化工厂,其他分析试剂购自长沙隆和化玻有限公司,ISSR引物参照加拿大哥伦比亚大学UBC的ISSR引物序列,由上海英骏生物技术有限公司合成。
1.2 方 法
1.2.1 基因组DNA提取与检测
对试剂盒法提取的钩栗DNA,采用琼脂糖凝胶电泳法检测DNA质量,取DNA溶液4 μL点样于含少量溴化乙锭的0.7%琼脂糖凝胶中,电泳30~35 min(4~5 V/cm),Bio-Rad紫外凝胶成像仪成像,比照电泳条带及标准Marker,检测DNA提取质量和浓度。
1.2.2 ISSR-PCR反应体系优化及设计
参照锥栗ISSR遗传分析的结果[13-14],先以预扩增较好的引物UBC808作为钩栗基因组DNA扩增体系建立的初选引物。以本实验室基本ISSR体系为基础:30 ng的模板DNA,1.2 µL的Mg2+,0.5 µL 引 物,0.6 µL 的 dNTPs,0.3 µL 的 Taq DNA聚合酶,10×Buffer缓冲液2.0 µL;分别对影响ISSR-PCR反应体系稳定性的5个因素(Taq酶、DNA模板、引物、Mg2+、dNTPs)进行先进行单因素试验,各个因素浓度水平设计见表1;以单因素实验结果为基础,确定了一个可用于钩栗ISSR分析的初选体系;然后再在该初选体系上,对以上5个因素采用正交设计L16(45)方法,进行5 因素 4 水平试验(表2),取扩增后的产物 5 μL在1.4% 的琼脂糖凝胶上进行电泳,PCR重复2次,根据2次实验的扩增结果进行直观分析,最终确定最佳ISSR反应体系。
L16(45)正交设计扩增结果的直观分析,参照何正文等[15]的评分的方法,对2次独立正交试验的扩增条带,各自依据谱带的多少、强弱和杂带的多少对 PCR 扩增结果进行评分,条带数量丰富、清晰、稳定的最佳产物记 16 分,最差的计1 分。2次重复分别独立统计,最后得出相应的平均分数以供实验分析。
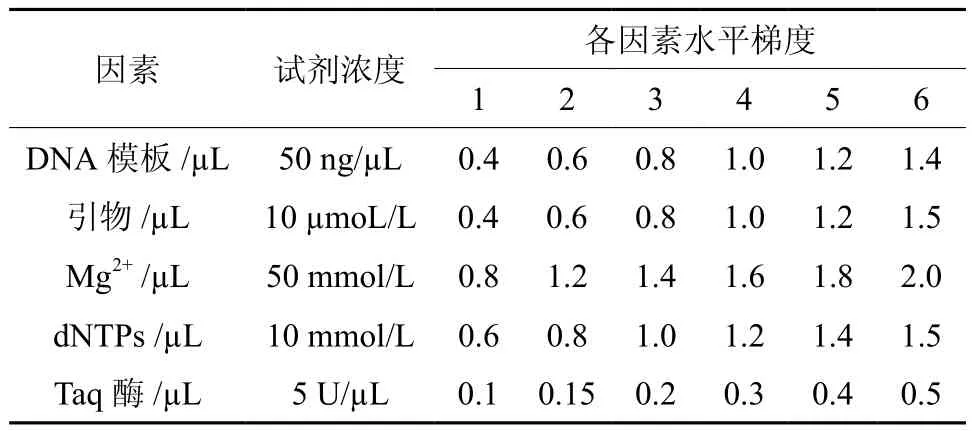
表1 影响ISSR-PCR扩增的因素水平Table 1 Factors and levels influencing amplification of ISSR-PCR
1.2.3 钩栗ISSR-PCR多态性引物的筛选
采用UBC808优化的ISSR-PCR体系,对来自3个不同省区钩栗的3个DNA模板,分别对100条ISSR引物进行筛选,选择扩增条带清晰,多态性丰富,稳定性高的引物,作为可用于遗传结构分析的多态性引物。
1.2.4 ISSR-PCR多态性引物最适扩增程序的确定
基于UBC808引物所建立的最佳PCR反应体系的基础上,对选择出来的12个多态性ISSR引物,利用梯度PCR仪对每条多态引物的理论 Tm值(Tm-5 ℃)~(Tm+ 5 ℃)附近设置退火温度[16],进行最佳退火温度和循环次数的扩增程序优化实验,选出条带数量多且清晰的退火温度作为该特定引物PCR扩增的最佳退火温度。
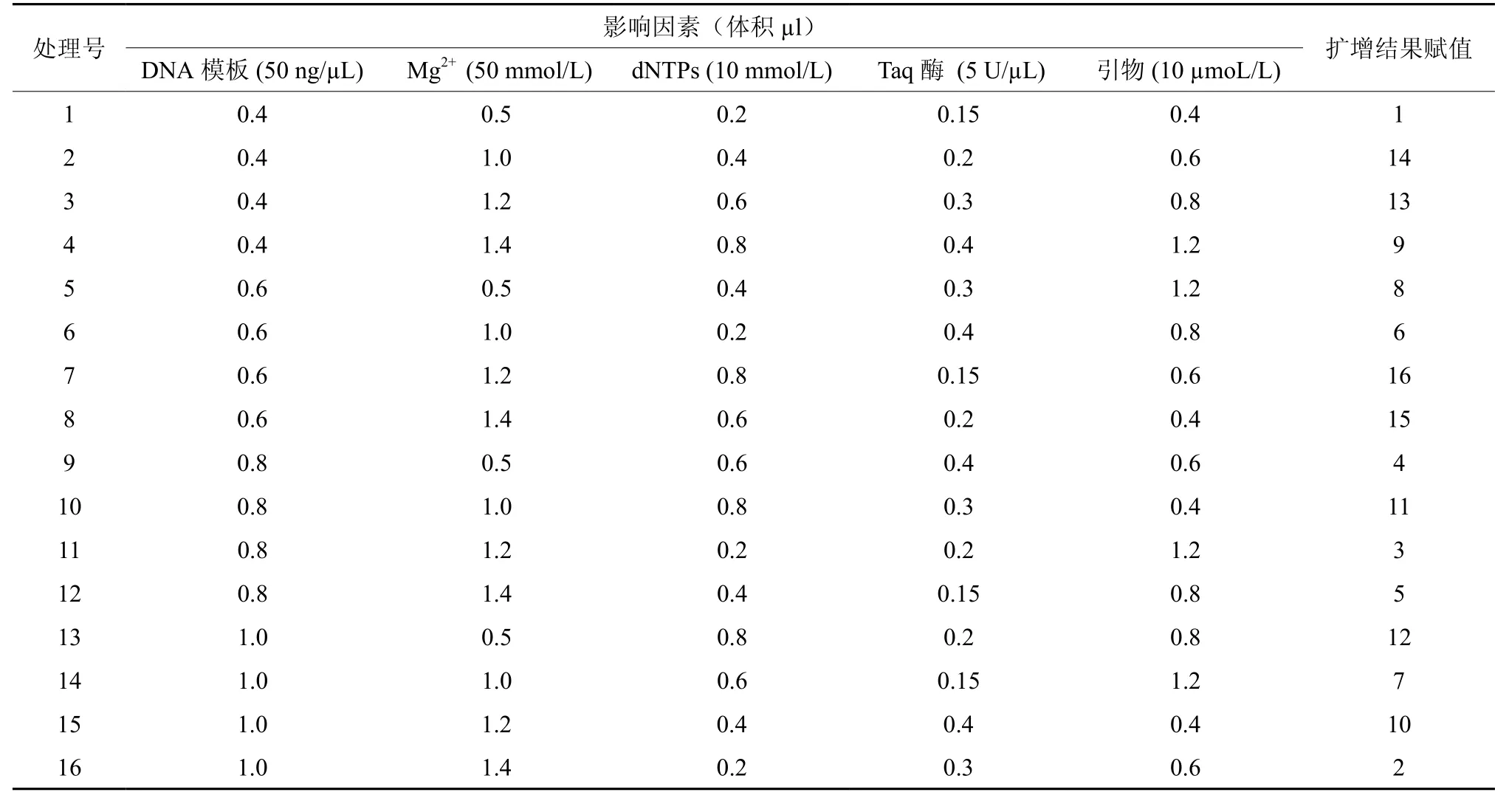
表2 正交钩栗ISSR反应正交试验设计L16(45)Table 2 ISSR reaction orthogonal design L16(45) for Castanopsis tibetana
2 结果与分析
2.1 DNA提取质量检测
不同钩栗样品采用试剂盒法提取的钩栗DNA电泳检测结果见图1,电泳检测结果显示,基因组DNA电泳呈一条整齐的带型,无拖带、弥散现象,这说明本方法提取的钩栗 DNA 质量较高,蛋白质、多糖和酚类等杂质基本去除,所提取的DNA 质量均能够满足进行ISSR分子标记分析的质量要求,待对每个样品检测其原始DNA浓度后,稀释至50 ng/μL备用。

图1 钩栗叶片基因组DNA电泳质量检测Fig.1 Electrophoresis quality testing of genomic DNA of C. tibetana leaves
2.2 ISSR-PCR反应体系单因素试验结果分析
2.2.1 DNA模板不同用量对钩栗ISSR-PCR的影响
在基本反应体系中,设定钩栗DNA模板不同的用量(0.2~1.2 μL)进行PCR扩增,结果如图2。图2的结果表明,反应体系中适量的模板浓度,对ISSR-PCR的体系建立非常关键,其中以0.6 μL左右的模板用量为钩栗 ISSR-PCR 反应体系的最佳DNA用量;当模板DNA 用量为0.2 μL 时,无条带;在0.4~1.2 μL时,扩增出的条带呈现出由模糊到清晰再模糊的表现,以0.6 μL时的清晰度最高;超过1.2 μL 时,非特异性条带数目增多,且清晰度减弱。因此,选择0.6μL左右的模板用量为钩栗ISSR-PCR 反应体系的最佳用量,即反应体系中30 ng的模板DNA用量比较适宜。

图2 不同水平模板DNA用量对ISSR扩增的影响Fig.2 Effects of different DNA template levels on ISSR amplif i cation
2.2.2 Mg2+浓度对ISSR-PCR的影响
Mg2+浓度影响引物与模板双链的解链。退火温度、Taq DNA聚合酶的活性和产物的特异性也都受Mg2+浓度的影响[17-18]。在基本反应体系中,设定了Mg2+不同的用量(0.6~2.0 μL)进行PCR扩增,结果如图3。图3的结果表明,最佳的Mg2+用量为1.2 μL。当Mg2+用量0.6~0.8 μL时条带量少且条带背景模糊;随着Mg2+用量升高(1.0~1.4 μL)条带清晰,主次带分明,特异性好;当Mg2+用量超过2.0 μL 时,PCR扩增的特异性降低,明显影响了PCR扩增产量,甚至不能扩增出条带。因用量为1.2 μL时最清晰稳定,故用作为钩栗ISSR-PCR反应体系中Mg2+最适用量,结合Mg2+的原初储备液浓度,得到每个反应体系中Mg2+最适的摩尔浓度为3 mmol/L。
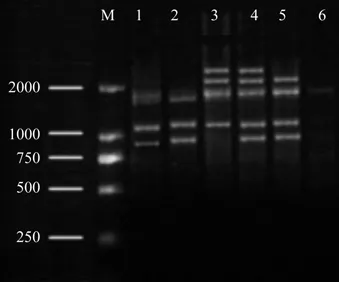
图3 不同水平Mg2+对ISSR扩增的影响Fig.3 Effects of different Mg2+ levels on ISSR amplif i cation
2.2.3 不同引物浓度对钩栗ISSR-PCR体系建立的影响
从图4可以看出,在基本反应体系中设定的引物不同用量(0.2~1.5 μL)进行PCR扩增的结果表明,引物用量为0.6 μL时条带反应稳定且清晰。当引物用量为0.2 μL时,无条带产生;随着引物用量的升高(0.4~1.5 μL),条带清晰度由弱到强;当引物用量为1. μL时条带背景开始弥漫且条带模糊。因此,选用引物用量0.6 μL作为钩栗 ISSR-PCR 反应体系的最佳用量,合算每个反应体系中引物的摩尔浓度为0.3 µmol/L。
2.2.4 dNTPs浓度对ISSR-PCR的影响
dNTPs 浓度太高容易产生错误掺入,浓度太低又会降低产率[19]。因此,合适的 dNTPs 浓度是建立ISSR-PCR 稳定体系的必要条件,本研究的研究结果表明,钩栗ISSR反应体系中,以0.8 μL的dNTPs用量为钩栗 ISSR-PCR 反应体系的最佳DNA用量;当dNTPs用量为0.4 μL 时,条带数量少;在0.6~1.2 μL时,扩增出的条带呈现出由模糊到清晰再模糊的表现,以0.8 μL时的清晰度最高;超过1.0 μL 时,条带明显减少且清晰度减弱。因此,选择0.8 μL的dNTPs用量为钩栗 ISSR-PCR 反应体系的最佳用量,合算其摩尔浓度为0.4 mmol/L。
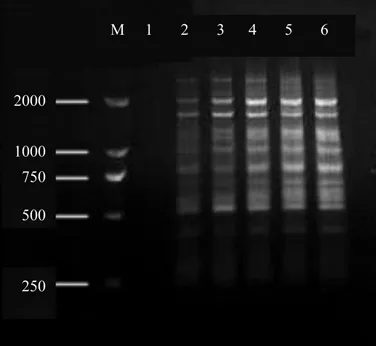
图4 不同水平引物对ISSR扩增的影响Fig.4 Effects of different primer levels on ISSR amplif i cation
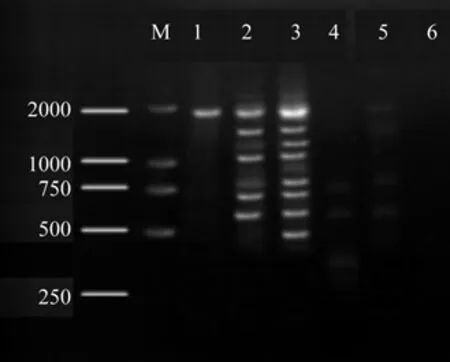
图5 不同水平dNTPs对ISSR扩增的影响Fig.5 Effects of different dNTPs levels on ISSR amplif i cation
2.2.5 Taq DNA聚合酶用量对ISSR-PCR的影响
在ISSR-PCR反应中,Taq DNA聚合酶的活性与浓度对扩增反应有着重要的影响,浓度过低会导致扩增产物不足或者不能扩增,浓度过高会产生弥散现象,非特异性扩增产物增多[20-21]。1~5 泳道代表不同Taq 酶用量(0. 5~2.5 U)的扩增产物(图6)。 图6的结果显示,当加入0.75 U的 Taq 酶时,扩增条带最清晰且主次带分明。Taq DNA聚合酶加入量为0. 5 U时,条带弥散背景模糊且条带少;随着Taq DNA聚合酶加入量的增加,扩增出的条带呈现出由清晰再模糊的表现。因此,选用0. 75U的Taq DNA聚合酶用量作为钩栗 ISSR-PCR 反应体系的最佳用量。

图6 不同水平Taq酶对ISSR扩增的影响Fig.6 Effects of different Taq DNA polymerase levels on ISSR amplif i cation
2.3 钩栗ISSR-PCR正交设计试验结果分析
从正交试验设计ISSR-PCR扩增结果(图7)可以直观看出[22],处理7和处理8扩增效果最好,不仅条带的多态性好、谱带清晰,而且扩增效果稳定。根据评分赋值可计算出每个因素同一水平下的试验值之和Ki以及每一因素各水平下的数据平均值ki,并求出同一因素不同水平间平均值的极差R(表3)。某影响因子极差R的高低反映了该影响因素水平的变化对反应体系的影响程度,R越大,影响越显著。由表3可知各因素对钩栗 PCR反应的影响从大到小依次为:dNTPs>模板 DNA>Mg2+>Taq 酶>引物。每一因素各水平下的数据平均值ki反映了该影响因素水平下反应体系的状况,ki值越大,该因素水平表现越好。由表3可知钩栗 ISSR-PCR 反应中 5 个影响因素的最佳反应水平组合可以推断为(20 ng模板DNA,3 mmoL/L Mg2+,0.4 mmol/L dNTPs,1 U Taq DNA聚合酶,0.2 µmoL/L引物),该最佳组合,与分值最高的7号处理接近。综合考虑单因素对比实验结果,选择处理7为最佳反应体系,即:优化后的最佳反应体系为20 µL反应总体系中,含30 ng模板DNA,3 mmoL/L Mg2+,0.4 mmol/L dNTPs,0.75 U Taq DNA聚合酶,0.3 µmoL/L引物。

图7 正交试验PCR产物电泳结果Fig. 7 Electrophoresis of orthogonal design PCR products

表3 正交试验数据分析Table 3 Data analysis of orthogonal tests
2.4 ISSR-PCR扩增多态性引物稳定扩增程序的筛选
从UBC100条ISSR引物里共筛选出了12条条带清晰多态性好且可用于遗传结构分析的多态性引物,根据不同的引物确定了最佳的ISSR-PCR退火温度,如表4。

表4 引物及其退火温度Table 4 Primers and annealing temperature
2.5 不同钩栗样品ISSR-PCR反应体系稳定性及适用性的验证
随机选取 821引物对优化后的体系及扩增程序进行稳定性验证。 验证结果如图8和图9所示。所选引物对其中20份钩栗材料进行扩增,扩出的条带多且清晰,无特异性条带,说明该体系稳定,适合钩栗基因组 DNA 的 ISSR-PCR 扩增。

图8 821号引物在优化后的体系下扩增20个样品的PCR结果Fig.8 PCR results of 20 specimens with peimer-821 and after optimized reaction system
3 讨 论
单因素实验只考虑了各因素不同水平对试验结果的影响,忽略了因素之间的交互作用,而正交设计试验,其结果的评价带有一定的主观性,降低了最佳反应水平的的可靠程度。本实验采用单因素和正交设计相结合的方法,在一定程度上避免了各自的局限性,获得了钩栗ISSR-PCR的最佳反应体系,用于不同样品的遗传多样性检测。
本试验得出dNTP浓度和模板DNA浓度是影响 PCR 扩增的主要因素,其次是Mg2+浓度和Taq DNA聚合酶用量;而在已研究的单因素试验中却发现Mg2+对 PCR 扩增均有显著影响,而引物浓度对扩增影响不显著。本实验中发现,dNTP浓度是影响本体系建立的最为重要的影响因子,这可能与dNTP购买时较高的初始储存浓度有关(达到了10 mmol/L),即使实验过程中dNTP用量的小幅度变化也能造成显著地影响。
本研究中所建立的 ISSR 稳定反应体系可为钩栗 ISSR 种质遗传分析及遗传多样性鉴定奠定重要的技术基础和技术依据。
[1] 张宏达,任善湘.中国植物志(第22卷)[M].北京:中国科学院中国植物志编辑委员会,1998.
[2] 洪 伟,林成来,吴承祯,等,福建建溪流域常绿阔叶防护林物种多样性的研究[J].生物多样性,1999, 7(3): 208-2131.
[3] 郑万钧.中国树木志[M]. 北京: 中国林业出版社, 1985.2216-2217.
[4] 宋晓英.福建三明钩栲种群与主要伴生树种生态位研究[J].亚热带植物科学,2002,(3):27-30.
[5] 林 敏,黄宗安. 钩栗种群生命表分析[J]. 福建林业科技,2003, (2):9-13
[6] 张嘉生.钩栲群落优势植物种群竞争的研究[J]. 福建林业科技,2005,(4):82-85.
[7] 王佩兰,许德禄,张 斌,等. 钩栗种子形态特征及主要生理指标测定分析[J]. 种子,2013,(8):7-10.
[8] 陈 养.钩栗人工育苗技术研究[J]. 林业科技开发,2007,(3):89-90.
[9] 李纯教. 皖南山区钩栲特征特性及播种育苗技术[J]. 现代农业科技,2012,(13):185-187.
[10] Zietkiew icz E, Rafalski A, Labuda D. Genome fingerprinting by simple sequence repeat(SSR) anchored polymerase chain reaction amplif i cation [J]. Genomics,1994,(20):176-183.
[11] 李娟玲,刘国民,宫庆龙,等. 鹧鸪茶种质资源ISSR分子标记中的引物筛选(摘要)(英文)[J]. Agricultural Science &Technology, 2009,(6):40-43.
[12] Bornet B, Antoine E, Bardouil M, et al. ISSR as new markers for genetic Characterization and evaluation of relationships among phytoplankon. Jouranl of APPlied Phycology, 2004,(16):285-290.
[13] 龚榜初,刘国彬. 锥栗自然居群遗传多样性的ISSR分析[J].植物遗传资源学报,2013,(4):581-587.
[14] 刘国彬.锥栗自然居群及农家品种遗传多样性的ISSR分析[D].武汉:华中农业大学,2009.
[15] 何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404.
[16] 李传代.女贞ISSR分子标记的引物筛选[J]. 热带生物学报,2010,(2):183-186.
[17] Sankar A A,Moore G A. Evalution of inter-simple sequence repeat analysis for mapping in Citrus and extension of the genetic linkage map [J]. Theor Appl Genet,2001,102:206-214.
[18] 杨玉洁,张冬林,杨模华,等.湖南桂阳马尾松种子园遗传多样性的ISSR分析[J].中南林业科技大学学报,2010,30(3):85-89.
[19] Shuguang Jian, Genetic Diversity Among South China Heritiera littoralis Detected by Inter-simple Sequence Repeats (ISSR)Analysis [J]. Journal of Genetics and Molecular Biology,2000,13(4):272-276
[20] Akkaya M S, Bhagwat A A, Cregan P B.Length polymorphism of simple sequence repeat DNA in soybean [J] .Genetics, 1992, 132:1131-1139.
[21] Prevost A, Wilkinson M J. A new system of comparing PCR primers applied to ISSR finger printing of potato cultivars[J].Theor Appl Genet, 1998, 98:107-112.
[22] 吴浩扬,常炳国,朱长纯. 遗传算法的一种特例——正交试验设计法[J]. 软件学报,2001,(1):148-153.
Establishment and optimization of Castanopsis tibetana Hance ISSR-PCR reaction system
TIAN Yan-ling, LI Zhi-hui, YANG Mo-hua, ZHANG Bin
(School of Forestry, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
By taking the Castanopsis tibetana Hance leaves as the tested materials, and adopting single factor orthogonal test, the effects of template DNA, Mg2+concentration, primers amount, Taq DNA polymerase, dNTPs dosage and different annealing temperature on ISSR-PCR amplif i cation of C. tibetana were investigated, and further the C. tibetana ISSR-PCR reaction system was set up. The results show that the optimized reaction system was consisted as follows: in the total reaction system with amount of 20 µL, there were 30 ng template DNA, 3 mmol/L Mg2+, 0.4 mmol/L dNTPs, 0.75 U Taq DNA polymerase, 0.3 µmol/L primers, respectively. The obtained DNA ISSR-PCR amplif i cation system of C. tibetana the DNA sample materials were detected, and the fi ndings suggested that the products’bands were clear with high stability, thus laying a foundation for ISSR markers genetic diversity researches of C. tibetana germplasm.
Castanopsis tibetana Hance; ISSR-PCR; orthogonal design; single factor tests; optimization
S792.17
A
1673-923X(2015)02-0032-06
10.14067/j.cnki.1673-923x.2015.02.007
http: //qks.csuft.edu.cn
2014-04-21
国家林业行业公益性项目“珍贵树种钩栗良种选育及栽培关键技术研究”(201204405)
田艳伶,硕士研究生 通讯作者:李志辉,教授,博士生导师,博士;E-mail:lzh1957@126.com
骆文华,代文娟,刘 建,等. 广西火桐自然种群和迁地保护种群的遗传多样性比较[J].中南林业科技大学学报, 2015,35(2):32-37.
[本文编校:吴 彬]
