超声波提取黑木耳多糖及其体外抗凝血活性*
2015-12-25吴小燕蔡为荣周迎
吴小燕,蔡为荣,周迎
(安徽工程大学生物与化学工程学院,安徽 芜湖,241000)
随着人民生活水平的提高和饮食结构的改变,血液高凝及其引发的血栓性疾病已日益危害人们健康[1]。抗凝血药物如肝素多糖已在血栓性疾病治疗中发挥相当重要的作用,但易引起自发性出血及诱导血小板减少等副作用[2]因此,从天然产物中寻找抗凝血活性成分,或将其主结构作为先导化合物进而研发新药,开发功能性食品,具有毒性小、研发费用低、周期短和全民保健的优势[3]。
黑木耳(Auricularia auricular),是一种含有较高的营养价值和药用价值的胶质真菌,是世界公认的保健品[4]。多糖为黑木耳的重要活性成分[5]。研究表明,黑木耳多糖具有抗肿瘤、抗氧化、抗癌症、抗凝血[6-9]等生物活性。近年来,黑木耳多糖抗凝血活性功能越来越引起人们的关注。然而,目前超声波提取黑木耳多糖,及体外抗凝血活性研究报道不多。
超声波提取真菌多糖,是利用超声波产生的强烈振荡、空化效应、热效应和机械搅拌等,提高真菌多糖浸出率,缩短提取时间,同时避免了高温对真菌多糖活性的影响[10]。真菌多糖的提取一般采用水提醇沉法,利用超声波提取已证明可获得比常规方法更佳的提取效率[11-12]。因此本文以黑木耳为研究对象,优化超声波提取黑木耳多糖的工艺,分离纯化多糖组分,对多糖组分其抗凝血活性进行了初步研究。
1 材料与方法
1.1 材料与设备
黑木耳,购于芜湖万达广场苏果超市;葡萄糖,中国医药集团上海化学试剂公司;双氧水,南京图邦科技有限公司;DEAE Sepharose CL-6B,Pharmacia公司;透析袋(截留MW14 000 Da),北京瑞达恒辉科技发展有限公司;APTT试剂盒,上海太阳生物科技有限公司;体积分数95%乙醇、乙醚、浓 H2SO4、苯酚、NaNO3等均为国产分析纯。
JK-300DB型数控超声波清洗器,合肥金尼机械制造有限公司;LXJ-Ⅱ型离心机,上海医用分析仪器厂;RE-52旋转蒸发器,上海青浦沪西仪器厂;L3S可见分光光度计,上海仪电分析仪器有限公司;DHL-A电脑数显恒流泵、BS-100A自动分布收集器,上海沪西分析仪器厂有限公司;真空冷冻干燥机,美国SIM公司;UV-5800PC紫外可见分光光度计计,上海元析仪器有限公司;Sysmex CA-1500凝血仪,日本Symex公司等。
1.2 实验方法
1.2.1 黑木耳粗多糖得率计算
黑木耳多糖含量的测定。本实验采用苯酚-硫酸法[13]测定多糖含量。标准曲线回归方程为 Y=0.007 02+0.016 14X,线性相关系数R2=0.999 21。

1.2.2 黑木耳粗多糖的提取流程
黑木耳,用清水浸泡洗净、烘干、粉碎过60目筛,取一定量黑木耳粉末在不同超声波提取条件下放置于超声波清洗器提取,离心得上清液,减压浓缩,加入4倍体积95%乙醇溶液,4 000 r/min离心收集沉淀。无水乙醚(除去脂溶性物质)淋洗2次、沉淀复溶、减压浓缩、冷冻干燥得黑木耳粗多糖。

图1 黑木耳粗多糖提取流程图Fig.1 Schematic diagram of extraction of process of Auricularia auricular crude polysaccharides
1.2.3 单因素实验
称取2 g黑木耳粉末,对超声频率、料液比、超声时间及超声温度4个因素探索,分别讨论对黑木耳粗多糖得率的影响。
根据L9(34)正交试验设计[14],综合单因素影响试验结果,选取超声频率、料液比、超声时间及超声温度对多糖得率影响较为显著的4个因素,以黑木耳粗多糖得率为指标。
1.2.4 黑木耳粗多糖纯化
黑木耳粗多糖经过 Sevag法去蛋白[15],H2O2法脱色[16],脱蛋白前后多糖进行紫外全波长扫描。
称取100 mg黑木耳多糖溶于20 mL蒸馏水,10 000 r/min,10 min离心除去不溶物,溶液上离子交换层析柱(1.6 cm×60 cm),分别用蒸馏水和 0.1、0.2、0.5 mol/L NaCl溶液进行梯度洗脱,流速为2 mL/min,分布收集器收集,用苯酚-硫酸法跟踪检测多糖含量,分别收集各单一峰组成,透析,冷冻干燥。
采用高效凝胶渗透色谱法(HPGPC)进行纯度鉴定[17],测定分离纯化后的黑木耳多糖样品。柱子UltrahydrogelTMLinear(7.8 mm id×300 nm),示差折光检测器。流动相为0.1 mol/L NaNO3溶液,流速为0.8 mL/min,柱温为35℃。标准品葡聚糖用流动相溶解,0.45 μm无机微孔膜过滤,以其分子质量的对数值(lg Mol Wt)为纵坐标、保留时间tr(min)为横坐标作图,回归线性分析。黑木耳多糖样品溶于流动相,0.45 μm微孔膜过滤,进样分析。
1.2.5 黑木耳多糖抗凝血活性
新鲜静脉血与3.8%的柠檬酸钠按体积比9∶1混合均匀,以2 500 r/min离心15 min,收集上清液贫血小板血浆,在4 h内使用。
待测血浆与多糖按4∶1体积比混合均匀,取样品50 μL,加入 APTT 试剂50 μL,37 ℃预热3 min,加入预热的CaCl2溶液50 μL,测定凝血时间,重复6次,统计分析。生理盐水和肝素钠分别作为阴性和阳性对照[18-19]。
2 结果与分析
2.1 单因素对黑木耳粗多糖得率的影响
在自然pH值下,料液比1∶(g∶mL)30,超声时间20 min,超声温度40℃下,超声功率对多糖得率的影响。在自然pH值下,料液比1∶30,时间20 min,在不同温度下热水浸提对多糖得率的影响。由图2可见,热水浸提,随着温度升高,提取得率逐渐增加,超过60℃多糖得率增加缓慢。超声波提取多糖得率明显高于热水浸提。

图2 超声频率对黑木耳粗多糖得率的影响Fig.2 Effect of ultrasonic frequency on AAP yield
超声波提取,多糖得率随着超声频率逐渐增加,黑木耳粗多糖提取率明显提高。当频率超过70 kHz后,粗多糖得率随着超声频率的增大而降低,可能是过高频率的超声波处理导致粗多糖被破坏,降低了得率。这与大多数超声波提取多糖结果大致相同[20-21]。因此,超声波频率选取70 kHz。超声波提取多糖得率明显高于热水浸提。
图3显示,在超声频率70 kHz,超声时间20 min,超声温度40℃下,料液比对多糖得率的影响,可见料液比越高,提取效果越好,当料液比在11∶30后多糖得率增加趋势减缓,选取料液比为1∶30。
图4显示下,超声频率70 kHz,料液比为1∶30,超声温度40℃,超声时间对多糖得率的影响。从中可见,超声时间在5~25 min,多糖得率随着时间的延长而增加,超过25 min后得率开始下降。多糖得率下降的原因可能是超声时间的延长,破坏了多糖分子结构。这与大多数超声提取多糖研究[22-23]结果相似。
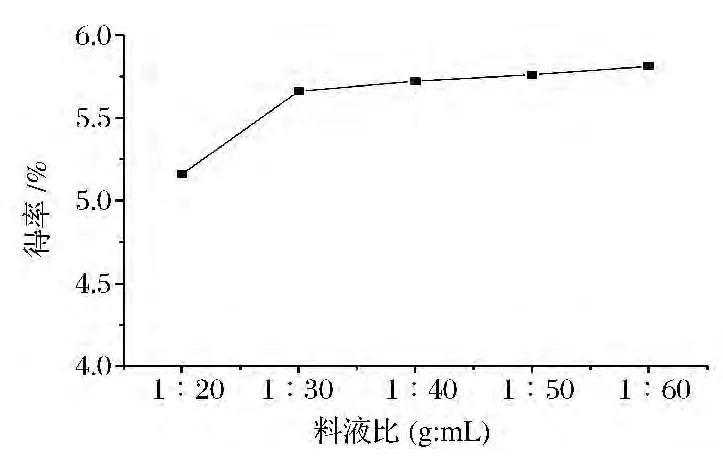
图3 料液比对黑木耳粗多糖得率的影响Fig.3 Effect of ratio of material to water on CAAP yield
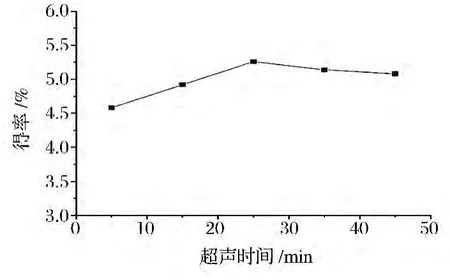
图4 超声时间对黑木耳粗多糖得率的影响Fig.4 Effect of ultrasonic time on CAAP yield
图5显示,在超声频率70 KHz,料液比1∶30,超声时间25 min,超声温度对多糖得率的影响,从中可见,随着温度的提高粗多糖得率增加显著,温度超过60℃时,多糖得率稍下降,可能高温条件下部分多糖水解的结构,这与大多数多糖提取结果相似,选取提取温度60℃。

图5 超声温度对黑木耳粗多糖得率的影响Fig.5 Effect of ultrasonic temperature on CAAP yield
2.2 黑木耳粗多糖提取的正交实验结果
由极差分析(表1)可知,各因素影响黑木耳多糖得率的主次顺序为A(超声频率,kHZ)>D(超声温度,℃)>B(料液比,g∶mL)>C(超声时间,min)。由直观分析可知,条件最优组合为A2B2C1D3。黑木耳多糖提取工艺的最佳提取条件是超声频率为70 kHz、料液比为1∶30(g∶mL)、超声时间为 15 min、超声温度为70℃。在此条件下进行验证性试验,黑木耳粗多糖得率为6.15%。

表1 黑木耳粗多糖提取正交试验结果Table 1 Results of Auricularia auricular crude polysaccharides in orthogonal experiment
2.3 黑木耳粗多糖纯化
黑木耳粗多糖经过Sevag法脱蛋白,黑木耳粗多糖脱蛋白前后紫外全波长扫描(图6),在260、280 nm处无明显吸收峰,表明了黑木耳粗多糖脱蛋白后几乎无核酸和蛋白质。H2O2脱色前为黑褐色,脱色后为淡黄色。
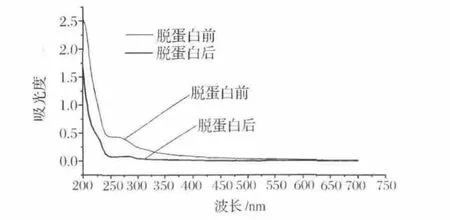
图6 黑木耳多糖的紫外可见光谱图Fig.6 UV-vis spectra of the Auricularia auricular polysaccharides
黑木耳粗多糖经过DEAE Sepharose CL-6B纯化得到4个组分 AAP-1、AAP-2、AAP-3、AAP-4经过透析(截留MW14 000 Da)、冷冻干燥,得棉花状白色固体。经称量计算 AAP-1、AAP-2、AAP-3、AAP-4得率分别为5.21%、39.36%、22.47%和2.35%,总的多糖回收率为72.39%。图7中,不同NaCl浓度洗脱可以得出:AAP-1为中性多糖,AAP-2和AAP-3、AAP-4为酸性多糖。
2.4 黑木耳多糖纯度鉴定

图7 黑木耳多糖DEAE Sepharose CL-6B的洗脱曲线Fig.7 Elution profiles of Auricularia auricular polysaccharides on DEAE Sepharose CL-6B column
HPGPC是按分子筛原理进行分离,不仅可以检测多糖的纯度,同时可以测定多糖分子质量及其分布。葡聚糖标准品,以标准葡聚糖分子量的对数lg Mol Wt为纵坐标,以保留时间tr为横坐标进行回归得Lg Mol Wt=-0.43tr+12.36,线性相关系数为R2=0.993 3,呈良好线性关系。
黑木耳多糖4个组分中,AAP-1和AAP-4含量较少,只对AAP-2和AAP-4进行纯度分析,其HPGPC图谱见图8。AAP-2多糖为单一峰,其重均分子质量大小为43.11×104。AAP-3多糖中主要含量有2个组分,其重均分子质量大小分别为15.55×104和14.20×104。表明AAP-3需进一步用凝胶过滤色谱对其分离。所得黑木耳多糖的分子质量与报道[24-25]的相差不大。
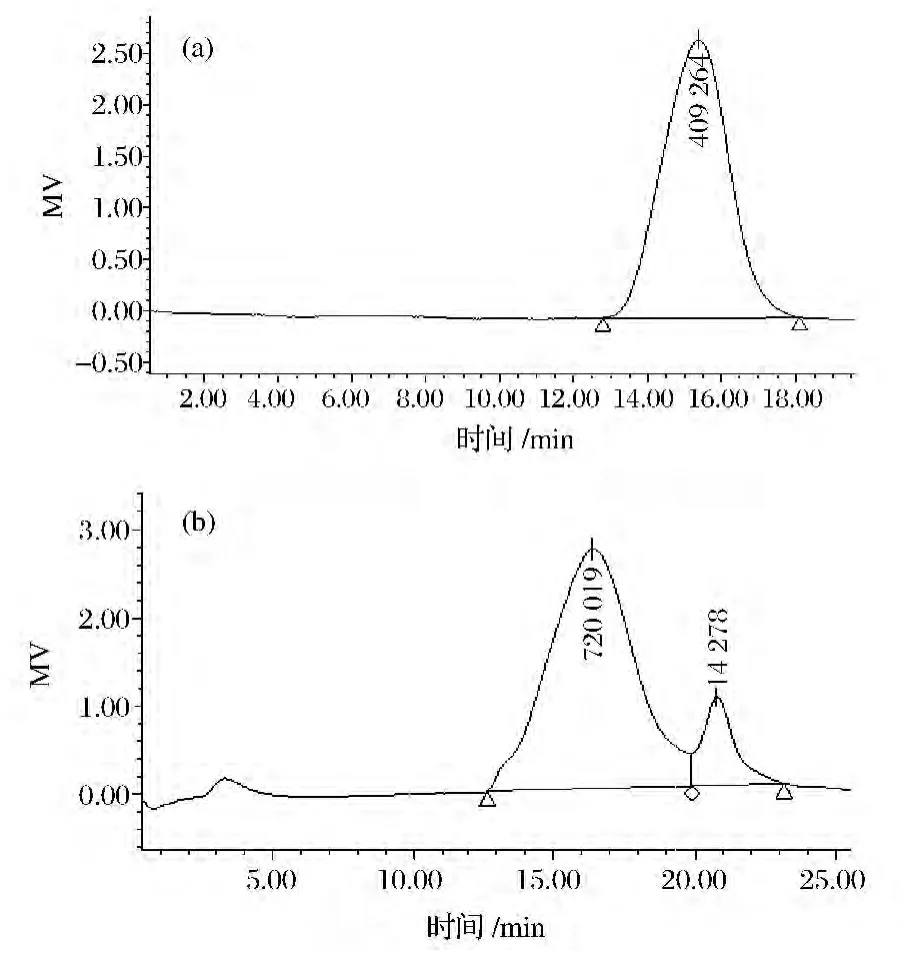
图8 AAP-2(a)和AAP-3(b)分子质量分布Fig.8 Mw distribution of AAP-2(a)and AAP-3(b)determined by HPGPC
2.5 黑木耳多糖体外抗凝血
活化部分凝血活酶时间(APTT)反应内源性各因子对凝血时间的影响,当APTT比正常值超过7s就视为延长。采用spss stastistics 17.0软件进行统计学分析,APTT检测结果表示平均值±标准差,重复6次,显著性差异采用t-配对分析。从黑木耳多糖体外抗凝血结果(表2)可知黑木耳多糖AAP-2、AAP-3有显著抗凝血活性,分别延长了30.82%和9.80。

表2 黑木耳多糖对体外活化部分凝血活酶时间的影响Table 2 Effect of Auricularia auricular polysaccharides on activated partial thromboplastin time in vitro
3 结论
本实验采用超声波提其黑木耳粗多糖,通过单因素、正交试验,黑木耳粗多糖提取的最佳条件:超声频率为70 kHz、料液比为 1∶30(g∶mL)、超声时间为 15 min、超声温度为70℃。在此条件下进行验证性试验,黑木耳粗多糖得率为6.15%。
提取的粗多糖用DEAE SepharoseCL-6B阴离子交换柱分级纯化,蒸馏水与NaCl溶液梯度洗脱,透析脱盐,冻干,得到 AAP-1、AAP-2、AAP-3和 AAP-4四个组分多糖。其得率分别为 5.21%、39.36%、22.47% 和2.35%,总的多糖回收率为72.39%。体外凝血活酶时间(APTT)实验,初步显示黑木耳多糖AAP-2与 AAP-3具有抗凝血活性,分别延长了30.82%、9.8%。
[1] 王有国.血黏导致脑梗阻[J].中国心血管病研究杂志,2001(2):19-20.
[2] Thomas D P.Does low molecular weight heparin casuse less bleeding[J].Thrombosis and Haemostasis,1997,78:1 422-1 425.
[3] 周永国,杨越冬,王树元,等.天然活性多糖在生物医药领域中的研究进展[J].高分子通报,2006(9):16-22.
[4] 李公斌.黑木耳多糖分子修饰及功能与应用研究[D].哈尔滨:东北林业大学,2006.
[5] 吴宪瑞.黑木耳的质量标准及营养成份[J].中国林副特产,1996,36(1):21-22.
[6] ZHANG Hua,WANG Zhen-yu,ZHANG Zhi,et al.Purified Auricularia auricular-judae polysaccharide(AAPI-α)prevents oxidative stress in an ageing mouse model[J].Carbohydrate Polymers,2011,84(1):638-648.
[7] SONG Guang-lei,DU Qi-zhen.Isolation of a polysaccharide with anticancer activity from Auricularia polytricha using high-speed countercurrent chromatography with an aqueous two-phase system[J].Journal of Chromatography A,2010,1217(38):5 930-5 934.
[8] SeenJoo Yoon,MyeongAe Yu,YuRyang Pyun,et al.The nontoxic mushroom Auricularia auricula contains a polysaccharide with anticoagulant activity mediated by antithrombin[J].Thrombosis Research,2003,112(3):151-158.
[9] Akira Misaki,Mariko Kaktuta,Takuma Sasaki,et al.Studies on interrelation of structure and antitumor effects of polysaccharides:antitumor action of periodatemodified,branched(1 →3)-β-D-glucan of Auricularia Auricula-judae,and polysaccharides confaining(1 →3)glycosidic linkages[J].Carbohydrate Research,1981,92(1):115-129.
[10] 唐娟,马永强.超声波技术在黑木耳多糖提取中的应用[J].食品与机械,2005,21(1):28-29.
[11] 杨景峰,罗志刚,罗发兴.物理波在真菌多糖提取中的应用[J].粮油食品科技,2007,15(5):55-58.
[12] 阿燕.真菌胞内多糖提取方法的研究进展[J].微生物学杂志,2011,31(5):82-86.
[13] 张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994.
[14] 潘丽军,陈锦权.实验设计与数据处理[M].南京:东南大学出版社,2008.
[15] Ataub A M.Removal of proteins Sevag method[J].Methods in carbohydrate chemistry,1965,5(2):5-6.
[16] 付学鹏,杨晓杰.植物多糖脱色技术的研究[J].食品研究与开发,2007,28(11):166-169.
[17] 钦传光,黄开勋,徐辉碧.凝胶过滤色谱法测定泥鳅多糖的组成及分子量[J].分析化学,2002,30(4):411-413.
[18] 于水,伦语,伦立民.血栓与止血检验研究进展[J].国际检验医学杂志,2012,33(22):2 743-2 745.
[19] 王碧松,王志斌,高阳,等.血凝仪-APTT法测定肝素的效价[J].药物分析杂志,2012,32(7):1 154-1 157.
[20] 田呈瑞,徐建国,胡青平,等.响应面法优化槐花水溶性多糖的超声波辅助提取工艺[J].食品科学,2011,32(4):112-116.
[21] 孙军凤,周泉城.超声波辅助提取桔梗多糖研究[J].食品科学,2007,28(7):111-116.
[22] 徐秀卉,杨波.超声波法提取黑木耳多糖的工艺[J].药学与临床研究,2011,19(2):189-190.
[23] 王雪,王振宇.响应面法优化超声波辅助提取黑木耳多糖的工艺研究[J].中国林副特产,2009(3):1-5.
[24] 韩春然,唐娟,马永强.黑木耳多糖的酶法提取、纯化及性质研究[J].食品科学,2007,28(2):53-56.
[25] 张俐娜,陈和生.黑木耳酸性杂多糖溶液性质研究[J].高等学校化学学报,1993,14(9):1 320-1 326.
