低场核磁共振结合常规理化分析海藻糖对冻藏罗非鱼片品质的影响*
2015-12-25张珂关志强李敏洪鹏志吴阳阳
张珂,关志强,李敏,洪鹏志,吴阳阳
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东湛江,524088)
罗非鱼(tilapia)又名非洲鲫鱼、福寿鱼、吴郭鱼等,是世界上仅次于鲤科和鲑科的第三大养殖品种,是高蛋白、低脂肪的经济鱼类之一[1]。我国是罗非鱼出口大国,其中冷冻罗非鱼片占出口罗非鱼的75%以上[2],然而在冷藏运输过程中,鱼肉蛋白质会发生干耗、蛋白质变性、解冻后色泽不佳,汁液流失严重,组织纤维化现象加剧等[3]。我国罗非鱼出口要经过多重的检测、检验、鉴定和认证环节,然而我国大部分企业和质检部门都缺乏先进的检测设备和技术[4],合适的浸渍预处理可以改善其冻藏品质,低场核磁技术的应用可为解决检测问题提供新思路。
海藻糖一般是由2个葡萄糖分子以α,α-1,1糖苷键构成的非还原性二糖,其热量为蔗糖的1/4,甜度为蔗糖的45%,以低甜度、低热量的抗冻剂代替传统的商业抗冻剂(4%蔗糖和4%山梨醇按质量比1∶1混合)成为了发展趋势。近年来,许多学者证明了海藻糖具有较好的抗冻效果,可有效抑制冷冻鱼糜[5]及其他鱼蛋白[7]的冷冻变性。低场核磁共振(low field nuclear magnetic resonance,LF-NMR)是指磁场强度在0.5 T以下的核磁共振,检测对象一般针对的是样品的物理性质[10]。根据肌肉中的水的分布不同,可将横向弛豫时间T2分为3种类型[11]:T2b表征分子内紧密结合的水,又叫结合水;T21表征存在于肌原纤维内部的水,也称不易流动水;T22表征存在于肌原纤维外部的水,也称自由水。低场核磁共振技术以其无需预处理、快速、无损、样品需要量少、实时获得数据等特点,已在食品诸多[13]领域得到了研究和应用。而国内外采用LF-NMR技术分析不同浓度海藻糖对罗非鱼片冻藏品质的影响还未见报道,本文以罗非鱼为试验对象,采用新型检测技术——LF-NMR技术,并将其与常规理化指标进行相关性分析,直观快速的检测海藻糖浸渍处理后罗非鱼品质的变化。
1 材料与方法
1.1 材料
吉富罗非鱼,购于湛江市工农市场,重约为750 g,共计12条。将健康鲜活的原料宰杀、取肉、去皮,修剪为长(100±5)mm,宽(70±5)mm,厚(9±2)mm(质量约80 g)的鱼片待用。根据本实验室前人的研究[16]得知海藻糖的适宜添加浓度为1% ~8%,故预先配制0%(空白对照组,control check;CK)、2%、8%浓度的海藻糖溶液,4%蔗糖和4%山梨醇1∶1质量比混合配置商业抗冻剂,均置于4℃冰箱待用,而后对鱼片进行浸泡处理。
1.2 试剂与仪器
海藻糖,购于河南佳诺食品配料中心;蔗糖、山梨醇(>98%),Ca2+-ATPase测试盒和考马斯亮蓝,购于南京建成生物工程研究所;NaCl(≥96.0%),广东光华科技股份有限公司。
MicroMR核磁共振交联密度仪,上海纽迈电子科技有限公司;TMS-PRO质构仪,美国FTC;GTR22-1型高速冷冻离心机,北京时代北利离心机有限公司;125型均质机,上海依背机械设备有限公司;UV-8000A紫外分光光度计,上海元析仪器有限公司;HHS型恒温水浴锅,上海博迅实业有限公司;AUY220型分析天平,日本岛津仪器有限公司;BCD-225SDCW冰箱,青岛海尔股份有限公司。
1.3 实验方法
1.3.1 持水性(water-holding capacity;WHC)的测定
参考Lakshmanan等人[17]的方法,稍加改动进行测定。取2.00 g切碎的鱼肉置于垫有2层滤纸(事先称重)的离心管中,然后在转数为3 000 r/min,10℃条件下离心10 min,称取离心后的滤纸质量,鱼肉的持水性可按以下公式计算:
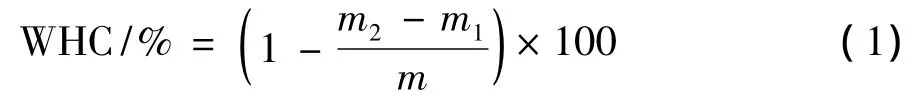
其中:m2是离心后滤纸质量,g;m1是离心前滤纸质量,g;m是鱼肉质量,(2.00±0.01)g。
1.3.2 Ca2+-ATPase活性的测定
按照南京建成生物工程所研发的ATP酶测试盒说明进行测量,Ca2+-ATPase活性以25℃每毫克蛋白质在每分钟内所产生的无机磷的微摩尔数表示,单位即μmolPi/(mg蛋白·h)。
1.3.3 弹性的测定
采用平底柱形探头p/5(直径5 mm),样品采用TPA模式进行测试[18]鱼片质构(弹性),具体实验条件为:测试速率60 mm/min,压缩程度50%,停留间隔时间5 s,环境温度控制在18~20℃。
1.3.4 水分弛豫时间和弛豫强度的测定
冻藏罗非鱼片在4℃冰箱解冻24 h后,取质量约为2.5 g,体积约为1 cm×1 cm×1 cm大小的肉块,放入直径约为17.0 mm的核磁管中进行测定。首先在参数设置中选择硬脉冲序列(Hard Pulse FID),寻找中心频率,然后进入CPMG(carr-purcellmeiboom-gill)序列,参数设置为:主频为22 MHz,射频信号频率偏移量O1=840 899.4 Hz,采样点数TD=1 024,采样频率SW=200 kHz,采样起始点D3=80 μs,重复采样的时间间隔TR=1 000 ms,重复采样次数NS=4,半回波时间 τ=100 μs,回波个数 EchoCnt=1 800。检测之后进行数据反演横向弛豫时间T2的分布情况。利用CPMG序列来检测样品的横向弛豫过程,其弛豫信号的数学表达式为:

其中:M(t)为横向磁化矢量衰减到t时间后的信号量;Pi表示样品中第i种成分的信号强度。总信号的大小事所有成分产生信号大小的总和,T2i表示样品中第i种成分的横向弛豫时间。
1.3.5 数据处理
试验数据均为3次平行结果的平均值,用Origin 8软件进行作图,利用JMP 7软件对数据进行单因素方差分析和Tukey HSD多重比较(P<0.05为差异显著),利用SPSS18.0进行相关性分析。
2 结果与讨论
2.1 不同浓度添加剂对冻藏罗非鱼片的持水性(WHC)的影响
由图1知,4组鱼片的持水性整体呈下降趋势。添加剂组鱼片在第3周时持水性略微下降,这或许是由于此时肌肉处于僵直期,pH值达到等电点,静电荷数达到最低,蛋白质发生聚集,降低了吸引水分子的能力,从而导致肌肉持水性降低[19];第4周时,鱼片持水性又有所增大,或许是由于糖分子中大量氢键与蛋白质和水分子结合所致[20]。而第4周后,4组鱼片持水性显著下降(P <0.05),Elisabeth[21]等人认为,或许是由于鱼肉在冻藏过程中冰晶不断挤压细胞结构,肌原纤维蛋白变性程度变大,结合水的能力下降。鱼片冻藏到第八周,2%海藻糖组和CK组显著降低(P<0.05),且两者无差异(P>0.05);而商业抗冻剂和8%海藻糖可显著增大持水性(P<0.05)。
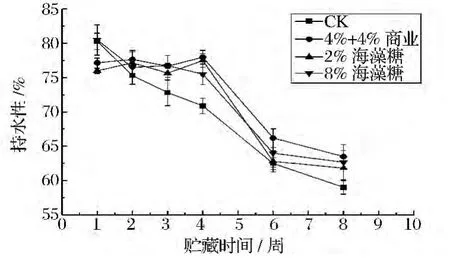
图1 添加剂对冻藏罗非鱼片WHC变化的影响Fig.1 Effects of cryoprotectants on WHC of tilapia fillets during frozen storage
2.2 不同浓度添加剂对冻藏罗非鱼片Ca2+-ATPase活性的影响
如图2所示,在冻藏的8周内,罗非鱼片肌原纤维蛋白的Ca2+-ATPase活性逐渐下降,CK组显著下降(P <0.05),由 3.01 μmol Pi/(mg蛋白·h)下降到0.62 μmol Pi/(mg蛋白·h);添加抗冻剂后,酶活性下降较为缓慢,其中商业抗冻剂和8%海藻糖组中鱼片的酶活性下降最小,仅降低了1.66和1.92,且无显著差异(P>0.05);2%海藻糖次之,此结果与Aimei Zhou等人得出结果相似。Benjakul等人[22]解释,肌肉中Ca2+-ATPase活性的下降是由于冷冻过程中冰晶的形成改变了离子强度或者肌动球蛋白表面疏水性集团被氧化,导致肌原纤维蛋白构象的改变,从而降低其Ca2+-ATPase活性。由此说明,8%海藻糖与商业抗冻剂具有类似的抗冻效果,都可以延缓肌原纤维蛋白在冻藏过程中结构的改变,从而抑制酶活性的降低。
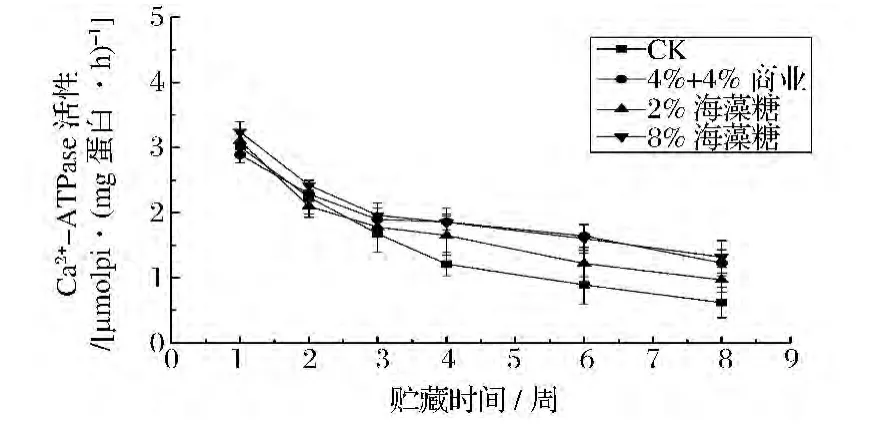
图2 添加剂对冻藏罗非鱼片Ca2+-ATPase活性变化的影响Fig.2 Effects of cryoprotectants on Ca2+-ATPase activity of tilapia fillets during frozen storage
2.3 不同浓度添加剂对冻藏罗非鱼片弹性(springiness)的影响
由图3与图1比较可以看出,罗非鱼弹性变化与其持水性变化类似,这是由于弹性与样品恢复形变的速度和程度有关,产品质地若是过软(即持水性较差),恢复形变的速度就会减慢,致使弹性的得分降低[23]。由以上分析可知,第3周时肌肉处于僵硬期,故肌肉的弹性下降;随后肌肉解僵,弹性有所恢复;而后肌肉进入腐败期,蛋白质变性较为严重,肌肉的弹性开始显著下降(P<0.05)。同样的,添加8%海藻糖和商业抗冻剂的罗非鱼片中,由于糖分子中氢键与水或蛋白质的结合,延缓了蛋白质的结构改变[24],弹性也比其余两组显著增大(P<0.05)。
由以上3个理化指标的分析得到,8%的海藻糖与商业抗冻剂有同等的抗冻效果,2%的海藻糖稍差,但都比CK组能够显著延缓蛋白质的变性程度,提高鱼肉中肌原纤维蛋白的持水性和弹性,又因其低糖低热量的优势,本试验中选择8%的海藻糖为较好的抗冻剂。
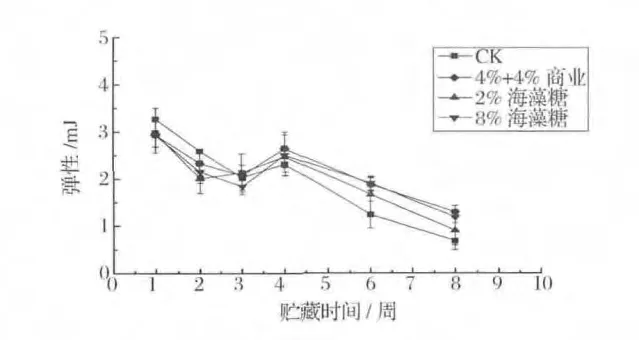
图3 添加剂对冻藏罗非鱼片弹性变化的影响Fig.3 Effects of cryoprotectants on springiness of tilapia fillets during frozen storage
2.4 以LF-NMR横向弛豫时间T2分析鱼肉中水分的变化
质子处于不同的化学环境就会导致横向弛豫时间T2的不同,T2值越小,质子的自由度越小,T2值越大,质子的自由度越大。T2值的变化能够反映水分子的流动性[25],以8%海藻糖组与CK组罗非鱼片为例,对T21和T22进行分析,观察冻藏期间鱼肉中水分的变化见下图4。
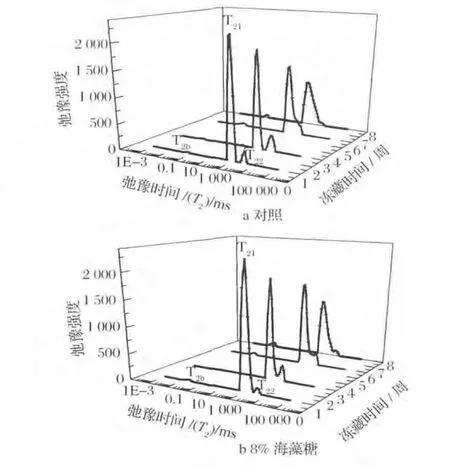
图4 添加剂对冻藏罗非鱼片横向弛豫时间T2的影响Fig.4 Effects of cryoprotectants on transversal relaxation time T2of tilapia fillets during frozen storage
根据图4中罗非鱼片横向弛豫时间分布情况可得知,罗非鱼肌肉中水分主要分为3种形式:与大分子紧密结合的水,即结合水T2b(0.1~1.0 ms);存在于肌原纤维内部的水,即不易流动水T21(10~100 ms);存在于肌原纤维网络外部的水,即自由水T22(100~800 ms)。图4的整体表现为:随着冻藏时间的延长,鱼片中不易流动水的横向弛豫时间T21和弛豫强度A21减小(P<0.05);自由水的横向弛豫时间T21减小(P<0.05),弛豫强度 A22增大(P<0.05)。仅由图4-b可知,8%海藻糖一组内的罗非鱼片在冻藏8周内不易流动水的横向弛豫时间T21从100.00 ms下降到75.65 ms(P<0.05),相对应的峰面积A21也显著下降(P<0.05),这与 Isabel Sánchez-Alonso[26]等人的结果相似,是由于随着冷藏时间的延长,蛋白质变性程度变大,不易流动水含量降低。T22由464.16 ms降低到305.38 ms(P<0.05),对应的峰面积A22却有所增加了(P<0.05),且与不易流动水连在一起,正如Bertram[27]等人所说的自由水的含量A22随着肌肉中水分损失增加而增大,即鱼片在冻藏过程中肌肉内部的水分逐渐向外部转移。此结论与本试验之前的测得的罗非鱼持水性减小,酶活性和弹性降低呈现相同趋势。
比较图4-a和图4-b中同一时期水分的弛豫时间和强度可知,8%海藻糖组的罗非鱼肌肉中不易流动水的横向弛豫时间 T21由86.97 ms增加到100.00 ms(P<0.05),弛豫强度A21下降较空白组缓慢;自由水的T22由351.11 ms增加到464.16 ms增大(P<0.05),弛豫强度A22增加也较为缓慢;结合水部分水分弛豫时间T2b和强度变化不大(P>0.05)。这与Carla da Silva Carneiro等人[28]在冻虾中加入三聚磷酸钠有相似的结果,主要是由于海藻糖的加入导致肌原纤维蛋白凝胶网络结构增大,从而提高肌肉的吸水能力和水分子的移动性,减小蛋白质变性程度。
2.5 理化指标与LF-NMR结果的比较
利用SPSS18.0软件,以8%海藻糖组为例,将其理化指标(持水性、Ca2+-ATPase活性和弹性)与横向弛豫时间T21和T22分别进行皮尔森相关性分析,可得出表1所示结果。
由表1可以看出,8%海藻糖处理后的罗非鱼片的不易流动水和自由水的横向弛豫时间T21和T22分布与Ca2+-ATPase活性有较好的相关性(P<0.05),相关系数都达到0.95以上;T21与持水性相关系数为0.952,相关度较高(P < 0.05),与 Isabel Sánchez-Alonsoa[30]提出T21与持水性直接相关的结论一致;T22与弹性也有高的相关度(P<0.05),可见鱼片的弹性与自由水含量变化趋势相一致。基于对核磁信号和常规理化指标的综合对比可知,8%海藻糖在提高鱼片持水力进而增加产量,延缓鱼肉蛋白抗冻,改善质构等方面有较好的效果,是一种性能优良的抗冻剂。
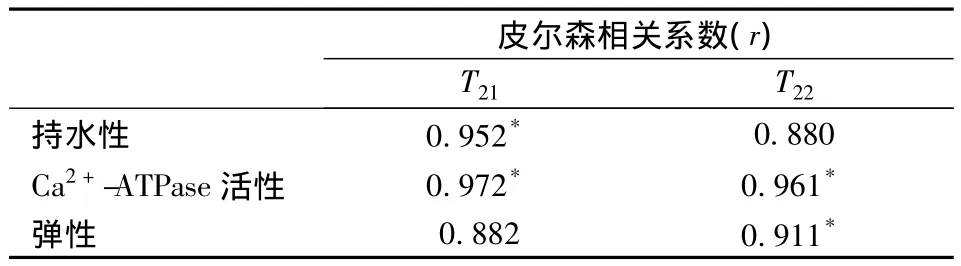
表1 8%海藻糖处理后的罗非鱼片的理化指标与LF-NMR结果的相关性Table 1 Correlations between the physicochemical parameters and the LF-NMR relaxation data of frozen tilapia fillets with 8%trehalose
3 结论
利用LF-NMR的横向弛豫时间分析海藻糖对不同冻藏期罗非鱼片品质的影响,结果表明,随着冻藏时间的延长,鱼片中不易流动水的横向弛豫时间(T21)和弛豫强度(A21)减小;自由水的横向弛豫时间变小(T22),弛豫强度(A22)变大,即肌肉内部的水分逐渐向外部转移。
添加8%海藻糖能提高鱼肉蛋白质的持水性,Ca2+-ATPase活性和弹性;此外,加入8%海藻糖会使罗非鱼片横向弛豫时间T21和T22增大,即增大肌原纤维蛋白凝胶网络结构,提高了肌肉的吸水能力和水分子的移动性,延缓了蛋白质的变性,本试验中认为8%的海藻糖为较优的抗冻剂,且该组核磁信号与相应的持水性,Ca2+-ATPase活性和弹性等理化指标变化趋势呈正相关(P<0.05)。因此,LF-NMR这种无损伤、快速的新型检测技术,可用于检测不同加工处理后的罗非鱼片水分变化,进而保证食品质量,提高经济效益。
[1] 唐小丹,周春霞,洪鹏志,等.罗非鱼肉蛋白的分离及其性质研究[J].食品科技,2011,36(6):156-166.
[2] 包特力根白乙.中国罗非鱼养殖产业发展及市场前景[J].安徽农业科学,2014,42(33):11 956-11 958.
[3] 蒋小强.冷冻对文蛤和波纹巴非蛤食品品质影响及改善的比较研究[D].湛江:广东海洋大学,2004.
[4] 付少徉.美国食品安全贸易壁垒对中国罗非鱼出口的影响及其对策[J].食品研究与开发,2014,35(18):151-155.
[5] ZHOU A M,Benjakul S,PAN K,et al.Cryoprotective effects of trehalose and sodium lactate on tilapia(Sarotherodon nilotica)surimi during frozen storage[J].Food Chemistry,2006,96(1):96-103.
[6] Laura C D,Clara A T,Javier B,et al.Gelation process in two different squid(Dosidicus gigas)surimis throughout frozen storage as affected by several cryoprotectants:Thermal,mechanical and dynamic rheological properties[J].Journal of Food Engineering,2011,107(1):107-116.
[7] 马妍,谢晶,周然,等.复合抗冻剂在暗纹东方鲀冻藏过程中的应用[J].食品与生物技术学报,2012,31(5):543-548.
[8] 张静雅,陆剑锋,林琳.鲢鱼冷冻鱼糜抗冻剂的复配研究[J].食品科学,2012,33(2):127-132.
[9] Ee-Tien Tee,Lee-Fong Siow.Physical and sensory properties of frozen spanish mackerel(Scomberomorus guttatus)fish balls added with cryoprotectants[J].Food and Bioprocess Technology,2014,7(12):3 442-3 454.
[10] Hills B P,Wright K M,Gillies D G.A low-field low-cost Halbach magnet array for open-access NMR[J].Journal of Magnetic Resonance,2005,175(2):336-339.
[11] Bertram H C,Andersen H J.NMR and the water-holding issue of pork[J].Journal of Animal Breeding and Genetics,2007,124(1):35-42.
[12] 阮榕生.核磁共振技术在食品和生物体系中的应用[M].北京:中国轻工业出版社,2009:1-36.
[13] 庞之列,殷燕,李春保.解冻猪肉品质和基于LF-NMR技术的检测方法[J].食品科学,2014,35(24):219-223.
[14] 胡博然,周妍,朱勇,等.利用核磁共振技术和电子舌技术分析2个产区干红葡萄酒代谢产物的差异[J].食品与发酵工业,2013,39(10):215-222.
[15] 刘贺,李君,庚平,等.转谷氨酰胺酶对Cheddar干酪力学性质的影响[J].食品与发酵工业,2014,40(6):70-75.
[16] 康彦.抗冻剂对罗非鱼冻藏品质影响的研究[D].湛江,广东海洋大学,2014.
[17] Lakshmanan R,Parkinson J A,Piggott J R.High-pressure processing and water-holding capacity of fresh and coldsmoked salmon(Salmo salar)[J].LWT-Food Science and Technology,2007,40(3),544-551.
[18] 王俏仪,董强,卢水仙,等.冷冻贮藏对罗非鱼肌肉质构特性的影响[J].广东海洋大学学报,2011,31(4):86-90.
[19] 姜晓文.肌肉水分分布、抗氧化性与生鲜猪肉持水性的关系[D].杭州:浙江工商大学,2009.
[20] 蒙健宗,秦小明,赵文报,等.海藻糖对冷冻罗非鱼片蛋白质变性作用的影响[J].食品工业科技,2007,28(2):214-217.
[21] Elisabeth H L,Steven M L.Mechanisms of water-holding capacity of meat:The role of postmortem biochemical and structural changes[J].Meat Science,2005,71(1):194-204.
[22] Benjakul S,Bauer F.Physicochemical and enzymatic changes of cod muscle proteins subjected to different freeze-thaw cycles[J].Journal of the Science of Food and Agriculture,2000,80(8),1 143-1 150.
[23] 殷俊,梅灿辉,陈斌,等.肉丸品质的质构与感观分析[J].现代食品科技,2011,27(1):50-55.
[24] 薛勇,薛长湖,李兆杰,等.海藻糖对冻藏过程中鳙肌原纤维蛋白冷冻变性的影响[J].中国水产科学,2006,13(4):637-641.
[25] 陈亚励,屈小娟,刘书成,等.高密度CO2处理虾仁营养组成和水分子状态的变化规律[J].农业工程学报,2014,30(13):268-275.
[26] Isabel Sánchez-Alonso,Pilar Morenob,Mercedes Carecheb.Low field nuclear magnetic resonance(LF-NMR)relaxometry in hake(Merluccius merluccius,L.)muscle after different freezing and storage conditions[J].Food Chemistry,2014,153(15):250-257.
[27] Bertram H C,Dønstrup S,Karlsson A H,et al.Continuous distribution analysis of T2relaxation in meat—an approach in the determination of water-holding capacity[J].Meat Science,2002,60(3):279-285.
[28] Carla da Silva Carneiro,Eliane Teixeira Mársico,Roberta de Oliveira Resende Ribeiro,et al.Studies of the effect of sodium tripolyphosphate on frozen shrimp by physicochemical analytical methods and Low Field Nuclear Magnetic Resonance(LF1H NMR)[J].LWT-Food Science and Technology,2013,50(2):401-407.
[29] Pearce K L,Rosenvold K,Andersen H J,et al.Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes:A review[J].Meat Science,2011,89(2):111-124.
[30] Isabel Sánchez-Alonsoa,Iciar Martinez,Javier Sánchez-Valencia,et al.Estimation of freezing storage time and quality changes in hake(Merluccius merluccius,L.)by low field NMR[J].Food Chemistry,2012,135(3):1 626-1 634.
