丝状真菌三孢布拉霉产番茄红素发酵条件优化*
2015-12-25罗玮周雅巩尊洋杜瑶顾秋亚余晓斌
罗玮,周雅,巩尊洋,杜瑶,顾秋亚,余晓斌
(江南大学生物工程学院糖化学与生物技术教育部重点实验室,江苏无锡,214122)
番茄红素是是一种脂溶性的不饱和碳氢化合物,性质非常活泼,具有极强的抗氧化和清除自由基能力,被广泛应用于食品、医药和化妆品领域[1-2]。在自然界中含有番茄红素量比较高的有番茄、番石榴、西瓜、红色的葡萄柚等红色水果,尤其番茄中的番茄红素占其类胡萝卜素总量的80%左右。除此以外,许多丝状真菌如布拉克须霉[3]、卷枝毛霉[4]和三孢布拉霉[5]中也含有大量的番茄红素,其含量远超过植物中番茄红素含量水平。且微生物的生长和代谢不受气候和土地等资源制约,可以大规模培养。目前已经在三孢布拉霉中实现了β-胡萝卜素的工业化生产,因此通过丝状真菌的规模化培养有望实现番茄红素的大规模生产。
三孢布拉霉是一种丝状真菌,属于霜霉目、藻状菌纲、白锈科,拉丁名是 Blakeslea trispora,是一种雌雄异体的接合菌。三孢布拉霉对营养要求简单、生长速度快且类胡萝卜素含量高,使其成为生产番茄红素的理想菌株[6-7]。三孢布拉霉有正负菌之分,负菌是番茄红素的主要生产者。番茄红素是三孢布拉霉合成β-胡萝卜素的一种中间代谢产物,要实现番茄红素在胞内累积,必须添加番茄红素环化酶抑制剂阻断番茄红素被进一步转化成β-胡萝卜素。
本研究以本实验室选育获得的一株番茄红素高产突变株为对象,通过优化发酵培养基和其他关键参数,以期进一步提高其番茄红素产量,为工业化生产番茄红素奠定良好基础。
1 材料与方法
1.1 仪器和试剂
仪器:恒温培养箱、可见光分光光度计、恒温摇床、pH仪、离心机、抽滤机、高压蒸汽灭菌锅、旋转真空干燥器等。
试剂:番茄红素标准品购于Sigma公司,磷酸二氢钾、七水硫酸镁、棉籽油、二甲基咪唑、石油醚、二氯甲烷均为分析纯。
1.2 菌种和培养基
三孢布拉霉菌(B.trispora)高产突变株ZY通过常压室温等离子诱变系统选育获得,由本实验室保藏。
各种培养基如下:
固体培养基:麦汁4°,琼脂粉20 g/L。
种子培养基:玉米粉25 g/L,黄豆粉50 g/L,KH2PO41.5 g/L,MgSO4·7H2O 0.5 g/L,pH 6.3,121 ℃灭菌20 min。
发酵培养基:玉米粉50 g/L,黄豆粉25 g/L,KH2PO41.5 g/L,MgSO4·7H2O 0.5 g/L,pH 6.3,棉籽油30 g/L,121℃灭菌20 min。
1.3 培养方法
种子培养:在无菌条件下,将三孢布拉霉正负孢子(正菌104个孢子/mL,负菌105个孢子/mL)分别接入种子培养基,在25℃,180 r/min的条件下,培养48 h。
发酵培养:将生长旺盛的正负菌种子液按1∶5的比例在无菌的条件下混合,再以20%的接种量接入发酵培养基,在25℃,180 rpm的条件下,培养120 h,在培养48 h时添加0.1 g/L 2-甲基咪唑。
1.4 分析方法
发酵120 h之后,收集菌丝体用蒸馏水洗涤后纱布过滤,40℃真空干燥过夜。干燥后在天平上准确称量。取适量干菌丝体加石英砂研磨破碎菌丝体,用石油醚抽提至菌体无色,合并抽提液,适当稀释后于502 nm下测定吸光值,根据标准曲线计算番茄红素含量。
1.5 正交试验设计方法
本研究设计了4因素3水平的正交试验,其因素及水平安排如表1所示。
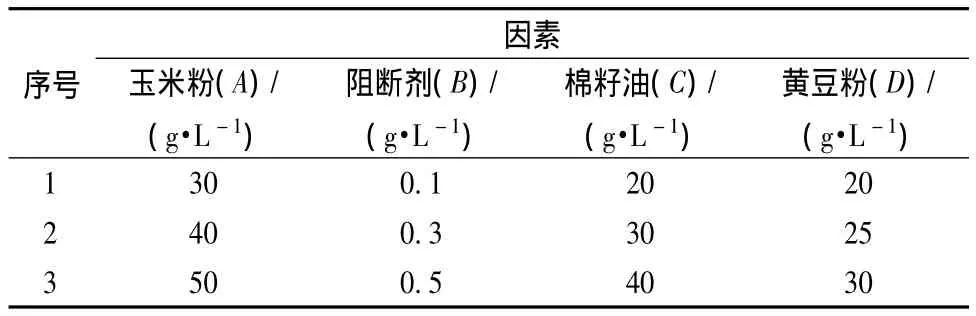
表1 各个因素梯度设计Table 1 The design of factors and level
2 结果与讨论
2.1 培养基中碳源的影响
碳源对微生物生长代谢以及产物合成至关重要,不同微生物对碳源的利用度和代谢能力也不尽相同。本实验选择了几种常见的单糖、二糖、寡糖以及多糖(葡萄糖、蔗糖、低聚麦芽糖、玉米粉、可溶性淀粉)作为代表,分别添加至发酵培养基中,保持培养基其他成份相同,对三孢布拉霉分别利用这5种碳源合成番茄红素的能力进行了比较。由该图2所示,多糖比单糖在促进菌体生长和番茄红素含量上效果要好。丝状真菌大多合成含量丰富的淀粉酶类,能够高效利用淀粉类碳源。同时,从图1中可以看出添加玉米粉的发酵效果要优于可溶性淀粉。这是因为三孢布拉霉是一种高度嗜黏微生物,因此培养基中添加玉米粉等固形物有利于菌丝体附着和生长以及番茄红素累积。Papaioannou等[8]也对三孢布拉霉的底物进行了研究,他们选择葡萄糖、乳糖和淀粉作为代表,发现三孢布拉霉能更有效利用淀粉和乳糖合成类胡萝卜素,尤其是采用淀粉作为碳源能够有效增加细胞干重和番茄红素生产强度,其作用机理可能在于淀粉是一种缓释性碳源,其在三孢布拉霉胞内多种淀粉酶作用下缓慢释放出单糖避免了分解代谢组阻遏效应。

图1 不同碳源对发酵的影响Fig.1 Effect of different carbon sources on lycopene fermentation
2.2 培养基中氮源影响
本实验同时考查了几种氮源(玉米浆、黄豆粉、酵母膏、NaNO3和(NH4)2SO4对三孢布拉霉合成番茄红素含量及生物量的影响。从图2可以看出,有机氮源对菌体生长和番茄红素合成效果要优于无机氮源,其中黄豆粉效果最好,其生物量及番茄红素的产量均比其他4种氮源更高。因此选择黄豆粉作为番茄红素发酵培养基的氮源。
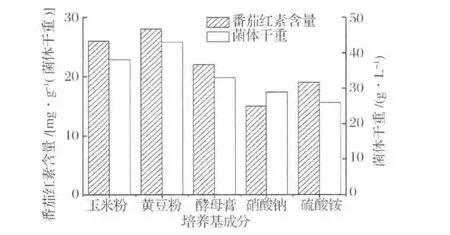
图2 不同氮源对发酵的影响Fig.2 Effect of different nitrogen sources on lycopene fermentation
2.3 不同油对番茄红素产量的影响
分别考察了花生油、棉籽油、葵花籽油、大豆油以及菜籽油对三孢布拉霉发酵的影响。从图3可以看出,油类均能有效促进生物量和番茄红素产量累积,其中棉籽油效果最好。Mantzouridou等[9]发现添加粗橄榄油和大豆油到葡萄糖为碳源的培养基中,能大幅提高三孢布拉霉类胡萝卜素含量。Vereschagina等[10]也研究发现添加亚油酸特别是亚麻酸含量丰富的油类能显著提高三孢布拉霉发酵产番茄红素水平,其作用机理可能是外源油脂添加使丝状真菌三酰甘油中多不饱和脂肪酸比例增加,从而增加了番茄红素在其脂质体中的溶解度而促进其大量累积。棉籽油和葵花籽油中的多不饱和脂肪酸含量要比其他油类更为丰富,在本实验中这2种油促进番茄红素合成效果最好,这与上述研究结果一致。
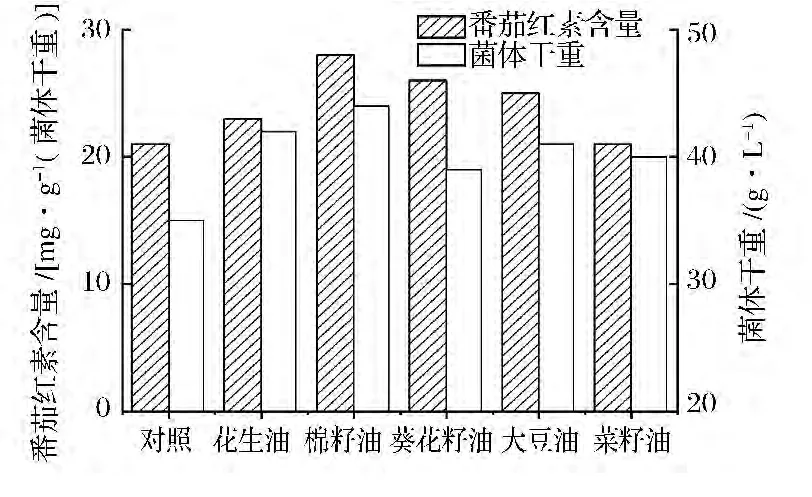
图3 不同油对发酵的影响Fig.3 Effect of different oils on lycopene fermentation
2.4 接种量和正负菌比例对番茄红素产量的影响
本实验对三孢布拉霉在发酵培养基中的接种量以其正负菌比例对发酵的影响作了分析,从图4a中可以看出当接种量为10%时,番茄红素的含量最高。因此在发酵时应该选择10%的接种量进行发酵。另外,从图4b中可以发现当正菌量少于负菌量,即两者比例小于1时更有利于番茄红素的合成,这是因为三孢布拉霉的负菌为番茄红素的主要生产者,正菌主要起刺激性激素三孢酸合成的作用,三孢酸则在三孢布拉霉合成类胡萝卜素过程中起重要作用[11]。同时,当正负菌比例为 1∶5时,番茄红素的含量最高。Varzakakou等[12]研究了三孢布拉霉正负菌比例对其累积β-胡萝卜素的影响,其设置正负菌的比例从100∶1到1∶100,发现正菌量高于负菌量时番茄红素含量降低,正负菌比例维持在1∶10时其β-胡萝卜素的含量最高。
2.5 利用正交试验优化番茄红素发酵条件
根据上述试验结果,外加碳源、氮源和油类分别以玉米粉、黄豆粉和棉籽油对番茄红素的累积效果最好,本研究进一步考察其最适浓度,同时阻断剂2-甲基咪唑浓度对番茄红素合成可能产生较大影响。本试验选取上述4因素进行正交试验,具体的实验设计见表1,每组实验设置两个平行,试验结果取其平均值。
2.5.1 极差分析
表2中的K1、K2、K3分别表示在各因素各水平下菌株ZY合成番茄红素含量的总和,k1、k2、k3分别表示在各因素各水平下番茄红素含量的平均值。用同一因素各水平下平均番茄红素含量的极差R(极差=平均含量的最大值-平均含量的最小值)来反映各因素的水平变动对含量影响的大小。极差大就表示该因素的水平变动对试验结果的影响大,极差小就表示该因素的水平变动对试验结果的影响小。

图4 接种量(a)和正负菌比例(b)对番茄红素发酵的影响Fig.4 Effects of inoculum size and ratio of(+)and(-)mating type of B.trispora on lycopene fermentation
由表2得到本次实验因素的主次顺序依次为:阻断剂、棉籽油、玉米粉、黄豆粉。同时可以得到各因素的最佳组合为 A3B3C2D2,即玉米粉50 g/L、阻断剂0.5 g/L、棉籽油30 g/L、黄豆粉25 g/L。按此搭配的试验在正交表的9次试验中并没有出现,需要做补充试验进行验证。

表2 正交实验结果Table 2 The result of orthogonal test
2.5.2 方差分析
正交试验的极差分析法简便、直观、计算量小,但不能估计试验误差,即不能区分试验结果的差异是由各因素的水平变化而导致,还是由试验的随机波动而导致。为了解决此问题,需要对试验结果做方差分析。对上述试验结果采用Excel软件做了方差分析,结果如表3所示。由表3可知各因素对试验结果的影响程度,阻断剂对结果影响最大,棉籽油次之,玉米粉再次之,而最后是黄豆粉,这个结果与极差分析的结果一致。

表3 方差分析表Table 3 Analysis of variance
2.5.3 验证试验
根据正交试验分析的结果,对最佳组合A3B3C2D2进行验证试验。将ZY接种于该发酵培养基中,为保证实验的精确性,每组实验进行3次。结果显示番茄红素含量达到29.9 mg/g菌体干重,高于正交试验中最高值(27.1 mg/g)。Liu等[13]对三孢布拉霉的培养条件进行优化之后,其番茄红素含量达到19 mg/g菌体干重。Wang等[5]在优化了培养基和培养条件后番茄红素的含量为11 mg/g菌体干重。Sun等[14]在培养基中添加2种竞争性途径抑制剂使三孢布拉霉番茄红素累积含量提高到4.3 mg/g。Shi等[15]在培养基中加入前体和代谢促进剂后番茄红素含量大幅提高至10 mg/g菌体干重,产量最高达到578 mg/L。上述研究均采用三孢布拉霉进行番茄红素发酵,但含量远低于本试验所获的结果。除此以外,采用基因工程菌进行番茄红素合成和发酵优化方面也取得了很大的发展。Alper等[16]在重组大肠杆菌中实现了番茄红素的高产(220 mg/L),在优化了搅拌速率和pH控制策略后,番茄红素的含量达到8.15 mg/g菌体干重,生物量达到27 g菌体干重/L。Yoon等[17]采用构建的大肠杆菌基因工程菌进行番茄红素发酵,在优化了代谢途径和发酵工艺后,获得了迄今番茄红素在大肠杆菌中最高含量(22 mg/g菌体干重),但由于其生物量较低,因此其产量仅为102 mg/L。

表4 验证试验结果Table 4 Results of verification test
3 结论
本研究对丝状真菌三孢布拉霉产番茄红素发酵培养基及其培养条件进行了优化,获得以下几个方面的结论。对三孢布拉霉产番茄红素发酵培养基的几个关键因素碳源、氮源、油以及接种量和正负菌比例进行了单因素试验。结果显示相对于单糖,三孢布拉霉更容易利用多糖合成番茄红素,且以不溶性的玉米粉为佳;氮源中有机氮源效果较好,黄豆粉为最佳氮源;培养基中添加油类能有效促进番茄红素累积,以棉籽油为最佳,这可能跟其不饱和度较高有关;同时,三孢布拉霉的接种量特别是接种比例对番茄红素影响较大,接种量10%为好,正负菌比例要以负菌为主,维持在1∶5时番茄红素产量达到最大。
同时对上述试验获得的几个重要因素进行了进一步优化,选择玉米粉、黄豆粉、油类、阻断剂进行了4因素3水平正交试验,并对结果进行了极差分析和方差分析,显示4因素的主次顺序为阻断剂、油、玉米粉、黄豆粉,且阻断剂对番茄红素合成影响显著。通过验证试验,确定了培养基最佳组合时番茄红素产量达到29.9 mg/g菌体干重。
[1] 包有霞,陈碧霄,闫震,等.沼泽红假单胞菌的培养和生产番茄红素的优化控制[J].食品与生物技术学报,2009,28(5):693-698.
[2] 李红,孙清瑞,张连富.温度对高顺式占比番茄红素稳定性影响研究[J].食品与生物技术学报,2014,33(7):715-720.
[3] Hsu W-J,Yokohama H,DeBenedict C.Chemical bioregulation of carotenogenesis in Phycomyces blakesleeanus[J].Phytochemistry,1990,29(8):2 447-2 451.
[4] Nicolas-Molina F E,Navarro E,Ruiz-Vazquez R M.Lycopene over-accumulation by disruption of the negative regulator gene crgA in Mucor circinelloides[J].Applied Microbiology and Biotechnology,2008,78(1):131-137.
[5] WANG J F,LIU X J,LIU R S,et al.Optimization of the mated fermentation process for the production of lycopene by Blakeslea trispora NRRL 2895(+)and NRRL 2896(-)[J].Bioprocess and Biosystems Engineering,2012,35(4):553-564.
[6] 徐志强,余晓斌.Mg2+对三孢布拉霉合成β-胡萝卜素的影响[J].无锡轻工大学学报,2003,22(3):104-406.
[7] 刘海丽,余晓斌.表面活性剂和抗氧化剂对三孢布拉霉合成β-胡萝卜素的影响[J].食品与生物技术学报,2007,26(2):97-101.
[8] Papaioannou E H,Liakopoulou-Kyriakides M.Substrate contribution on carotenoids production in Blakeslea trispora cultivations[J].Food and Bioproducts Processing,2010,88(2-3):305-311.
[9] Mantzouridou F,Tsimidou MZ,Roukas T.Performance of crude olive pomace oil and soybean oil during carotenoid production by Blakeslea trispora in submerged fermentation[J].Journal of Agricultural and Food Chemistry,2006,54(7):2 575-2 581.
[10] Vereschagina O A,Memorskaya A S,Tereshina V M.The role of exogenous lipids in lycopene synthesis in the mucoraceous fungus Blakeslea trispora[J].Microbiology,2010,79(5):593-601.
[11] 王见冬,袁其朋,钱忠明.β-胡萝卜素发酵过程中关键的代谢产物—三孢酸[J].微生物学通报,2004,31(3):147-150.
[12] Varzakakou M,Roukas T,Kotzekidou P.Effect of the ratio of(+)and(-)mating type of Blakeslea trispora on carotene production from cheese whey in submerged fermentation[J].World Journal of Microbiology and Biotechnology,2010,26(12):2 151-2 156.
[13] LIU X J,LIU R S,LI H M,et al.Lycopene production from synthetic medium by Blakeslea trispora NRRL 2895(+)and 2896(-)in a stirred-tank fermenter[J].Bioprocess and Biosystems Engineering,2012,35(5):739-749.
[14] SUN Y,YUAN Q-P,Vriesekoop F.Effect of two ergosterol biosynthesis inhibitors on lycopene production by Blakeslea trispora[J].Process Biochemistry,2007,42(10):1460-1464.
[15] SHI Y Q,XIN X L,YUAN Q P.Improved lycopene production by Blakeslea trispora with isopentenyl compounds and metabolic precursors [J].Biotechnology Letters,2012,34(5):849-852.
[16] Alper H,Miyaoku K,Stephanopoulos G.Characterization of lycopene-overproducing E.coli strains in high cell density fermentations[J].Applied Microbiology and Biotechnology,2006,72(5):968-974.
[17] Yoon S H,Lee Y M,Kim J E,et al.Enhanced lycopene production in Escherichia coli engineered to synthesize isopentenyl diphosphate and dimethylallyl diphosphate from mevalonate[J].Biotechnology and Bioengineering,2006,94(6):1 025-1 032.
