培养条件及接触材料对大米中蜡样芽孢杆菌生物被膜形成的影响*
2015-12-25马悦吴谦吴希阳李小龙唐书泽
马悦,吴谦,吴希阳,李小龙,唐书泽
(暨南大学食品科学与工程系,广东 广州,510632)
蜡样芽孢杆菌(Bacillus cereus)是一种常见的食品污染菌和食源性条件致病菌,在细菌性食物中毒中,由蜡样芽孢杆菌引起的食物中毒在发生起数和发病人数方面均居前三位[1]。蜡样芽孢杆菌通过产生催吐毒素及腹泻毒素引起食物中毒[2],我国发生的蜡样芽孢杆菌食物中毒主要是由致吐型肠毒素引起的。引发致吐型蜡样芽孢杆菌食物中毒的食品由70%是粮食加工制品[3],尤其是大米制品。我国是世界上大米的最大生产国和消费国,研究蜡样芽孢杆菌污染的控制技术对于我国大米消费地区的食品安全具有重要意义。
生物被膜是微生物在生长过程中为适应生存环境而形成的一种与浮游菌相对应的菌细胞群体,它附着于活力组织或无活力组织表面,由其产生的细胞外多聚基质包裹的菌体细胞构成[4],环境因素如温度、pH、碳源、无机盐、培养时间等对其影响很大[5]。细菌生物被膜一旦形成,很难从食品加工设备及其接触面上彻底清除。形成的生物被膜对抗生素的耐受性比浮游菌增强10~1 000倍,给食品安全带来严重的潜在隐患[6]。生物被膜还会带来如降低流径,阻碍传热等问题[7]。蜡样芽孢杆菌在食品加工、包装、储存等过程中容易黏附于不锈钢、有机玻璃、聚氯乙烯及玻璃等非生物表面并形成生物菌膜[8],增加了灭菌难度。
目前,国内外有关生物被膜的报道主要集中于单增李斯特菌、大肠杆菌以及金黄色葡萄球菌等,对能产生芽孢的菌类生物被膜研究较少,关于接触材料表面对生物被膜的影响鲜见报道[9]。本文通过平板计数法比较蜡样芽孢杆菌在接触过煮熟大米的不锈钢材料(Rice-SS)与洁净的不锈钢(Clean-SS)材料上形成生物被膜的总量,并为进一步研究生物被膜形成规律及其致病性奠定基础,为大米制品生物危害安全防控技术提供理论依据和技术支撑。
1 材料与方法
1.1 菌株及培养基
蜡样芽孢杆菌菌株,分离自大米。
胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB),青岛高科园海博生物技术有限公司。
1.2 主要仪器试剂
蜡样芽孢杆菌生化鉴定盒071800,广东环凯生物技术有限公司;盖玻片(玻璃材质,20 mm×20 mm,),广州健阳生物技术有限公司;不锈钢片(SS,304型,20 mm×20 mm),上海凤庭机械设备有限公司;有机玻璃(PMMA,20 mm×20 mm)、聚氯乙烯(PVC,20 mm×20 mm),上海艾纽斯敦塑料科技有限公司;酶标仪(PMT-49984),宝生物工程(大连)有限公司;涡旋振荡仪(QL-901),其林贝尔仪器制造公司;离心机(KDC-1042),科大创新股份有限公司。
1.3 方法
1.3.1 菌种分离鉴定及培养
用电子天平准确称取市售国产大米100 g,放入摇摆式高速粉碎机中,粉碎1 min左右,至粒径约1 mm;室温下(25~30℃),按照米水比14∶15的质量比,用玻璃棒搅拌约20~30 min调成糊状,以无菌操作称取10 g上述糊状米粉,转入90 mL无菌生理盐水中,取1 mL涂布于TSA平板上,37℃培养24~40 h。
菌种鉴定:进行生理生化鉴定(蜡样芽孢杆菌生化鉴定盒071800);后采用试剂盒法(青岛海博生物有限公司)提取芽孢杆菌的DNA,用细菌16S rDNA的通用引物,即上游引物27 F:5'-AGAGTTGATCCTGGCTCAG-3',下游引物 1492 R:5'-GGTTACCTTGTTACGACTT-3'进行 16S rDNA的扩增。PCR反应条件为:94℃,5 min;94℃,30 s;60℃,30 s;72℃,25 s,20 cycle,72℃,1 min。PCR反应体系见表1。

表1 PCR反应体系表Table 1 PCR reaction system
凝胶电泳条件为:电压90 V,温度60℃,电泳时间3 h,将胶条放置于质量浓度为0.5μg/mL的EB染色液中染色15 min,再于TAE脱色液中脱色10 min;之后委托上海生工公司进行基因测序。
培养:将蜡样芽孢杆菌接种于5 mL TSB中,37℃以100 r/min振荡培养16 h至生长稳定期[8];4 500 r/min离心10 min,弃去上清液,用1 mL pH 7.4的无菌磷酸盐缓冲溶液(PBS)洗涤 2次[10],7~10 mL PBS调整其OD600值为0.1左右(约108CFU/mL)。
1.3.2 载体处理
盖玻片、6孔板、96孔板在体积分数为75%的乙醇中浸泡24 h后在无菌条件下晾干,紫外杀菌30 min。
PMMA、PVC片在45 Hz条件下超声30 min后PMMA片在甲醇中浸泡30 min,PVC在甲醇溶液中浸泡3次,每次10 s。在无菌条件下晾干,紫外杀菌30 min。
SS的处理参照Peng[9]等的方法:将SS片浸泡在体积比为1∶1的甲醇丙酮混合溶液中超声1 h除去表面油脂,浸泡于反渗透(RO)水中,取出后在75℃条件下放置于0.2 g/mL的NaOH溶液中,5 min后取出再次于 RO水中浸泡,在75℃将其浸泡在1%的HNO3溶液中,之后最后1次于RO水中浸泡,121℃高压灭菌15 min。
Rice-SS的处理:将洁净的SS片包埋于米水质量比为1∶1.5时蒸出的米饭中,放置24 h后取出自然风干,121℃高压灭菌 15 min[9]。
1.3.3 培养温度和培养时间对B.cereus生物被膜形成的影响
在置有盖玻片的6孔平底板中加入200 μL按1.3.1制备的菌悬液,加入5 mL TSB培养基,分别在4,25,37 ℃培养 4,8,12,24,48,72 及 96 h。小心取出盖玻片,用无菌PBS溶液洗3次除去浮游菌;200 μL 10%甲醇固定10 min,200 μL 1%结晶紫染色5 min后用PBS洗至无紫色脱出,60℃干燥30 min,加1 mL 33%乙酸,浸没盖玻片,小心振荡使结晶紫溶解,用酶标仪于波长600 nm处测其光密度。同时做空白对照。每组设置6个平行,重复3次,取平均值。通过OD600值反映生物量的大小。
1.3.4 培养基成分对B.cereus生物被膜形成的影响
将按1.3.1制备的菌液与添加不同成分的新鲜的TSB培养基按照1∶100的体积比混合均匀,以每孔200 μL接入96孔板,各组分别以不添加葡萄糖、蔗糖、MgCl2、CaCl2、NaCl、pH 为 7.0 的 TSB 培养基为阴性对照,设阴性对照组测得的相对OD600值为1,方便其他各组与之比较。37℃培养48 h,之后同1.3.2操作。
碳源对B.cereus生物被膜的影响:分别配制含葡萄糖、蔗糖质量分数为 0.50%,1.0%,2.0%,3.0%,4.0%,6.0%,8.0%和 10.0%的 TSB,121 ℃高压灭菌15 min后进行上述操作。
无机盐对B.cereus生物被膜的影响:分别配制含 CaCl2、MgCl2质量分数为 0.010%,0.02%,0.05%,0.10%,0.25%和0.50%的TSB,121℃高压灭菌15 min后进行上述操作。
培养基初始pH对B.cereus生物被膜的影响:配制 pH 值分别为 2.0,5.0,6.0,7.0,7.5,8.0,9.0,12.0的TSB,121℃高压灭菌15 min后按1.3.3操作。
1.3.5 接触材料对B.cereus生物被膜形成的影响
将经处理的PVC、PMMA、SS片分别置于6孔板中加入 200 μL 1.3.1制备的菌悬液,后加入 5 mL TSB培养基,37℃培养48 h。取出长有生物被膜的薄片后参照Dourou等[5]的操作并略作修改:将长有生物被膜的片放入装有10 mL PBS及10颗玻璃珠的50 mL无菌离心管中,4 000 r/min涡旋振荡2 min(移除效果通过将涡旋处理后的各载体经革兰氏染色后镜检确定),取100 μL该菌液梯度稀释后进行平板计数。
洁净的SS与Rice-SS表面成膜总量比较:将经处理的洁净SS与Rice-SS片分别置于6孔板中,加入200 μL 1.3.1制备的菌悬液,后加入5 mL TSB培养基,分别于 37 ℃下培养 12,24,36,48,72 h。
1.3.6 数据处理
对实验数据进行标准偏差分析,采用Origin 8.0软件作图。
2 结果与讨论
2.1 菌种分离鉴定
对国产大米中的细菌进行培养后菌落计数发现,大米中菌落总数约为2.49×103CFU/g,其中有2~3种菌落形态,经镜检发现多数为G+的芽孢杆菌,少数为G-的肠杆菌。本实验分离出1株芽孢杆菌,暂命名为菌株B。经生理生化鉴定后可初步确定菌株B是蜡样芽孢杆菌。对菌株B的16S rDNA序列进行blast比对,与GenBank中4株蜡样芽孢杆菌的16S rDNA序列相似性均达到99%以上,可以确认菌株B为蜡样芽孢杆菌。
由上述结果可知检测的国产大米中微生物污染情况较严重,其中包括了食源性病原菌B.cereus,将对大米产品加工带来危害,进一步说明了本研究的必要性。
2.2 培养温度及时间对B.cereus生物被膜形成的影响
培养温度和时间与B.cereus生物被膜有着极为密切的关系。如图1所示,在不同温度条件下,B.cereus生物被膜生长的大致趋势一致:培养初期B.cereus所形成的生物被膜OD600值随着培养时间的延长而增加,约24 h达到峰值;继续培养至48 h生物被膜OD600值有所下降,48 h后趋于稳定。

图1 不同温度条件下B.cereus生物被膜培养光密度值随时间的变化Fig.1 Optical density value of B.cereus biofilms during 96 h incubation in different temperature
生物被膜形成大致可分为几步:(1)菌体黏附至合适的底物;(2)形成微菌落,微菌落融合并形成生物被膜的基底层;(3)产生细胞外基质,逐渐成熟形成三维立体结构;(4)生物被膜子代细胞的播散。李丽娟[11]等研究了烟曲霉生物被膜的形成过程和结构特征,发现烟曲霉生物被膜的形成过程为孢子黏附(4 h),孢子萌芽(8 h),菌丝延长相互连接形成单细胞层(10~12 h),菌丝缠绕形成多层立体结构(16~20 h),最后形成菌丝有序排列、具有复杂的三维立体结构特征的多细胞菌落。本研究结果显示B.cereus的生物被膜形成情况:0~12 h为早期黏附阶段,主要是培养液中的菌体及孢子黏附于96孔板表面,孢子萌发,96孔板表面微生物的生物量逐步增加;12~24 h B.cereus生物被膜OD600值快速增加,生物被膜内菌体迅速增值;24~48 h生物被膜形成量呈短暂的降低趋势,可能是菌体大量繁殖导致营养受到限制;48~72 h为生物被膜成熟阶段,OD600值趋于稳定。
37℃时生物被膜生长状况明显优于4及25℃。本实验证明在4,25,37℃均可长出B.cereus生物被膜,但形成生物被膜量有所不同。不仅室温(25℃)条件下可以生成B.cereus生物被膜,甚至在冷藏温度(4℃)都可生成,证明了生产过程中及时清洁和有效除菌的必要性。37℃生物被膜生长状况明显优于其他温度,这与B.cereus最适生长温度为28~35℃[3]基本相符。
2.3 培养基成分对B.cereus生物被膜形成的影响
碳源与B.cereus生物被膜的形成关系密切(图2):葡萄糖添加量在0~3.0%时随着添加量增加B.cereus生物被膜形成总量整体呈现逐渐增强的趋势,在添加量为3.0%时B.cereus生物被膜形成量最大,为不添加葡萄糖时的1.67倍,此后随着葡萄糖添加量增加,B.cereus生物被膜总量逐渐减少(图2a)。
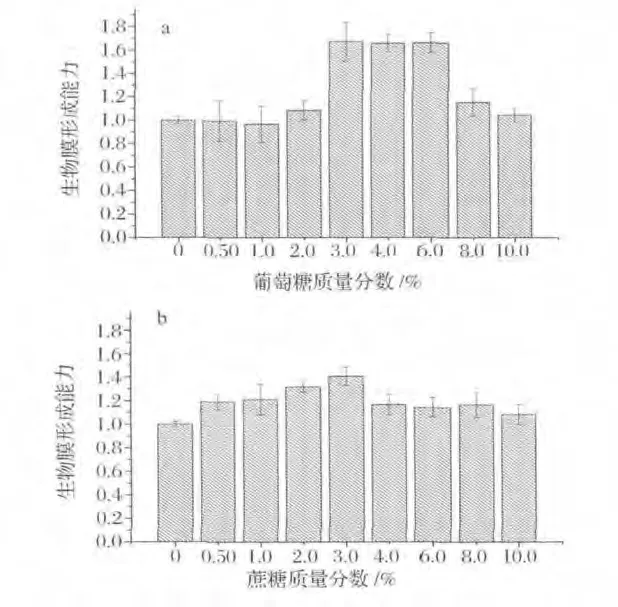
图2 碳源对B.cereus生物被膜形成量的影响Fig.2 Effects of concentration of carbon sources on B.cereus biofilm formation
B.cereus生物被膜形成总量随蔗糖添加量增多先增后减,总体都促进了其生物被膜形成,在添加量为3.0%到达峰值,为不添加蔗糖时的1.33倍(图2b)。
葡萄糖、蔗糖作为微生物生长的碳源,为微生物生命活动提供所需要的碳架和能量,然而一旦超过一定的限度,高浓度的葡萄糖或蔗糖产生高渗透压,抑制B.cereus生物被膜的形成。
图3为无机盐对B.cereus生物被膜形成量的影响结果,添加MgCl2总体均促进了生物被膜的形成,随着添加量的增加,B.cereus生物被膜形成量先增后减,在添加量为0.1%时最强,为不添加时的1.64倍(图3a)。镁是起广泛调节作用的无机元素。它的主要功用是可使正常代谢和生长所需要的酶活化。在研究Mg2+对黏液性铜绿假单胞菌、荧光假单胞菌、嗜水气单胞菌生物被膜的形成作用时,发现Mg2+通过对负电荷(细菌多糖及载体)的吸引既增加菌落间的聚集,又增加了菌落与载体间的黏附[12]。本研究表明:MgCl2总体促进了生物被膜的形成,且促进作用在MgCl2添加量为0.1%时最强。

图3 无机盐对B.cereus生物被膜形成量的影响Fig.3 Effects of inorganic salts on B.cereus biofilm formation
Ca2+可使许多微生物的生长和繁殖速度加快[12],CaCl2添加量在0.01%时促进 B.cereus生物被膜的形成,此时其生物被膜形成总量是不添加CaCl2时的1.21倍 ;此后随着CaCl2浓度增加,B.cereus生物被膜总量逐渐减少(图3b),可能是由于较高浓度Ca2+能通过抑制细菌的生长繁殖而到抑制生物被膜的形成。
图4为不同培养基初始pH对B.cereus生物被膜形成的影响,初始pH为2.0和12.0时,B.cereus基本不形成生物被膜,pH为3.0~7.0时,B.cereus生物被膜形成量随之增加,且pH为7.0时B.cereus生物被膜形成量最大,pH为7.5~12.0时,B.cereus生物被膜形成量明显减少。B.cereus生物被膜形成最适pH为7,这与李南薇[13]等的报道基本一致。
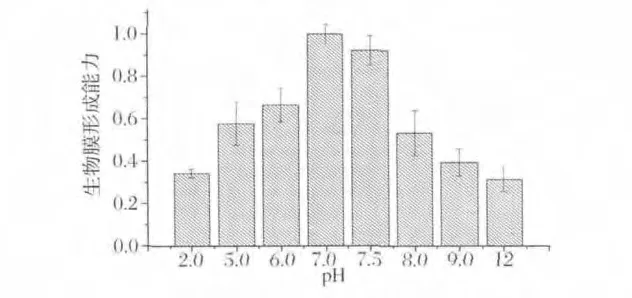
图4 不同培养基初始pH对B.cereus生物被膜形成的影响Fig.4 Effects of medium initial pH on B.cereus biofilm formation
2.4 接触材料对B.cereus生物被膜形成的影响
通过图5可以看出:3种材料表面B.cereus生物被膜的生长趋势大致一致,在3种测试材料中不锈钢表面生物被膜形成总量最大;对培养72 h后形成B.cereus生物被膜的Clean-SS及Rice-SS涡旋处理使其生物被膜剥落后进行菌落计数发现,24 h内2种表面分离出的活菌量没有明显差别。但随着时间延长,表面污染过大米的SS材料分离出的活B.cereus菌体明显多于洁净的材料。
Dourou等[5]研究证明大肠杆菌 O157∶H7 在接触材料表面形成生物被膜的总量与接触表面材料和接触表面污染物有关。本实验证明在不锈钢、有机玻璃以及聚氯乙烯3种材料中,不锈钢表面形成B.cereus生物被膜的总量最大,家庭及工厂生产过程中经常用到不锈钢材料,其潜在的食品安全隐患不容忽视。

图5 材料对B.cereus生物被膜形成量的影响Fig.5 Effects of surface on B.cereus biofilm formation
表面污染过大米的不锈钢材料比清洁的不锈钢表面生成B.cereus生物被膜的总量更大,生物被膜内菌体维持活性时间更长,原因可能是由于污染过大米的不锈钢表面粗糙程度增加,表面自由能发生变化,同时大米还为B.cereus生物被膜生长提供营养物质。这就更加突出了及时清洁(clean-in-place,CIP)的重要性。
3 结论
蜡样芽孢杆菌可在玻璃、聚氯乙烯、有机玻璃、不锈钢表面形成生物被膜,其形成量与培养时间、温度、培养基中碳源、无机盐、pH、渗透压以及生长的材料有密切的关系。B.cereus生物被膜的OD600值在培养24 h达到峰值,48 h后趋于稳定。形成B.cereus生物被膜最适温度为37℃,最适pH为7.0。在培养基中加入10.0%以内的葡萄糖、蔗糖、MgCl2(葡萄糖添加量在3.0% ~6.0%时,蔗糖在3.0%,MgCl2为1.0%分别达到最明显的促进效果);0.01%的CaCl2具有促进生物被膜形成的作用;不锈钢材料与有机玻璃、聚氯乙烯相比生成B.cereus生物被膜的量最大,接触过大米的不锈钢表面比洁净的不锈钢表面B.cereus生物被膜形成总量更大,生物被膜内菌体维持活性时间更长。
[1] 张昕,王子军,冉陆.2008年全国突发公共卫生事件网络报告食物中毒事件分析[J].疾病监测,2010,25(5):406-409.
[2] Nam H,Seo H S,Bang J,et al.Efficacy of gaseous chlorine dioxide in inactivating Bacillus cereus spores attached to and in a biofilm on stainless steel[J].International Journal of Food Microbiology,2014,188:122-12.
[3] 王君.全国食品中蜡样芽孢杆菌的污染分布规律及遗传多样性研究[D].广州:广东工业大学,2013.
[4] Donlan R M,Costerton J W.Biofilms:survival mechanisms of clinically relevant microorganisms[J].Clinical Microbiology Reviews,2002,15(2):167-193.
[5] Dourou D,Beauchamp C S,Yoon Y,et al.Attachment and biofilm formation by Escherichia coli O157:H7 at different temperatures,on various food-contact surfaces encountered in beef processing[J].International Journal of Food Microbiology,2011,149(3):262-268.
[6] Lebert I,Leroy S,Talon R.Effect of industrial and natural biocides on spoilage,pathogenic and technological strains grown in biofilm[J].Food Microbiology,2007,24(3):281-287.
[7] Kumari S,Sarkar P K.In vitro model study for biofilm formation by Bacillus cereus in dairy chilling tanks and optimization of clean-in-place(CIP)regimes using response surface methodology[J].Food Control,2014,36(1):153-158.
[8] Wong H C,Chung Y C,Yu J A.Attachment and inactivation of Vibrio parahaemolyticus on stainless steel and glass surface[J].Food Microbiology,2002,19(4):341-350.
[9] Peng J S,Tsai W C,Chou C C.Inactivation and removal of Bacillus cereus by sanitizer and detergent[J].International Journal of Food Microbiology,2002,77(1-2):11-18.
[10] 吴谦,邓曦,马悦,等.副溶血弧菌在玻璃表面生物菌膜的生长特性及超声波法解离作用[J].现代食品科技,2015,31(4):181-185.
[11] 李丽娟,陈伟,许辉,等.曲霉生物被膜的形成过程与结构特征[J].中国真菌学杂志,2011,6(2):93-97.
[12] 袁海兰,苏建,胡鲲,等.环境因子对水霉菌生物被膜形成的影响[J].微生物学通报,2014,41(9):1 829-1 836.
[13] 李南薇,何佩倩,杜冰,等.培养条件对蜡样芽孢杆菌生物被膜生长的影响[J].食品工业,2012(7):108-110.
[14] 仪淑敏,李远钊,张培正,等.蜡样芽孢杆菌在营养肉汤和维也纳香肠中的生长模型及控制[J].食品工业科技,2007,28(9):72-75.
