利用代谢工程构建高产乙偶姻枯草芽孢杆菌
2015-12-25张显赵晓静李欣饶志明
张显,赵晓静,李欣,饶志明,2
1(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏无锡,214122)
2(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
乙偶姻是一种重要的香料物质,又名3-羟基-2-丁酮或甲基乙酰甲醇。乙偶姻主要用于配置奶香型、肉香型、草莓香型的香精,或直接用于奶制品[1]。我国国家标准GB 2760—1986明确规定其为允许使用的食品级香料,美国食品和萃取协会(FEMA)安全号为2008[2]。乙偶姻在微生物体内的生理作用主要表现在3个方面:中和发酵过程中酸性产物对菌体的毒害作用,乙偶姻代谢产物2,3-丁二醇也被认为有这种作用[3];储存能量和碳源,研究证明,细胞在缺乏碳源时可以利用自身产生的乙偶姻来进行能量和物质供给[4];由于乙偶姻和2,3-丁二醇在相互转化的过程中需要NADH/NAD+作为辅酶,因此也认为乙偶姻和2,3-丁二醇在微生物中是调节细胞氧化还原水平的一种机制[4-5]。
乙偶姻的生产方法主要分为化学合成法、酶转化法和微生物发酵法[6]。近年来微生物发酵法生产乙偶姻受到越来越多的关注,许多菌株可以生产乙偶姻,比如 Lactococcuslactis,Klebsiella oxytoca,Bacillus subtilis,Paenibacilluspolymyxa,Enterobacter aerogenes,Leuconostoc mesenteroides,Saccharomyces cerevisiae[7]。在这些菌株中,枯草芽孢杆菌被公认为是食品安全菌株,通常用来作为一种平台微生物来获得多种次级代谢产物。近年来微生物发酵法生产乙偶姻受到越来越多的关注,各国科学家相继开展这方面的工作。目前对发酵法生产乙偶姻的研究多集中在筛选野生菌株和对发酵培养基或者工艺进行优化方面,而基因工程改造菌株报道相对较少,大部分产量也较低。
本实验室前期筛选到1株高产乙偶姻的枯草芽孢杆菌B.subtilis JNA3-10,该菌株利用葡萄糖发酵140 h左右,可以生产大约42.2 g/L的乙偶姻[8]。在枯草芽孢杆菌中,丙酮酸到乙偶姻的合成途径包括两个关键酶:alsS基因编码的α-乙酰乳酸合成酶(α-acetolactate synthetase,ALS)和alsD基因编码的α-乙酰乳酸脱羧酶(α-acetolacetate decearboxylase,ALDC),它们催化丙酮酸到α-乙酰乳酸再到乙偶姻的这个过程。另外乙偶姻在bdhA基因编码的乙偶姻还原酶/2,3-丁二醇脱氢酶(AR/BDH)催化下可以和2,3-丁二醇相互转化。在代谢工程育种中,阻断目标产物的降解途径或加强目标产物前体物的代谢通量是有效提高目的产物积累量的重要手段。本课题将上述策略应用于B.subtilis JNA 3-10:在实验室前期对bdhA基因进行分子敲除的基础上[7]克隆了来自出发菌株的ALS和ALDC编码基因,进一步研究了ALS和ALDC在bdhA敲除菌株(BM)中进行加强表达对乙偶姻发酵的影响。
1 材料与方法
1.1 菌株、质粒与引物
在已公布的枯草芽孢杆菌全基因组序列中,我们选择模式菌株B.subtilis 168基因序列作为参考,并以此设计实验引物。表1为本实验用到的菌株、质粒及设计的引物。

表1 菌株、质粒及引物Table 1 Strains,plasmids and primers used in this study
1.2 主要试剂、相关培养基与培养条件
DNA胶回收试剂盒、质粒小量提取试剂盒均购自博大泰克生物工程有限公司;工具酶和广范围蛋白质分子量标准购自Takara公司;丙烯酰胺、甲叉双丙烯酰胺、IPTG、咪唑、抗生素、2-(N-马啉代)乙磺酸、Brij35购自上海 Sangon公司;PCR引物由上海Sangon公司合成;乙酰基-2-甲基乙酰乙酸乙酯(ethyl-2-acetoxy-2-methylacetocetate)购自sigma公司;FAD(黄素腺嘌呤二核苷酸)、TPP(焦磷酸硫胺素)、DTT(二硫苏糖醇)均购自百灵威公司;其他生化试剂均购自国药集团化学试剂有限公司。
发酵种子培养基:采用LB培养基(酵母粉5 g/L,蛋白胨10 g/L,NaCl 10 g/L,配置LB培养基所需蛋白胨、酵母粉购于OXOID公司),培养条件为旋转式摇床37℃,160 r/min。
发酵培养基:酵母膏5 g/L,玉米浆6 g/L,尿素2 g/L,葡萄糖 100~150 g/L,培养条件为旋转式摇床37℃,160 r/min;相应的固体培养基为上述培养基中添加20 g/L的琼脂粉。
发酵条件:发酵温度为37℃,发酵初始pH在6.4~6.8,种龄选择10 h,接种量选择6%。
1.3 枯草芽孢杆菌染色体的提取
细菌染色体提取方法参照细菌基因组DNA提取试剂盒相关操作说明(上海生工生物)。
1.4 PCR反应及其产物回收
PCR总反应体系为50 μL,包含1 ng的DNA模板,200 μmol/L dNTP,20μmol/L 引物和 1 μL 的ExTaq DNA聚合酶。程序设定为95℃预变性5 min;循环扩增程序为95℃变性50 s,56℃退火90 s,72℃延伸90 s(根据实际情况,时间设定为1 kb/min),35个循环;72℃延伸10 min。PCR反应产物用1%的琼脂糖凝胶电泳分离,目的条带经分离后用胶回收试剂盒(Takara)按照说明书上的方法回收,回收的DNA产物送上海生工生物有限公司测序。
1.5 感受态细胞的制备与转化
大肠杆菌感受态细胞的制备及转化采用CaCl2法[9]。
枯草芽孢杆菌感受态的制备及转化按照文献方法进行[10]。
1.6 重组菌构建及验证
根据GenBank中公布的来自B.subtilis 168的alsS(Gene ID:936852)和alsD(Gene ID:936857)基因序列分别设计引物(见表1)。利用PCR技术克隆来自B.subtilis JNA 3-10的alsS基因(连接pET-28a(+)用到引物P1和P2,连接pMA5用到引物P1和P3)和alsD基因(连接pET-28a(+)用到引物P4和P5,连接pMA5用到引物P4和P6),分别将其连接到大肠杆菌表达载体pET-28a(+)和枯草芽孢杆菌表达载体pMA5上。由于alsS和alsD基因在枯草芽孢杆菌染色体上处在相邻的位置,因此可以利用alsS的上游引物和alsD的下游引物来克隆alsSD基因片段(用到引物P1和P6),并将alsSD连接至枯草芽孢杆菌表达载体pMA5上,构建ALS和ALDC在枯草芽孢杆菌中的共表达质粒pMA5-alsSD。将构建好的质粒转化大肠杆菌E.coli BL21(DE3)和枯草芽孢杆菌B.subtilis JNA 3-10感受态细胞,抽提质粒后进行酶切验证。
1.7 重组菌蛋白表达及总蛋白浓度测定
大肠杆菌重组蛋白的诱导表达:将活化好的菌液接种至10 mL含50 μg/mL卡那霉素的LB培养基,菌体生长进入到对数期之后加入1 mmol/L的IPTG进行诱导培养,诱导培养时间约为4~12 h。
重组蛋白表达情况分析:利用SDS-PAGE分析重组菌的全细胞蛋白[11];总蛋白质浓度采用Brandford方法,以牛血清蛋白(BSA)作为标准[12]。
1.8 ALS及ALDC酶活检测分析
ALS和ALDC酶活力的测定参照文献进行[10]。
ALS单位酶活(IU)定义为:在37℃,pH 7.0的反应条件下,每分钟合成1 μmol乙酰乳酸所用的酶量;ALDC单位酶活(IU)定义为:在30℃,pH 6.0的反应条件下,每分钟使α-乙酰乳酸脱羧形成1 μmol乙偶姻的酶量。
1.9 组氨酸标签蛋白的Ni-NTA纯化
蛋白质纯化方法参照文献进行[13]。
1.10 发酵参数分析方法
乙偶姻和2,3-丁二醇采用气相色谱法检测[14];葡萄糖采用SBA生物传感器测定[15];有机酸产物采用高效液相色谱法测定[16]。
2 结果与讨论
2.1 枯草芽孢杆菌JNA 3-10 alsS和alsD基因的克隆及其序列分析
以B.subtilis JNA 3-10基因组DNA为模板,分别用alsS和alsD的上下游引物进行PCR扩增,分别得到大小约为1 713 bp的alsS片段及大约768 bp的alsD片段,分别连接pMD18-T载体,构建克隆载体T-alsS和T-alsD,送上海生工测序。
测序结果经GenBank BLAST比对,结果表明本实验扩增得到的来自B.subtilis JNA 3-10的基因alsS和alsD与GenBank中公布的B.subtilis 168基因组中的alsS和alsD基因同源性分别达到99.5%和100%,其中alsS基因有8个碱基位点的差异,使得其编码的ALS相比较模式菌株的ALS发生了5个氨基酸的变化,而alsD基因编码的ALDC与模式菌株的ALDC氨基酸序列没有差异。
2.2 大肠杆菌重组表达质粒pET28a-alsS和pET28a-alsD的构建
将T-alsS、T-alsD和表达载体pET-28a(+)用相应的限制性内切酶Xhol I和BamH I酶切,经胶回收、纯化、连接后,重组质粒转化E.coli BL21(DE3)。挑取在含氨苄青霉素平板上长出的转化子,经活化后抽提质粒,并用限制性内切酶Xhol I和BamH I处理,释放出5 369 bp长度的pET28a片段和相应长度的目的基因片段。酶切验证如图1,结果表明E.coli BL21/pET28a-alsS和E.coli BL21/pET28a-alsD构建成功。
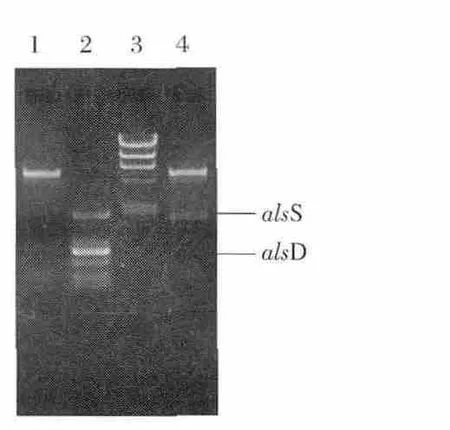
图1 pET28a-alsD与pET28a-alsS限制性酶切图谱Fig.1 Enzyme digestion analysis of recombinant plasmids pET28a-alsS and pET28a-alsD
2.3 重组大肠杆菌的SDS-PAGE分析
将重组菌株E.coli BL21/pET28a-alsS和E.coli BL21/pET28a-alsD分别接种于LB培养基培养至对数期,然后经IPTG诱导过夜,8 000 r/min离心10 min收集菌体,用pH 7.4的PBS缓冲液洗涤菌体2次,菌体重悬于20 mL细胞破碎缓冲液并置于冰水中,采用超声波破碎细胞,经12 000 r/min离心30 min,得到的上清液即为粗酶液。将上述蛋白样品经SDS-PAGE电泳,结果如图2所示,排除载体本身可以表达大小约3 ku的His标签,过量表达的重组菌特异性蛋白大小与预期一致,其中ALS大约为62 ku,ALDC大约为29 ku,初步确认为目的蛋白ALS与ALDC。

图2 重组菌SDS-PAGE电泳图片Fig.2 SDS-PAGE analysis of whole cell proteins in recombinant strains
2.4 ALS和ALDC的蛋白纯化
收集经IPTG诱导后的E.coli BL21/pET28a-alsS和E.coli BL21/pET28a-alsD菌体经超声波破碎,离心取上清液。采用Ni-NTA亲和层析法对ALS和ALDC进行纯化,经SDS-PAGE电泳,由图3可以看到,纯化后得到的蛋白大小与目的蛋白ALS和ALDC一致。经测定ALS粗酶液纯化后比酶活可达到原来的6.8倍,而ALDC粗酶液纯化倍数约为6.65,相关数据见表2。

图3 ALS和ALDC经纯化后电泳分析Fig.3 SDS-PAGE analysis of purified ALS and ALDC
2.5 ALS和ALDC的酶学性质分析
2.5.1 pH对ALS和ALDC酶活力的影响
配制pH 3~11的反应缓冲液,分别测定不同pH环境下ALS和ALDC的活力,将最适pH条件的酶活力定义为100%,结果如图4所示。ALS的最适pH为8.0,该酶在中性偏碱性的pH环境活力较高;图5所示ALDC的最适pH为6.0,该酶在中性偏酸的环境活力较高,当pH大于7.0或者小于5.0时,ALDC的活力迅速下降。在自然发酵过程中,发酵培养基前期维持中性偏酸的环境有利于枯草芽孢杆菌的生长和底物的利用,前期发酵过程中酸性产物的生成也会使发酵培养基偏酸性,这个环境有利于ALDC将α-乙酰乳酸转化到乙偶姻,但是并不利于ALS将丙酮酸转化到α-乙酰乳酸,因此ALS的活力是限制乙偶姻高效合成的一个比较关键因素。
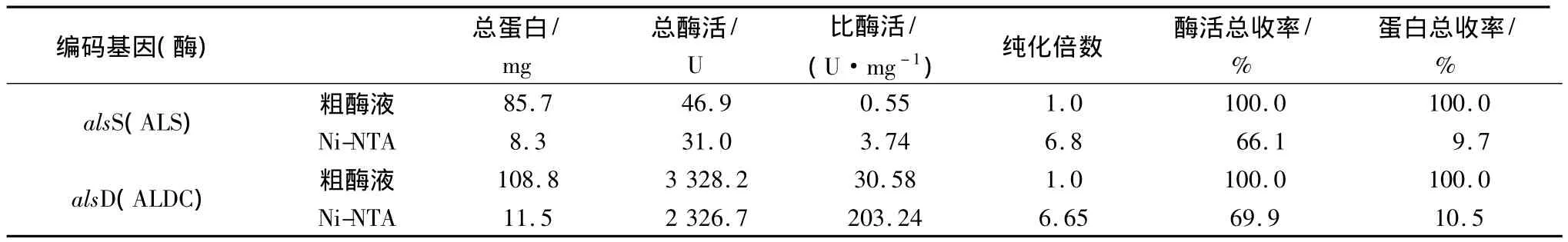
表2 重组菌目的蛋白纯化过程Table 2 Purification of the over-expressed proteins
2.5.2 温度对ALS和ALDC酶活力的影响
在25~60℃范围内,每隔5℃设1个梯度,检测ALS和ALDC在不同温度条件下的酶活力的大小,将最适温度下的酶活力定义为100%。结果如图6所示,ALS最适温度在50℃,低于或者高于该温度,酶活力下降较明显;图7所示ALDC的最适温度为35℃,在25℃至45℃范围内酶活力相差不大,高于45℃酶活力下降较明显。以上结果表明,ALS在正常发酵温度(37℃左右)的酶活力较低,限制了丙酮酸分解代谢流向乙偶姻途径的分配,而ALDC则在发酵温度下保持了较高的酶活力。
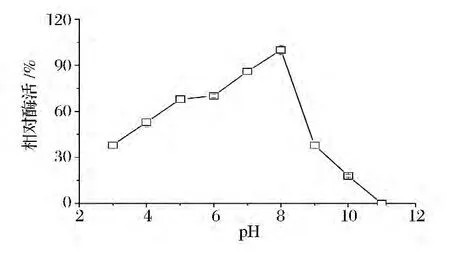
图4 pH对ALS酶活力的影响Fig.4 Effect of pH on enzyme activity of ALS

图5 pH对ALDC酶活力的影响Fig.5 Effect of pH on enzyme activity of ALDC
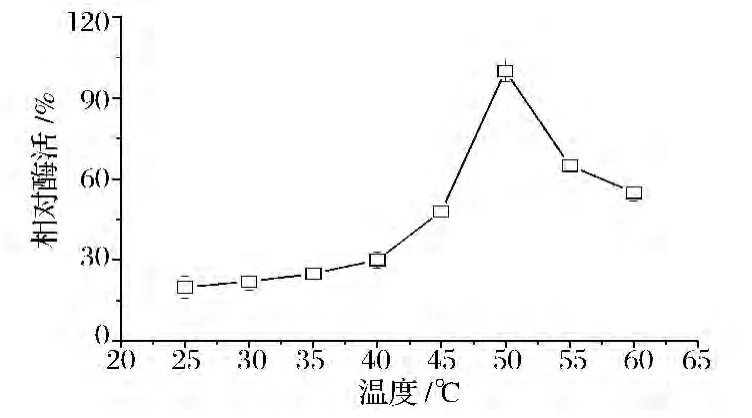
图6 温度对ALS酶活力的影响Fig.6 Effect of temperature on enzyme activity of ALS

图7 温度对ALDC酶活力的影响Fig.7 Effect of temperature on enzyme activity of ALDC
2.5.3 pH对ALS和ALDC酶活力稳定性的影响
根据酶最适的反应pH范围,将纯化后的酶保存在不同pH的缓冲液中,冰上放置10 h,每隔2 h取样并在酶的最适温度和最适pH条件下测定酶活力。图8和9分别表示了ALS和ALDC在不同pH条件下的稳定性情况。结果表明,ALS在pH 7.0和pH 8.0的时候较稳定,10 h后仍有90%左右的活力,而在偏酸性环境下(pH 6.0)稳定性较差,不利于乙偶姻发酵,因此增强ALS的表达对乙偶姻的发酵有重要意义;ALDC在pH为6.0的条件下较稳定,较高或较低的pH都会导致酶活力较大的损失,当其在pH为8.0的缓冲液中保存4 h后完全失活。由于发酵后期乙偶姻的合成使得发酵液pH上升,呈现偏碱性的pH,因此当发酵后期乙偶姻产量积累到一定程度,发酵液pH发生上升时会反过来促使ALDC发生降解,阻止乙偶姻的合成,使发酵液pH维持在一个中性范围,此时ALDC对维持发酵液pH起了一种调节作用。
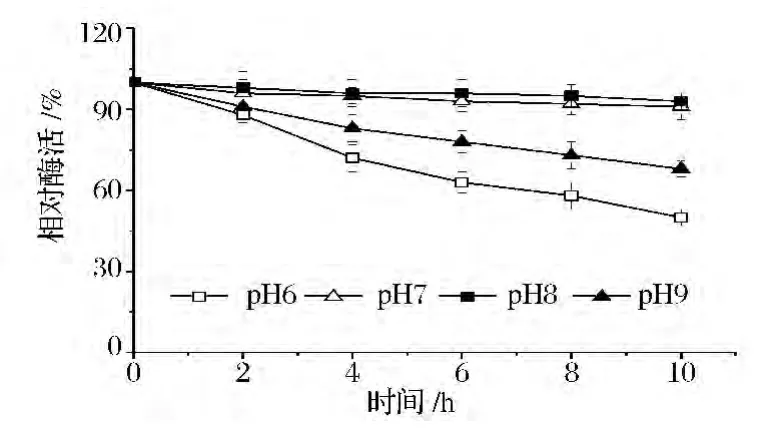
图8 pH对ALS酶活力稳定性的影响Fig.8 Effect of pH on enzyme stability of ALS
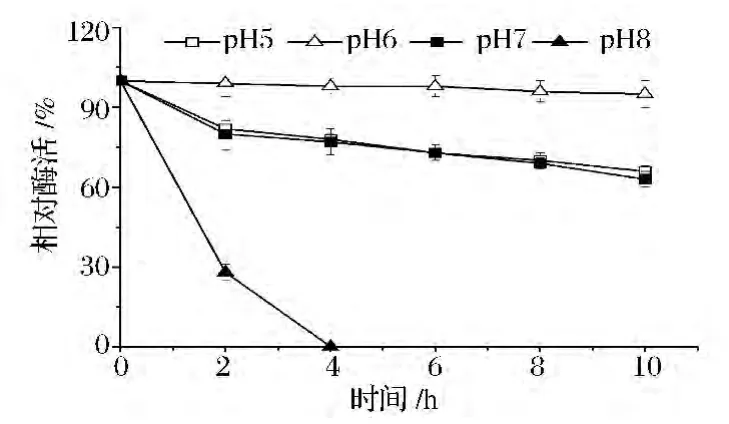
图9 pH对ALDC酶活力稳定性的影响Fig.9 Effect of pH on enzyme stability of ALDC
2.5.4 温度对ALS和ALDC酶活力稳定性的影响
选择常用的酶保藏所需的温度和酶促反应所需的温度,将纯化后的酶保存液在不同的温度下放置10 h,每隔2 h取样并在酶的最适温度和pH条件下检测酶的活力。图10和图11分别表示了ALS和ALDC在不同温度条件下的稳定性。可以看出ALS在0℃和-20℃时放置10 h酶活力基本保持不变,而在其最适反应温度50℃放置10 h后完全失活,表明该酶在最适反应温度下并不稳定,当ALS在发酵温度37℃保存10 h后,酶活力仅剩余20%左右,表明该酶不稳定,容易变性或降解;ALDC在0℃和-20℃时放置10 h酶活力同样基本保持不变,随着温度的升高,酶的稳定性逐渐下降,而在其最适反应温度35℃时放置10 h,酶活力仅为初始酶活力的50%左右。以上结果表明ALS和ALDC在发酵温度附近稳定性较差,因此在细胞内加强它们的表达会有利于乙偶姻的合成,又由于ALS稳定性相比ALDC更差,加强ALS的表达可能更为重要。

图10 温度对ALS酶活力稳定性的影响Fig.10 Effect of temperature on enzyme stability of ALS

图11 温度对ALDC酶活力稳定性的影响Fig.11 Effect of temperature on enzyme stability of ALDC
2.5.5 金属离子及EDTA对ALS和ALDC酶活力的影响
以不加金属离子的反应体系为对照,分别在反应体系中加入终浓度为1 mmol/L的Ca2+、Sn2+、Ni2+、Zn2+、Li+、Mn2+、K+、Na+、Mg2+、Cu2+、Fe3+等离子以及EDTA,研究各金属离子及EDTA对ALS和ALDC活力的影响。研究发现大多数金属离子及EDTA对ALS都有较大抑制作用,而K+和Li+对其无明显抑制作用(图12);对于ALDC而言,EDTA和大部分金属离子对其均有轻微的抑制作用,K+和Ni2+对其有轻微的促进作用(图13)。
2.6 增强表达ALS和ALDC对枯草芽孢杆菌发酵生产乙偶姻的影响
2.6.1 重组表达质粒pMA5-alsS、pMA5-alsD和pMA5-alsSD的构建

图12 金属离子及EDTA对ALS活力的影响Fig.12 Effect of mental ions and EDTA on enzyme activity of ALS

图13 金属离子及EDTA对ALDC活力的影响Fig.13 Effect of mental ions and EDTA on enzyme activity of ALDC
分别将克隆得到alsS、alsD以及alsSD基因和枯草芽孢杆菌表达载体pMA5用相应的限制性内切酶BamH I和Mlu I酶切,经胶回收、纯化、连接,转化克隆宿主E.coli JM109。挑取在氨苄抗生素平板上长出的转化子,经活化后抽提质粒,并用相应的限制性内切酶处理重组质粒,琼脂糖凝胶电泳结果显示释放出约7 107 bp的pMA5片段和相应长度的目的基因片段。结果表明 pMA5-alsS、pMA5-alsD和 pMA5-alsSD构建成功。
2.6.2 重组枯草芽孢杆菌BMS、BMD和BMSD的构建及发酵分析
将构建好的重组表达质粒 pMA5-alsS、pMA5-alsD和pMA5-alsSD转化枯草芽孢杆菌BM,获得重组菌BMS、BMD以及BMSD。对3株重组菌及原始菌进行了5+L罐发酵比较,如图14和表3。结果表明:(A)在菌株BM中分别过量表达ALS、ALDC使得ALS和ALDC的酶活力提高幅度在30倍左右,而同时过量表达这两个酶使得它们的酶活力提高幅度都在25倍左右;(B)在菌株BM中分别过量表达ALS和ALDC,发酵结果并不理想,说明单独加强丙酮酸到乙偶姻代谢途径中其中一个酶的表达水平并不能有效增强该途径代谢流;另外,根据发酵过程曲线我们还发现过量表达ALS或ALDC抑制了发酵前期菌体的生长,最终导致重组菌的乙偶姻发酵水平提高不明显。重组菌乙偶姻产量分别提高了5.2%和4.1%(BMS产量为50.8 g/L,BMD产量为50.3 g/L);(C)同时过量表达ALS和ALDC对乙偶姻发酵过程有较好的促进作用,但是由于发酵前期菌体生长也同样受到了一定的抑制,乙偶姻产量提高约10.8%,达到53.5 g/L;(D)增强丙酮酸到乙偶姻的合成途径会竞争性的削弱其它以丙酮酸为前体的副产物代谢流,表3结果显示,乙偶姻发酵过程中的一些副产物如乙酸、乳酸、乙醇等的产量都有一定程度的下降。
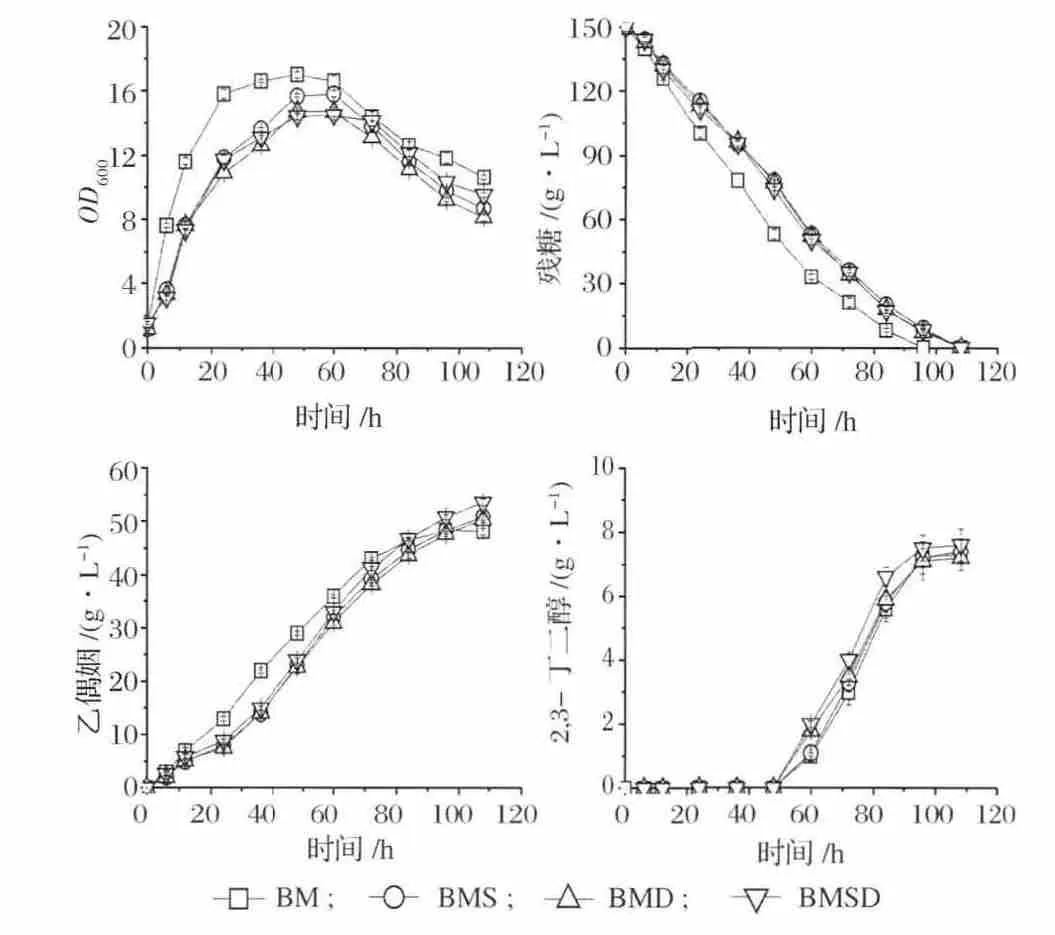
图14 菌株BM、BMS、BMD、BMSD的发酵过程曲线Fig.14 Fermentation curves of strain BM,BMS,BMD and BMSD
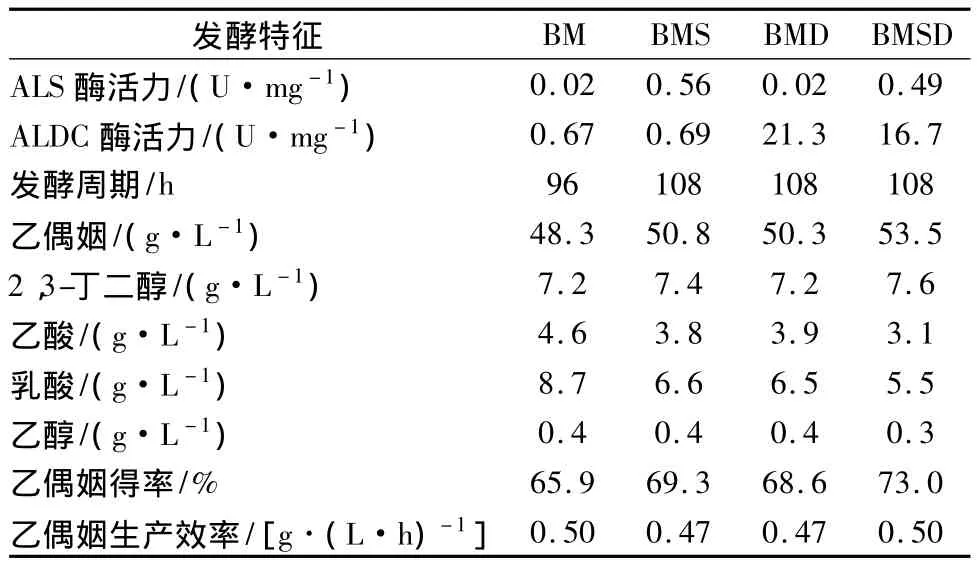
表3 菌株BM、BMS、BMD、BMSD的发酵特征比较Table 3 Comparison of fermentation characterizations of strains BM,BMS,BMD and BMSD
研究表明,只有当胞内的丙酮酸浓度达到一定水平[17-18],伴随着 ALS 活力较明显的升高[19],细胞才会开始大量合成乙偶姻,这可能是因为乙偶姻具有中和胞内酸性产物维持细胞内部pH的作用[20],因为当丙酮酸过量积累时,细胞内的乳酸、乙酸等也会开始积累,使得发酵液pH下降。但是当过量表达ALS和ALDC的时候,细胞在发酵前期主要是进行蛋白质的合成,其生长速率受到了一定程度的影响,不利于菌体对葡萄糖的利用。
3 结论
本实验克隆了来自B.subtilis JNA 3-10中的alsS和alsD基因,并与GeneBank中公布的B.subtilis 168基因组中的alsS和alsD基因进行序列比较,发现其相似度分别达到99.5%和100%。成功将B.subtilis JNA 3-10中alsS和alsD基因编码的ALS和ALDC分别在大肠杆菌BL21中进行过量表达,随后对ALS和ALDC进行了初步的纯化。对ALS和ALDC酶学性质进行初步分析发现:ALS和ALDC的最适反应pH分别为pH 8.0和pH 6.0;ALS在pH 7.0和pH 8.0的时候较稳定,ALDC在pH为6.0的条件下较稳定,升高或降低pH都会导致ALDC酶活力较大的损失;两个酶的最适反应温度分别为50℃和35℃,在0℃和-20℃时保存都较稳定,而在它们的最适反应温度下,两个酶的热稳定性都较差;大部分金属离子或EDTA对ALS都有一定的抑制作用,而K+和Ni2+对ALDC酶活力有轻微的促进作用。为了进一步提高目标产物乙偶姻的产量,提出了在菌株BM中分别加强表达ALS或ALDC或者同时加强表达这两个酶的策略,结果发现:过量表达的蛋白会对发酵前期菌体生长造成抑制;单独表达ALS或者ALDC,乙偶姻发酵产量分别提高5.2%和4.1%(BMS为50.8 g/L,BMD为50.3 g/L);而同时过量表达ALS和ALDC,乙偶姻产量提高10.8%左右(53.5 g/L)。本研究表明,加强乙偶姻合成途径关键酶的表达,会增强乙偶姻合成代谢流,并且会在一定程度上削弱相关副产物的积累。
[1] 韩丽,赵祥颖,刘建军.乙偶姻的性质、生产及应用[J].山东轻工学院学报,2007,21(4):80-83.
[2] 张小舟,曾崇余,任晓乾.乙偶姻合成研究现状及展望[J].江苏化工,2001,23(4):29-31.
[3] Speck E L,Freese E.Control of metabolite secretion in Bacillus subtilis[J].J Gen Microbiol,1973,78(2):261-275.
[4] Johansen L,Bryn K,Stormer F C.Physiological and biochemical role of the butanediol pathway in Aerobacter(En-terobacter)aerogenes[J].J Bacteriol,1975,123(3):1 124-1 130.
[5] JI Xiao-jun,HUANG He,OUYANG P K.Microbial 2,3-butanediol production:A state-of-the-art review[J].Biotechnology Advances,2011,29(3):351-364.
[6] 韩丽,赵祥颖,刘建军.3-羟基丁酮的研究现状[J].食品与发酵工业,2006,32(10):116-118.
[7] ZHANG Xian,ZHANG Rong-zhen,BAO Teng,et al.The rebalanced pathway significantly enhances acetoin production by disruption of acetoin reductase gene and moderateexpression of a new water-forming NADH oxidase in Bacillus subtilis[J].Metabolic Engineering,2014,23:34-41.
[8] ZHANG Xian,YANG Tao-wei,LIN Qin,et al.Isolation and identification of an acetoin high production bacterium that can reverse transform 2,3-butanediol to acetoin at the decline phase of fermentation[J].World Journal of Microbiology & Biotechnology,2011,27(12):2 785-2 790.
[9] Sambrook J,Russell D W.Molecular cloning:a laboratory manual[M].Cold Spring Harbor Laboratory Press,2001.
[10] ZHANG Xian,ZHANG Rong-zhen,BAO Teng,et al.Moderate expression of the transcriptional regulator ALsR enhances acetoin production by Bacillus subtilis[J].J Ind Microbiol Biotechnol,2013,40(9):1 067-1 076.
[11] Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5 259):680-685.
[12] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[13] ZHANG Xian,BAO Teng,RAO Zhi-ming,et al.Two-stage pH control strategy based on the pH preference of acetoin reductase regulates acetoin and 2,3-butanediol distribution in Bacillus subtilis[J].PLoS One,2014,9(3):e91187.
[14] ZHANG Xian,ZHANG Rong-zhen,YANG Tao-wei,et al.Mutation breeding of acetoin high producing Bacillus subtilis blocked in 2,3-butanediol dehydrogenase[J].World J Microbiol Biotechnol,2013,29:1 783-1 789.
[15] YANG Tao-wei,RAO Zhi-ming,ZHANG Xian,et al.Production of 2,3-butanediol from glucose by GRAS microorganism Bacillus amyloliquefaciens[J].Journal of Basic Microbiology,2011,51(6):650-658.
[16] YANG Tao-wei,RAO Zhi-ming,ZHANG Xian,et al.Fermentation of biodiesel-derived glycerol by Bacillus amyloliquefaciens:effects of co-substrates on 2,3-butanediol production[J].Applied Microbiology and Biotechnology,2013,97(17):7 651-7 658.
[17] XIAO Zi-jun,LIU P H,QIN Jia-yang,et al.Statistical optimization of medium components for enhanced acetoin production from molasses and soybean meal hydrolysate[J].Applied Microbiology and Biotechnology,2007,74(1):61-68.
[18] Starrenburg M J,Hugenholtz J.Citrate Fermentation by Lactococcus and Leuconostoc spp.[J].Appl Environ Microbiol,1991,57(12):3 535-3 540.
[19] Martin M G,Magni C,de Mendoza D,et al.CitI,a transcription factor involved in regulation of citrate metabolism in lactic acid bacteria[J].J Bacteriol,2005,187(15):5 146-5 155.
[20] XIAO Zi-jun,XU Ping.Acetoin metabolism in bacteria[J].Critical Reviews in Microbiology,2007,33(2):127-140.
