α核素肿瘤靶向治疗药物研究的进展与挑战
2015-12-25杨远友廖家莉
刘 宁,马 欢,杨远友,廖家莉
四川大学 原子核科学技术研究所,辐射物理及技术教育部重点实验室,四川 成都 610064
α核素较β核素有更高的能量和较短的射程,理论上认为α核素靶向治疗(TAT)药物针对微小肿瘤、散在性癌和微转移癌有良好的应用前景。虽然α核素达百多种,但是能应用到放射免疫药物上的并不多,仅包括211At、213Bi、212Bi、225Ac、223Ra等少数α核素,其性质列入表1[1]。适用于放射免疫药物的核素理想半衰期应在30min~10d,但大部分α核素的半衰期过长或过短,另外研究所需高核纯的α核素生产困难,使这些核素的价格相对昂贵。α核素发出的α射线能量高,传能线密度值(LET)为80~100keV/μm,与辐射治疗的最佳LET值(100keV/μm)非常接近[2];发出的α粒子射程短,在软组织中的射程一般小于100μm,仅相当于5~10个肿瘤细胞的直径[3],医护人员的辐射防护措施实施较容易;相对生物学效应(RBE)高,能引起DNA双链不可修复的断裂[4];引起的细胞毒性作用几乎和剂量率与含氧量无关,可以有效地杀死乏氧癌细胞。基于以上优点,近年来有关α核素放射免疫药物的研究取得了相当进展,特别对微小肿瘤、散在性癌和微转移癌的靶向治疗显示出可喜的应用前景[5]。如果将α核素与对肿瘤细胞具有特异性亲和力的载体相结合,是治疗肿瘤、特别是微小转移癌和散在性癌的一条有效的途径。不过,由于α粒子的这些特点,也给α核素放射免疫药物的研究提出了更严格的要求,即必须采用对肿瘤细胞具有高亲和性的载体,载体的生物半衰期要与标记所用核素的半衰期相匹配,且制得的放射免疫药物在体内应有足够的稳定性。否则,所制得的放射免疫药物难以达到在最大程度地杀死肿瘤细胞的同时降低对正常细胞损伤的疗效。本文介绍了目前国内外一些研究比较活跃的α治疗核素用于肿瘤靶向治疗的新进展,对于面临的问题、现状及临床应用前景也进行了探讨。
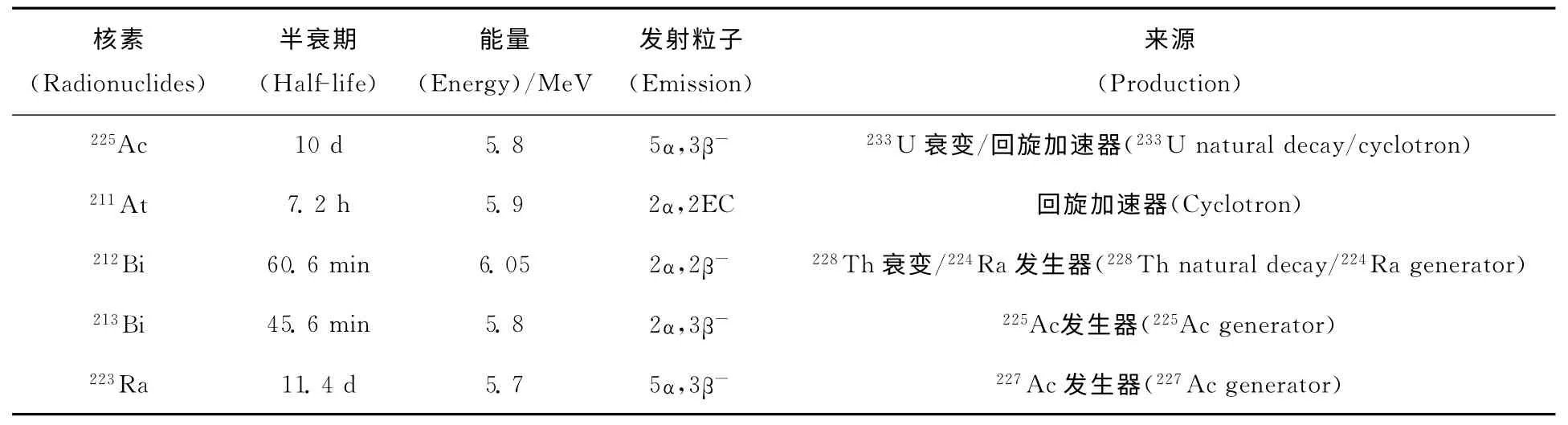
表1 适用于靶向治疗的α核素性质[1]Table 1 Properties ofα-radioactive nuclide suitable for TAT[1]
1 α核素放射性药物研究进展
从20世纪40—50年代开始[6],就有学者开始研究α核素211At在鼠、猴及人体中的药代动力学和细胞毒性[5],为211At放射免疫药物的研究奠定了基础。进入70年代以后,211At、213Bi、212Bi、225Ac、223Ra等α核素用于肿瘤靶向治疗的研究先后引起了国内外学者的重视,取得了相当的进展,并已进入临床研究阶段。特别是美国食品药品监督管理局(FDA)与欧盟药品管理局(EMA)已将223Ra-dichloride批准用于临床治疗(表2)。关于α核素放射性药物的研究大多集中在通过偶联剂将α核素与单克隆抗体及其片段或多肽连在一起,考察其体内外稳定性、生物分布及临床与临床前试验。下面就几种适用于靶向治疗的α核素的研究进展简要加以介绍。
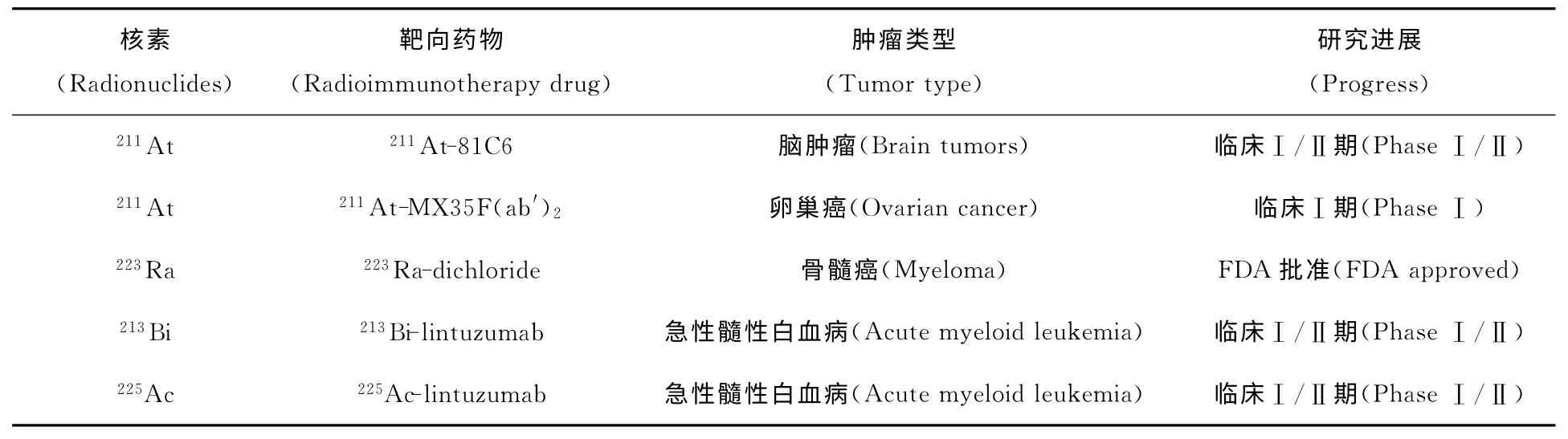
表2 α核素靶向治疗的进展Table 2 Progress in TAT
1.1 211At
At是重卤族元素,化学性质与I相似,但具有I所没有的轻金属性,可与芳环上的碳原子较稳定地结合[7]。211At衰变纲图示于图1,其能释放出近100%的α射线,射线平均能量为6.78MeV,其LET为98.84keV/μm;在软组织中的射程约为6~8个细胞的范围(55~88μm),就放射治疗而言,它是除硼中子俘获治疗外仅有的高传能线密度体系[6]。
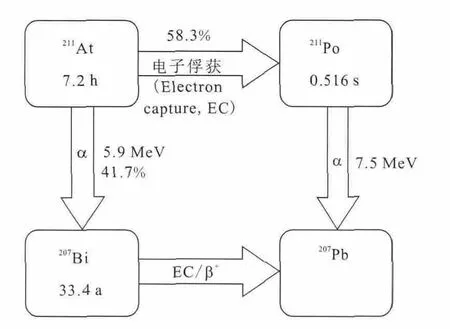
图1 211 At衰变纲图Fig.1 Decay chain of 211 At
211At一般通过α粒子引起的核反应209Bi(α,2n)211At来制备,但应控制照射到Bi靶上的α射线能量,当α射线能量高于28MeV时就会产生210At(T1/2=8.3h),210At的 子 体210Po(T1/2=133.38d)也为α辐射体,对骨髓具有极强的毒性[8]。为此,国内外一般采用能量为22.0~28.5MeV的α粒子照射Bi靶来制备211At,在满足高211At产量的同时尽量减小210At的含量。20世纪90年代,Larsen等[9]将外靶照射改为内靶照射后,极大地提高了211At的产率,这让211At标记药物向临床应用迈了一大步。此外IBA公司于2010年在法国南特大学投建了一个能量可达70MeV的加速器(ARRONAX)用于211At等医用同位素的生产,以实现211At的商业供应,这对211At放射免疫药物的研究来说无疑是一个振奋人心的好消息。
从20世纪70年代211At放射免疫药物的研究受到国内外重视开始,除了利用211At标记一些对肿瘤有亲和力的小分子化合物外,更多的集中在211At标记偶联单克隆抗体及其片段的放射免疫药物上[10-14]。在国内,除20世纪80年代初刘伯里等[15]曾开展过211At标记化合物的初步探讨,以及最近合肥工业大学林辉等[16]进行了211At在细胞群模型的剂量分布模拟计算外,仅本课题组对此进行了长期且系统的研究工作[14,17-18]。
近年来,有关211At靶向药物的研究更加细致与深入。关于211At靶向药物涉及到偶联剂、标记方法、靶向药物生物分布、肝/肾脏及血液学毒性、α射线造成的DNA损伤应答和生物学后果及对基因转录的影响等,还有211At放射免疫药物与化疗药物、外科手术、β核素标记药物联用的研究日渐丰富[19-23]。
α核素有高的相对生物学效应,对DNA双链的破坏力较其他类型核素强。Lyckesvärd等[4]比较了发射γ射线的60Co和发射α射线的211At对不同细胞周期状态下的正常甲状腺细胞的DNA损伤与修复情况。在24h内各细胞的γ-H2AX水平均出现下降的趋势,但之后除了经211At照射的处于分裂周期中的细胞,其他细胞都完成了修复。细胞的pChk2值变化趋势再次证明了α射线较γ射线能对细胞造成更强的不可逆伤害。
对放射免疫药物的制备过程来说,放化产率和放化纯度的分析必不可少。Lindegren等[24]将高效液相色谱(HPLC)和NaI(Tl)探测器联合起来,以211At为分析对象,在线量化分析放化产率和放化纯度。该装置的主要优点是操作简单、速度快和精度高,特别是对短半衰期放射性核素来说,这种组合型分析系统的出现将十分有利于放射免疫药物研究工作的开展。
在α核素放射免疫药物的研究进程中,如何提高标记率一直困扰着研究人员。美国华盛顿大学的Wilbur研究了各种用于211At标记的偶联剂来提高标记率和靶向药物在体内的稳定性[19-20]。本课题组尝试用巢状碳硼烷化合物TCP为双功能偶联剂通过B—At键实现了牛血清蛋白(BSA)的211At标记(其标记偶联路线示于图2),并与以偶联剂N-琥珀酰亚胺-3-三正丁基锡-苯甲酸酯(ATE)、5-(三正丁基锡)-3-吡啶甲酸-N-琥珀酰亚胺酯(SPC)为中间体进行的211At标记的BSA进行对比。结果表明,以TCP为双功能偶联剂的标记时间短、标记率有所提高,且所得的标记物在小鼠甲状腺的放射性摄取最低、体内稳定性最高,适合于小分子蛋白及多肽的标记[25]。本课题组还以双功能偶联剂SPC为中间体将211At和二膦酸盐类化合物相结合得到标记物211At-SAPC-ABP,其在体内外具有较高的稳定性且标记物对小鼠骨骼也具有明显的亲和性[18]。
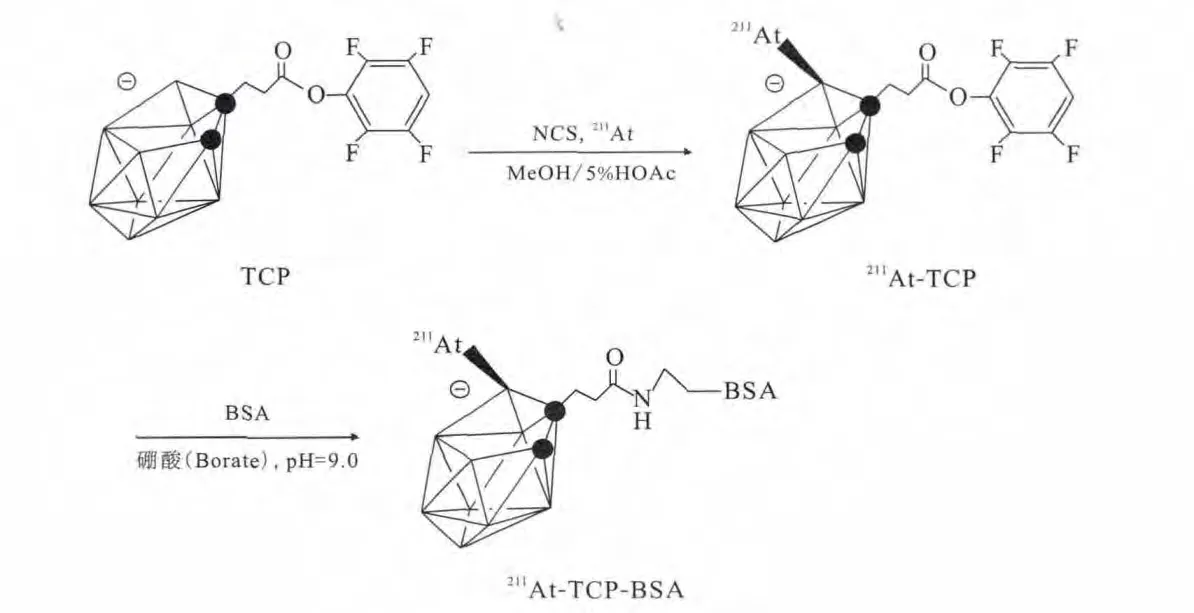
图2 TCP标记偶联路线图[25]Fig.2 Radioastatination scheme of BSA using TCP as linker[25]
在高剂量下,标记率一直难以提高,有学者认为这是由于高剂量下211At发射的α粒子引起的中间体辐射分解而造成的结果。211At衰变放出α粒子时,母核会受到一个反冲的作用力,这个作用力大于211At与偶联剂之间的键能。如果211At与质量较大的物质相连,那么这个反冲速度减小,反冲能量也就显得微乎其微了。近期本课题组拟改变标记与偶联的顺序,先偶联再对偶联物进行标记,希望可以降低标记过程中的辐解效应提高标记率。
放射免疫药物的高效靶向性是研究人员所一直追求的,在杀死肿瘤细胞的过程中都希望能尽量少伤害正常细胞,对各器官的毒性要降到最低,但大多数实验的生物分布数据都有待完善。Gothenburg大学有课题组致力于研究预定位靶向治疗,希望能将放射性药物更大程度的载带到肿瘤部位。目前的实验数据显示预定位靶向治疗与靶向治疗有同样的疗效,同时预定位靶向治疗可以降低肝/肾脏的毒性[26]。
211At放射免疫药物的临床前研究除了单独考察该药物的疗效外,还联合其他肿瘤治疗方式对疗效进行评价。有研究人员将曲妥珠单抗与211At标记的曲妥珠单抗联合使用在卵巢癌裸鼠模型上,先注射400kBq211At标记的曲妥珠单抗,7d后再分别注射5、50、500μg的曲妥珠单抗。其中50μg组的肿瘤质量比5μg组减少78%,500μg组的裸鼠肿瘤已被治愈[27]。华盛顿大学的Orozco等[28]在裸鼠急性髓性白血病模型中将造血干细胞移植与211At-anti-CD45靶向药物联合使用,有效地延长了裸鼠的存活时间。注射0、444、740、888kBq剂量的裸鼠存活期分别为37、61、101、123d。造血干细胞移植两周后白细胞最低计数大于2 000/μL,使毒性降到了最低。
Zalutsky等[29]进行的临床Ⅱ期试验中,18个脑肿瘤复发患者在手术切除创建空腔内注射211At-ch81C6,随后接受补救性化疗。对治疗后的病人连续24h用γ相机观察并做血液学检查,96.7%±3.6%的211At标记药物在空腔内发生衰变,6个病人在6周内出现神经毒性,随后5个病人痊愈,接受治疗的病人中并未出现三级及以上的神经毒性。患多形性成胶质细胞瘤、间变型星型细胞瘤及少突神经胶质瘤的平均存活时间分别为54、52与116周。Andersson等[30]将211At-MX35F(ab)′2用于妇女复发卵巢癌临床Ⅰ期实验中,考察其药代动力学与剂量学指标。9位患者在接受治疗前先做腹腔镜检查,排除肉眼可见肿瘤存在及粘连的情况。通过腹膜透析管给病人灌输含211At-MX35F(ab)′2的透析液,6h内用γ相机与单光子发射计算机断层显像(SPECT)观察,检测病人48h内的血液、尿液及腹水,并连续23个月跟进病人的血液学指标、肾脏与甲状腺功能。实验数据显示腹水中的放射性浓度在24h内下降了50%,45h时血清中的放射性浓度上升6%,甲状腺中的放射性浓度在20h上升127%±63%,而之前对甲状腺有阻塞只上升了20%不到,其他器官无明显摄取,患者也没有出现不良反应。
目前,有关211At标记药物的研究正在如火如荼的进行中,有许多临床前实验有望向临床试验发展。
1.2 212Bi
212Bi可以从228Th天然衰变而得,半衰期较短为60.6min,一般通过224Ra发生器来制备,以弥补因其短半衰期带来的不便。212Bi衰变纲图示于图3,衰变时放出2个α和2个β-粒子,平均衰变能量为7.8MeV,在软组织中的射程为40~100μm。212Bi衰变还会放出2.6MeV的γ射线,因此,患者与医护人员的辐射防护工作将给212Bi的临床应用带来一定的困扰。
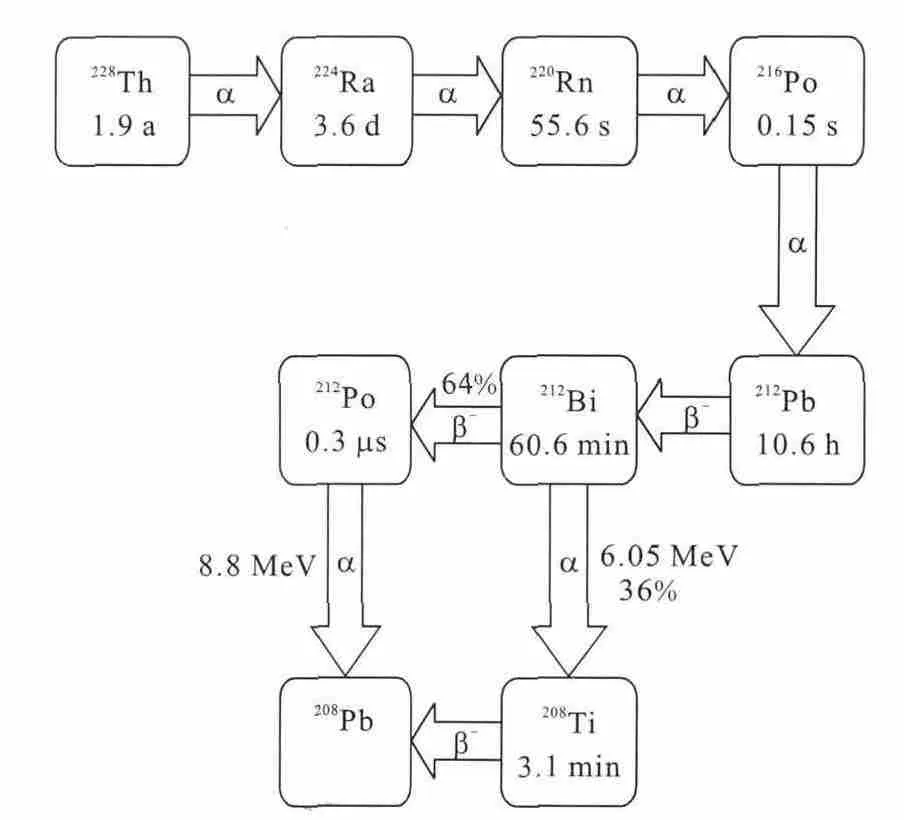
图3 212Bi衰变纲图Fig.3 Decay chain of 212Bi
有关212Bi靶向药物的偶联剂有SCN-Bz-DTPA、CHX-A″-DTPA和Mx-DTPA,实验表明通过CHX-A″-DTPA偶联的靶向药物在体内有最好的稳定性[31]。
20世纪80年代后212Bi放射免疫药物的研究开始受到重视,特别是在淋巴瘤、白血病等肿瘤模型中显示了良好的疗效。然而近年来关于212Bi的研究报道并不多,取而代之的是它的同位素213Bi。
1.3 213Bi
213Bi衰变纲图示于图4,在可用于放射治疗的α核素中,其半衰期最短,只有46min,但213Bi可从225Ac/213Bi发生器制取,也有研究人员将之作为体内发生器用在靶向药物中。与212Bi类似,213Bi靶向药物常用的偶联剂是CHX-A″-DTPA。值得注意的是,由于213Bi衰变时还会放出440keV的γ射线,因此可在治疗过程中进行显像,这将有利于生物分布、药代动力学和剂量学研究工作的开展。
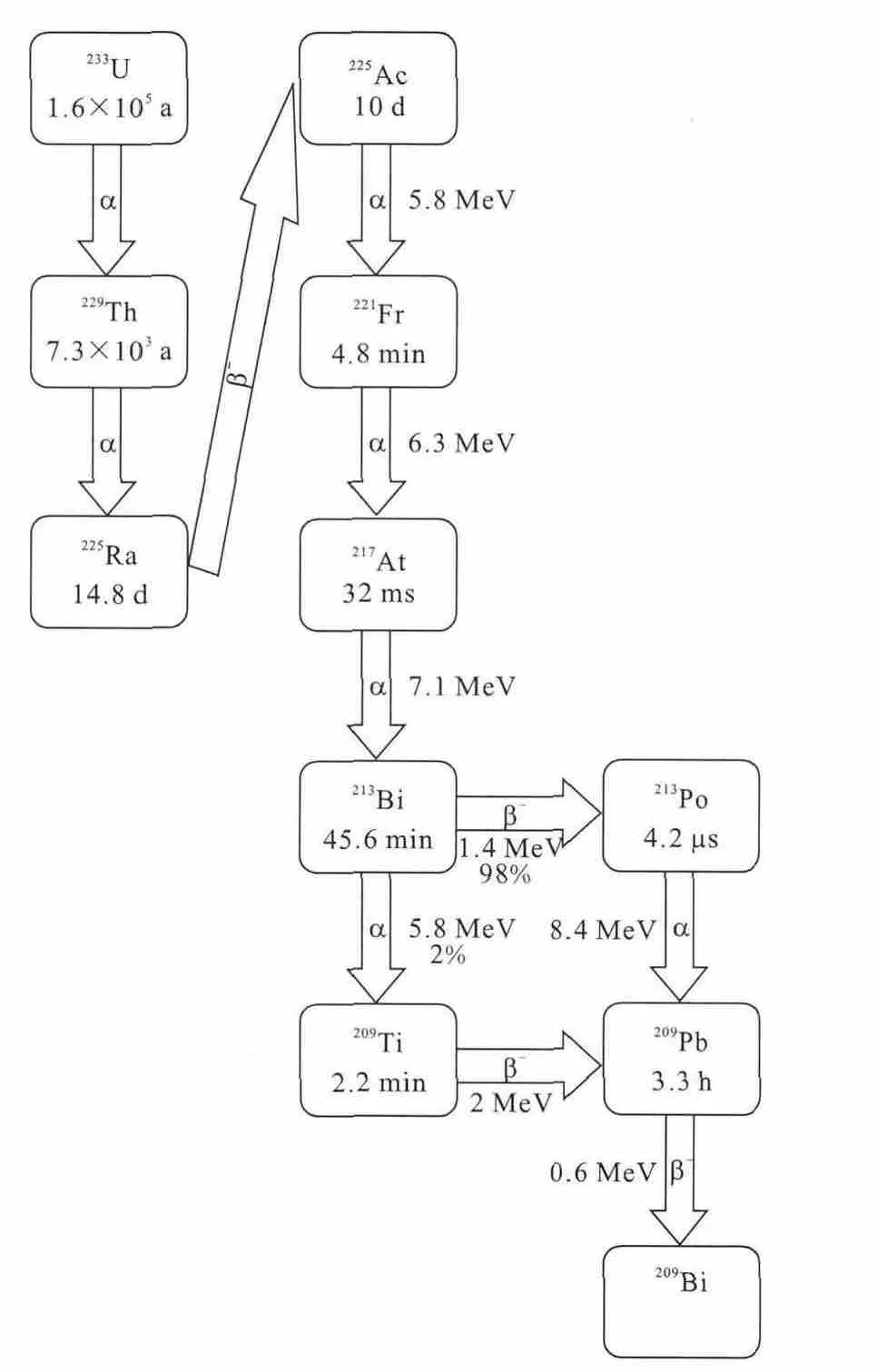
图4 213Bi和225Ac衰变纲图Fig.4 Decay chain of 213Bi and 225Ac
作为α核素,213Bi发出的高能α射线有极强的细胞毒性作用。Wulbrand等[32]考察了213Bianti-EGFR-MAb对乏氧细胞和正常含氧细胞的杀伤力,结果表明α粒子可以杀死β和γ粒子不能杀死的乏氧细胞。Wild等[33]用人前列腺癌裸鼠模型比较了α核素213Bi和β核素177Lu标记药物的疗效,特别是比较了177Lu-DOTA-PESIN、213Bi-DOTA-PESIN和213Bi-AMBA三 种 靶 向 药物的最大耐受量、生物分布和剂量学。对照组不做处理或者用175Lu-DOTA-PESIN处理,实验表明,213Bi-DOTA-PESIN和213Bi-AMBA的最大耐受量是25MBq而177Lu-DOTA-PESIN的最大耐受量是112MBq,213Bi-DOTA-PESIN组的裸鼠存活时间大于15周,比177Lu-DOTA-PESIN组的5倍还长。Chérel等[34]用小鼠多发性骨髓瘤模型研究了213Bi标记抗mCD138的疗效,3.7MBq和7.4MBq的剂量能明显延长小鼠的存活时间。此外,213Bi靶向药物还在膀胱癌、乳腺癌和前列腺癌转移等肿瘤中有临床前研究。
Gouard等[35]用裸鼠多发性骨髓瘤模型比较了传统的美法仑化疗法和213Bi标记药物的放射免疫疗法的疗效。空白对照组有一半裸鼠在接种骨髓瘤细胞63d后死亡,美法仑化疗组并未见痊愈,只有使用200μg美法仑的裸鼠存活时间有延长。在骨髓癌细胞接种22d后用213Bi标记抗CD138抗体的放射免疫治疗组有60%的存活率,在肿瘤细胞接种25d后再进行放射免疫治疗则没有疗效,可见α核素靶向治疗适合于治疗小体积的肿瘤。遗憾的是美法仑化疗和213Bi标记药物靶向治疗联合起来也并没有提高存活率。Milenic等[36]将213Bi-DTPA-F3与紫杉醇联合起来用于裸鼠腹膜转移癌模型中,联合用药对细胞的毒性作用增强,同时联合用药也比单独用药更有效地延长了裸鼠的存活时间。
213Bi靶向药物治疗神经胶质瘤的临床Ⅰ期实验用213Bi-DOTA-substance P治疗精确定位的Ⅱ—Ⅳ期的5位患者,再用系列的SPECT/电子计算机断层扫描(CT)、核磁和血液学检查来跟进治疗情况,临床数据显示α核素213Bi靶向药物跟β核素靶向药物有相同的疗效而且α核素对周围正常组织的损伤小,初期临床试验证明了213Bi-DOTA-substance P治疗神经胶质瘤是很有希望的[37]。
213Bi靶向药物在治疗白血病上有可喜的进展。213Bi标记林妥珠单抗的临床Ⅰ期实验证明该靶向药物安全可行。在213Bi标记林妥珠单抗的临床Ⅰ/Ⅱ期实验中,31个急性髓性白血病患者接受了治疗。连续给药阿糖胞苷5d后,使局部癌细胞数目减少,再给病人于1~2d内分次注射从18.5~46.25MBq/kg213Bi标记的林妥珠单抗,所有的剂量均能有效的降低骨髓萎缩,临床数据显示人体内最大承受剂量可达37MBq/kg,在用213Bi靶向药物治疗前,通过化疗药物使癌细胞数目减少是必要的,也就是说α核素靶向治疗对小体积肿瘤有效[38]。
1.4 225Ac
225Ac衰变纲图示于图4,在可用于放射治疗的α核素中[6],其半衰期仅次于223Ra,为10.0d,因此有希望制成药盒用于边远地区。225Ac由长寿命的229Th(T1/2=7 430a)衰变而来,7 430a的半衰期可使229Th成为225Ac永久的母体源。225Ac是用于靶向治疗中非常有潜力的核素之一,尤其是将225Ac作为213Bi的母体核素吸附到脂质体上制成225Ac-213Bi的体内发生器[39]。由于225Ac衰变可产生6个子体核素,每次衰变可以放出4个α粒子,因而较其它α核素的细胞毒性更强[40]。但其α核素衰变子体能否也在肿瘤组织中很好地浓集,而不分散到肿瘤组织外对正常组织造成损伤,则成为225Ac研究中必须要考虑的重要问题之一。
225Ac没有稳定的同位素,生产成本高,很大程度上限制了对其化学性质的研究。225Ac靶向药物所用的偶联剂不仅要稳固的结合225Ac,还要将225Ac衰变的子体也牢牢的结合住。Chappell等[41]研究了一种大环螯合剂1,4,7,10,13,16-六氮杂环十六烷-1,4,7,10,13,16-六乙酸(HEHA)来偶联α核素与单克隆抗体,其与225Ac的粒子半径很匹配,然而,HEHA与225Ac衰变子体的结合能力并不理想,会使衰变子体分布到肿瘤组织外。Sofou等[42]用DOTA来做偶联剂,将225Ac制成纳米体内发生器,以提高其衰变子体在肿瘤组织的保留率。起初研究人员用脂质体封装225Ac,让它的子体保留在病灶,可因为225Ac大多结合在磷脂膜表面,实际上只有14%的子体是聚集在癌组织内,之后又研究出一种多囊泡脂质体(MUVEL),可以保留98%(质量分数)的225Ac、31%225Ac的子体。
Bandekar等[43]用脂质体装载225Ac,评估其对前列腺特异膜抗原的杀伤力。聚乙二醇化的脂质体装载着225Ac,再分别连上J591抗体和A10适配体,考察其对表达PSMA的前列腺癌细胞单分子膜和诱导表达PSMA的HUVEC单分子膜靶向选择性、内在化程度和杀伤力。标记的J591抗体比标记的A10适配体显示更高水平的结合能力,细胞毒性研究表明,标记的J591抗体的细胞毒性与半致死剂量值最大。装有225Ac的抗PSMA靶向脂质体能选择性结合,并杀死PSMA表达细胞,包括诱导表达PSMA内皮细胞。这些发现结合脂质体的独特能力,可以容易地调整脂质体的大小和表面性能,用于优化生物分布,推进α核素靶向药物的研究。
用225Ac标记的E4G10在裸鼠前列腺癌和结肠癌模型中均能有效地抑制肿瘤的增长延长裸鼠的存活时间。Song等[44]用225Ac标记的抗鼠HER-2抗体治疗裸鼠乳腺癌转移,彻底根除肺转移达67%,使裸鼠生存时间延长1a,比213Bi标记的抗体61d的存活时间和90Y标记的抗体50d的存活时间有明显的优势。但生物分布分析结果显示,接受225Ac治疗后其子体核素聚集在肾脏,给肾脏造成了长期的毒性作用。Essler等[45]比较了225Ac与213Bi标记多肽对小鼠腹膜转移癌的疗效,在接种肿瘤细胞后对照组的存活时间为60d,接受6×1.85kBq225Ac-DOTA-F3治疗组和6×1.85MBq213Bi-DTPA-F3组小鼠的存活时间分别为95、97d。225Ac和213Bi标记的靶向药物均能有效的延长裸鼠的存活时间,且对肾脏的毒性在可以承受的范围内。225Ac-HuM195在食蟹猴实验中显示了良好的药代动力学、剂量学和毒性作用。Jurcic等[46]进行了225Ac-HuM195的临床Ⅰ期试验,18位患者接受了18.5~148kBq/kg剂量的药物,111kBq/kg和148kBq/kg剂量组分别有1名和2名患者出现剂量毒性,有10位患者的外周血癌细胞被清除,骨髓癌细胞减少33%甚至更多。
1.5 223 Ra
镭在元素周期表中属于碱土金属,223Ra与钙同族,具有良好的亲骨性,可以模拟钙与羟基磷灰石形成复合物,加快骨质更新。223Ra可以通过227Ac/223Ra发生器制得,半衰期为11.43d,为生产和应用之间提供了足够的时间进行运输,较长的半衰期也可以使223Ra在大量衰变前就从软组织中清除,降低软组织的吸收剂量。223Ra发出的α粒子平均能量为5.78MeV,其高的LET值可以打断DNA双链,杀死癌细胞。
223Ra的临床前实验表明,223Ra具有良好的亲骨性,其衰变子体也没有明显的再分配,为223Ra的临床研究奠定了基础。二氯化镭(223RaCl2)初期的临床Ⅰ期实验单次注射46~250kBq/kg剂量的药物,显示了良好的生物学效应,且没有剂量限制性毒性,后期的临床试验主要选择分次给药,Parker等[47]进行的临床Ⅲ期实验,治疗的病人达上千人,每4周给病人注射一次50kBq/kg剂量的药物,共注射6次,接受223Ra治疗的患者比接受安慰剂治疗的患者存活时间延长了3.6个月,显著的延迟了骨骼病变的发生,改善了患者的生存质量。Lassmann等[48]还考察了氯化镭在人体各正常器官的剂量学指标,将有助于比较各种治疗方式和评估器官的吸收剂量,并制定病人的用药剂量,为该药物在临床上的应用提供了有价值的参考。基于上述Ⅰ/Ⅱ/Ⅲ期临床试验,223Ra是第一个经FDA及EMA批准用于临床治疗的α核素,223RaCl2注射液用于治疗伴有骨转移症状但无内脏转移的去势抵抗性前列腺癌,商品名为Xofigo。
1.6 其它α治疗核素
255Fm也是具有医学应用潜力的α核素之一。20.1h的半衰期、63μm的射程和7.020MeV的α粒子能量对于放射免疫治疗非常有利。149Tb衰变既放出3.97MeV的α粒子,还放出165keV能量的γ射线。因此可如213Bi一样,在治疗过程中同时进行显像,但其半衰期较短(4h),对加速器有依赖性。227Th半衰期18.7h,有研究人员将其作为223Ra的体内发生器[6]。
2 α治疗核素面临的问题和前景
α核素靶向药物的研究在过去的几十年中有了长足的发展。由最初的核素性质、制备研究和药物标记方法的研究,到现在提高放化产量和标记率,生物分布、药代动力学、剂量学研究等,甚至有些核素已进入了临床试验,并取得了初步的成效,如223Ra和213Bi的治疗药物,特别是223RaCl2(Xofigo)获得FDA的批文及在临床上的应用,为α核素放射免疫药物的发展开辟了广阔的空间。
但就目前的研究结果来看,大部分α治疗核素还停留在临床前实验阶段。其存在的问题主要表现在以下几个方面。
(1)α核素的来源。大部分能用于靶向治疗的高核纯α核素生产成本高,生产方式有限,限制了大量系统实验的开展。为此要对加速器生产核素的条件进行优化,摸索出能大批量生产所需核素的条件。
(2)标记方法的完善。标记方法需要进一步完善来提高标记率,合适偶联剂与标记路线的选择有望将靶向药物从小规模的实验室生产发展成免疫试剂药盒的形式给临床应用带来便利。
(3)靶向性的提高。α核素的性质使其标记药物在体内外必须具有足够的稳定性并要快速的浓集在肿瘤部位,提高靶/非靶比,因此特异性载体的研究还有待完善。
(4)核素靶向药物剂量学研究有待加强。α治疗核素要用于临床,对各器官必须制定一个合理的剂量指标来指导合理用药,减少毒副作用,正确评价药物疗效和安全性。
随着研究工作的不断深入,α治疗核素的放射性药物的研究和应用前景定会更加光明。
[1]Kitson S L,Cuccurullo V,Moody T S,et al.Radionuclide antibody-conjugates,a targeted therapy towards cancer[J].Curr Radiopharm,2013,6(2):57-71.
[2]Hoff P.NATO advanced research workshop on techniques and selected applications of nuclear physics,Krzyze.Poland,SEP 02-04,1999[C].Krakow,Poland:Acta Physica Polonica B,2000,31(1):33-46.
[3]Allen B J,Blagojevic N.Alpha-and beta-emitting radiolanthanides in targeted cancer therapy:the potential role of terbium-149[J].Nucl Med Comm,1996,17(1):40-47.
[4]Lyckesvärd M N,Delle U,Kahu H,et al.Alpha particle induced DNA damage and repair in normal cultured thyrocytes of different proliferation status[J].Mutat Res,2014,765:48-56.
[5]Durbin P W,Asling C W,John M E,et al.The induction of tumors in the rat by astatine-211[J].Radiat Res,1958,9(3):378-397.
[6]昝亮彪,刘宁,杨远友,等.α核素用于肿瘤靶向治疗研究的进展[J].核技术,2006,29(4):279-285.
[7]Imam S K.Advancements in cancer therapy with alpha-emitters:a review[J].Int J Radiat Oncol,2001,51(1):271-278.
[8]Kim G,Chun K,Park S H,et al.Production of alpha-particle emitting At-211using 45MeV alphabeam[J].Phys Med Biol,2014,59(11):2849-2860.
[9]Larsen R H,Wieland B W,Zalutsky M R.Evaluation of an internal cyclotron target for the production of At-211via the Bi-209(alpha,2n)At-211reaction[J].Appl Radiat Isot,1996,47(2):135-143.
[10]Reist C J,Foulon C F,Alston K,et al.Astatine-211labeling of internalizing anti-EGFRvⅢmonoclonal antibody using N-succinimidyl 5-[At-211]astato-3-pyridinecarboxylate[J].Nucl Med Biol,1999,26(4):405-411.
[11]Vaidyanthan G,Affleck D,Zalutsky M R.Monoclonal antibody f(ab′)2fragment labeled with N-succinimidyl 2,4-dimethoxy-3-halobenzoates:in vivo comparison of iodinated and astatinated fragments[J].Nucl Med Biol,1994,21(1):105-110.
[12]Yordanov A T,Garmestani K,Zhang M,et al.Preparation and in vivo evaluation of linkers for At-211labeling of humanized anti-Tac[J].Nucl Med Biol,2001,28(7):845-856.
[13]Liu N,Jin J N,Mo S W,et al.Prepartion and preliminary evaluation of astatine-211labeled IgG via DTPA anhydride[J].J Radioanal Nucl Chem,1998,227(1-2):187-190.
[14]Liu N,Jin J N,Zhang S Y,et al.Astatine-211labeling of a monoclonal antibody and its Fab fragment:synthesis,immunoreactivity and experimental therapy[J].J Lab Comp Radiopharm,1995,36(11):1105-1113.
[15]Liu B L,Jin Y T,Liu Z H,et al.Halogen exchanges using crown ethers:synthesis and preliminary is distribution of 6-(211At)-astato-methyl-19-norcholest-5(10)-en-3β2-ol[J].Int J Appl Radiat Isot,1985,36(7):561-563.
[16]Lin H,Jing J,Xu Y Y.Effect of different cell cluster models on the radiobiological output for211Atradioimmunotherapy[J].Cancer Biother Radiopharm,2011,26(1):85-95.
[17]Liu N,Yang Y Y,Zan L B,et al.Astatine-211labeling of insulin:synthesis and preliminary evaluation in vivo and in vitro[J].J Radioanal Nucl Chem,2007,272(1):85-90.
[18]Yang Y Y,Liu N,Zan L B,et al.Preparation and preliminary evaluation of211At labeled amidobisphophonates[J].J Radioanal Nucl Chem,2010,283(2):329-335.
[19]Wilbur D S,Chyan M K,Nakamae H,et al.Reagents for astatination of biomolecules 6:an intact antibody conjugated with a maleimido-closo-decaborate(2-)reagent via sulfhydryl groups had considerably higher kidney concentrations than the same antibody conjugated with an isothiocyanato-closodecaborate(2-)reagent via lysine amines[J].Bioconj Chem,2012,23(3):409-420.
[20]Wilbur D S,Chyan M K,Hamlin D K,et al.Reagents for astatination of biomolecules 5:evaluation of hydrazone linkers in At-211-and I-125-labeled closo-decaborate(2-)conjugates of Fab′as a means of decreasing kidney retention[J].Bioconj Chem,2011,22(6):1089-1102.
[21]Palm S,Back T,Claesson I,et al.Therapeutic efficacy of astatine-211-labeled trastuzumab on radioresistant SKOV-3tumors in nude mice[J].Int J Radiat Oncol,2007,69(2):572-579.
[22]Chen J,Zhang M L,Ju W,et al.Effective treatment of a murine model of adult T-cell leukemia using depsipeptide and its combination with unmodified daclizumab directed toward CD25[J].Blood,2009,113(6):1287-1293.
[23]Nestor M,Sundstroem M,Anniko M,et al.Effect of cetuximab in combination with alpha-radioimmunotherapy in cultured squamous cell carcinomas[J].Nucl Med Biol,2011,38(1):103-112.
[24]Lindegren S,Jensen H,Jacobsson L.A radio-highperformance liquid chromatography dual-flow cell gamma-detection system for on-line radiochemical purity and labeling efficiency determination[J].J Chromatogy,2014,1337:128-132.
[25]Yang Y Y,Lin R S,Liu N,et al.Astatine-211 labeling of protein using TCP as a bi-functional linker:synthesis and preliminary evaluation in vivo and in vitro[J].J Radioanal Nucl Chem,2011,288(1):71-77.
[26]Frost S H,Bäck T,Chouin N,et al.Comparison of At-211-prit and At-211-rit of ovarian microtumors in a nude mouse model[J].Cancer Biother Radio,2013,28(2):108-114.
[27]Palm S,Bäck T,Claesson I,et al.Therapeutic efficacy of astatine-211-labeled trastuzumab on radioresistant SKOV-3tumors in nude mice[J].Int J Radiat Oncol,2007,69(2):572-579.
[28]Orozco J J,Baeck T,Kenoyer A,et al.Anti-CD45 radioimmunotherapy using At-211with bone marrow transplantation prolongs survival in a disseminated murine leukemia model[J].Blood,2013,121(18):3759-3767.
[29]Zalutsky M R,Reardon D A,Akabani G,et al.Clinical experience with alpha-particle-emitting At-211:treatment of recurrent brain tumor patients with At-211-labeled chimeric antitenascin monoclonal antibody 81C6[J].J Nucl Med,2008,49(1):30-38.
[30]Andersson H,Cederkrantz E,Bäck T.Intraperitoneal alpha-particle radioimmunotherapy of ovarian cancer patients:pharmacokinetics and dosimetry of(211)At-MX35-F(ab′)(2)-A phaseⅠstudy[J].J Nucl Med,2009,50(7):1153-1160.
[31]Montavon G,Le D A,Champion J,et al.DTPA complexation of bismuth in human blood serum[J].Dalton T,2012,41(28):8615-8623.
[32]Wulbrand C,Seidl C,Gaertner F C,et al.Alphaparticle emitting Bi-213-anti-EGFR immunoconjugates eradicate tumor cells independent of oxygenation[J].Plos One,2013,8(5):e64730.
[33]Wild D,Frischknecht M,Zhang H W,et al.Alpha-versus beta-particle radiopeptide therapy in a human prostate cancer model(Bi-213-DOTAPESIN and Bi-213-AMBA versus Lu-177-DOTAPESIN)[J].Cancer Res,2011,71(3):1009-1018.
[34]Chérel M,Gouard S,Gaschet J,et al.Bi-213radioimmunotherapy with an anti-mCD138monoclonal antibody in a murine model of multiple myeloma[J].J Nucl Med,2013,54(9):1597-1604.
[35]Gouard S,Pallardy A,Gaschet J,et al.Comparative analysis of multiple myeloma treatment by CD138antigen targeting with bismuth-213and Melphalan chemotherapy[J].Nucl Med Biol,2014,41(Suppl):e30-5.
[36]Milenic D E,Garmestani K,Brady E D,et al.Multimodality therapy:potentiation of high linear energy transfer radiation with paclitaxel for the treatment of disseminated peritoneal disease[J].Clin Cancer Res,2008,14(16):5108-5115.
[37]Cordier D,Forrer F,Bruchertseifer F,et al.Targeted alpha-radionuclide therapy of functionally critically located gliomas with Bi-213-DOTA-[Thi(8),Met(O-2)(11)]-substance P:apilot trial[J].Eur J Nucl Med Mol I,2010,37(7):1335-1344.
[38]Rosenblat T L,McDevitt M R,Mulford D A,et al.Sequential cytarabine and alpha-particle immunotherapy with bismuth-213-lintuzumab(HuM195)for acute myeloid leukemia[J].Clin Cancer Res,2010,16(21):5303-5311.
[39]Geerlings M W,Kaspersen F M,Apostolidis C,et al.The feasibility of Ac-225as a source of alphaparticles in radioimmunotherapy[J].Nucl Med Comm,1993,14(2):121-125.
[40]Sofou S,Tomas J L,Lin H Y,et al.Engineered liposomes for potential alpha-particle therapy of metastatic cancer[J].J Nucl Med,2004,45(2):253-260.
[41]Chappell L L,Deal K A,Dadachova E,et al.Synthesis,conjugation,and radiolabeling of a novel bifunctional chelating agent for Ac-225radioimmunotherapy applications[J].Bioconj Chem,2000,11(4):510-519.
[42]Sofou S K,Barry J,Jaggi J S,et al.Enhanced retention of the alpha-particle-emitting daughters of actinium-225by liposome carriers[J].Bioconj Chem,2007,18(6):2061-2067.
[43]Bandekar A,Zhu C,Jindal R,et al.Anti-prostatespecific membrane antigen liposomes loaded with Ac-225for potential targeted antivascular alpha-particle therapy of cancer[J].J Nucl Med,2014,55(1):107-114.
[44]Song H,Hobbs R F,Vajravelu R,et al.Radioimmunotherapy of breast cancer metastases with alphaparticle emitter Ac-225:comparing efficacy with Bi-213and Y-90[J].Cancer Res,2009,69(23):8941-8948.
[45]Essler M,Gäertner F C,Neff F,et al.Therapeutic efficacy and toxicity of Ac-225-labelled vs.Bi-213-labelled tumour-homing peptides in a preclinical mouse model of peritoneal carcinomatosis[J].Eur J Nucl Med Mol I,2012,39(4):602-612.
[46]Jurcic J G,Rosenblat T L,McDevitt M R,et al.Alpha-particle immunotherapy for acute myeloid leukemia(AML)with bismuth-213(213Bi)and actinium-225(225Ac)[C]∥8thInternational Symposium on Targeted Alpha Therapy,Oak Ridge,TN USA,2013:14.
[47]Parker C,Nilsson S,Heinrich D,et al.Alpha emitter radium-223and survival in metastatic prostate cancer[J].New Engl J Med,2013,369(3):213-223.
[48]Lassmann M,Nosske D.Dosimetry of Ra-223-chloride:dose to normal organs and tissues[J].Eur J Nucl Med Mol I,2013,40(2):207-212.
