水稻粒形调控基因的研究进展
2015-12-24朱业宝郭玉春梁康迳孙新立
朱业宝,郭玉春,梁康迳,孙新立
(1.福建农林大学作物遗传育种与综合利用教育部重点实验室,福建福州350002;2.福建农业科学院水稻研究所,福建福州350018)
水稻(Oryza sativa L.)是我国三大主要粮食作物之一,其产量和品质对我国粮食安全影响巨大.水稻产量直接受3个因素控制,即穗数、穗粒数和粒重(籽粒大小和充实度).水稻的粒形不仅是粒重的重要因素,而且是重要的品质性状.本文从粒形相关性状的遗传分析、QTL定位及基因克隆和基因作用机理等方面综述了前人研究成果,以期为水稻粒形遗传改良提供依据.
1 数量遗传
水稻粒重受粒长、粒宽、粒厚和充实度的影响,均属于数量性状,受多基因控制.多基因在染色体上的位置称为数量性状基因座(Quantitative Trait Loci,QTL)[1].许多重要的农艺性状被多基因共同控制,而且受环境影响较大.其中,1个或多个基因的作用较大,称这些基因为主效基因,也是研究的重点.
粒重属于复合性状,为使研究简化,一般将其分解为受基因直接控制的几个组成因素.本文重点阐述其构成因素(粒长、粒宽和粒厚)的遗传规律(表 1)[2,3].不同品种间粒长变异较大(6 -15 mm)[2],粒宽和粒厚的变异较小.
2 QTL定位及其相关基因的克隆
随着分子生物学的发展,全基因组测序的完成,作为模式植物之一的水稻,有约1.8万个容易操作、重复性好、共显性的简单序列重复标记(Simple Sequence Repeat,SSR)可以使用.另外,除粳稻Nipponbare序列外(http://rapdb.dna.affrc.go.jp/),水稻中还有籼稻 93 -11(http://rise.genomics.org.cn/rice/index2.jsp)、野生稻W943的全基因组序列以及2000份栽培稻和普通野生稻超过7×106个单核苷酸多态性(Single Nucleotide Polymorphisms,SNP)可以利用(http://ricevarmap.ncpgr.cn/django/home/)[4].同时,搜索NCBI(http://www.ncbi.nlm.nih.gov/)、EBI(http://www.ebi.ac.uk/)、RAP-DB(http://rapdb.dna.affrc.go.jp/)和Gramene(http://www.gramene.org/)等相关网站,还会获取更多相关资源.这些为水稻粒形QTL分析、重要基因克隆和功能分析奠定了基础.
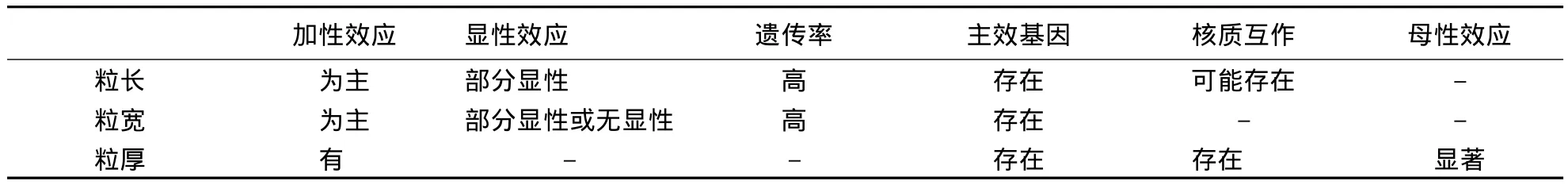
表1 水稻粒形基因的遗传效应1)Table 1 Genetic effects of rice grain shape genes
2.1 已定位的调控水稻粒形QTL
对于数量性状位点的研究不同于质量性状,需将控制数量性状的位点分解成单个QTL.目前,已定位了大量控制水稻粒长和粒宽的QTL,但控制粒厚的QTL的较少.有研究已定位了超过400个QTL涉及水稻粒形和粒重,其中控制粒长的QTL有102个,粒宽的QTL有93个[2].Gramene网站(ftp://ftp.gramene.org/pub/gramene/CURRENT_RELEASE/data/qtl/)收录了控制粒长的QTL有24个,粒宽的QTL有31个(表2).结果差异较大,除所引用论文的差异外,不同实验所定位的QTL难以比较是重要的原因.这些研究或搜索引擎仅对论文中所定位的QTL进行简单的相加,不做进一步分析,这样存在大量的重复,即同一个QTL为不同作者在不同试验中的重复检测[2,5].
2.2 已克隆的水稻粒形调控基因
虽然粒形性状是由多基因控制,但调控粒形的每一个基因,尤其是主效基因,表现出典型的孟德尔遗传现象.这样可通过连续回交筛选,只保留一个调控粒形的主效基因杂合,获取BCnF1种子,建立BCnF2的大群体,进而将目标QTL进行精细定位,最终克隆调控粒形性状的QTL.这是图位克隆数量性状的常用方法.目前,采用该策略,至少已经克隆了8个粒形相关的QTL(表3).

?
实际上,除8个粒形相关QTL外,还有其它的一些基因,影响粒形性状.Huang et al[2]将这些基因分成三类,第一类基因包括D1、D2、D11和D61(表3).这些基因突变使籽粒变短,植株变矮,叶倾角变小.D1基因编码G蛋白的α亚基,该基因的突变同时影响GA和油菜素内酯信号(Brassinosteroid,BR)2条传导途径[6,7].目前,已经发现的多个D1突变体,多是因为插入或缺失造成[8].D2和D11编码细胞色素P450氧化还原酶,涉及 BR 的合成[9,10].D61 编码 BR 受体蛋白[11].最近,Duan et al[12]发现一个新的突变体—smg1,引起籽粒变短、植株变矮和叶片直立.SMG1编码MAPK4,调控细胞的增殖.该基因的突变影响BR信号传导途径.第二类基因主要影响水稻的粒形性状,在穗粒部位表达较强.GS3是影响粒形性状的主效基因之一,这一基因对籽粒的大小(粒长、粒宽、粒厚,以下相同)负调控作用(表3).该基因首先在明恢63和川7杂交群体中被精细定位,编码一个未知功能的跨膜蛋白,包含4个构域,从氨基端到羧基端分别为OSR-TM-TNFR-VWFC(organ size regulation-transmembrane region-tumor necrosis factor receptor-von Willebrand factor type C).OSR结构域缺失,粒形变长;VWFC结构域缺失,粒形变短;二者同时缺失,粒形变长[14,15].另一个对粒长影响较大的基因qGL3/GL3.1,同时被2实验室分别克隆.该基因编码带有Kelch-like repeat结构域的磷酸酯酶.长粒中一个位点C到A的突变,造成Kelch结构域中AVLDT基序的改变(Asp→Glu或者D→E),从而使粒形变长[16,17].目前,已经克隆的调控粒宽的基因有 5个—GW2、GW5/qSW5、GW8、GS5和 GS6.GW2编码RING型E3泛素连接酶,首先在大粒水稻WY3和小粒丰矮占1号杂交组合中定位.这一基因1 bp的缺失造成了大粒WY3中基因的移码突变.GW2通过蛋白酶体对细胞分裂起着负调控作用,该基因的突变,造成其靶向蛋白的积累,加速了细胞分裂,增加了籽粒的粒宽和重量[18].GW5/qSW5被两个实验室同时克隆的粒宽基因,这一基因编码一个位于细胞核中144个氨基酸的蛋白质,该蛋白带有一个富含精氨酸的结构域.由于此蛋白能与多聚泛素互作,推测可能通过泛素—蛋白酶体途径调控细胞的分裂[19,20].GW8通过Basmati385和HJX74杂交组合定位发现,编码SQUAMOSA启动子结合蛋白,属于SBP转录因子家族,可简写为OsSPL16.不同于前面谈到的基因,该基因的突变发生在基因的启动子区,启动子中10 bp的碱基缺失造成Basmati 385中基因表达降低,籽粒变窄.然而,OsSPL16基因表达的降低,同时提高了米粒的品质[21].GS5基因是主要调控粒宽的QTL,同时影响籽粒的灌浆和粒重.它编码一个丝氨酸羧肽酶,对籽粒的粒形有正调控作用[22].GS6编码含GRAS结构域的蛋白质,348位点的G到A的突变致使蛋白质早熟,籽粒变宽.该基因可能是看家基因,几乎在所有的组织中都表达,没有差异[23].GIF1基因的突变造成籽粒灌浆缺陷,突变体籽粒中由于大量疏松淀粉颗粒存在,垩白区很大.该基因编码一种细胞壁转化酶,因1 bp的缺失造成移码突变,蛋白质的早熟[24,25].
第三类基因的突变有些类似于第一类基因所产生的性状,主要发现于粳稻中,产生小而圆的粒形(表3).这些基因的突变缩短了籽粒的长度,增加了籽粒的宽度.同样,这些基因也会影响植株的株高,突变体植株与野生型相比,每一节间都有一定程度的缩短,而第一类基因突变体尤其会造成某一节间的严重缩短.这类基因目前有SRS1、SRS3和SRS5.SRS1编码含有1365氨基酸的未知功能蛋白质,它的突变会造成种子纵向生长细胞变短变少,横向生长变长[26,27].SRS3编码含有813个氨基酸的蛋白质,含有Kinesin结构域和Coiled-coil结构,该基因的突变造成纵向生长细胞变短.SRS3基因不仅在穗粒中表达,而且在叶片和节间中表达.其中,在节间表达最强[28].SRS5编码α-tubulin蛋白质.点突变引起SRS5中第308位的精氨酸变成亮氨酸,基因突变后同样造成纵向生长细胞变短,它与BR信号传导途径无关[29].
除上面谈到的3类基因外,最近发现PGL1基因过量表达和APG基因沉默都能增加籽粒的长度.PGL1基因都编码非典型的bHLH(碱性螺旋—环—螺旋蛋白)转录因子,该因子缺乏与DNA结合的结构域,通过与其互作的蛋白质APG调控基因表达,二者表现出拮抗作用.APG是细胞伸长负向调控因子,其功能受PGL1抑制[30].Bsg1/Th1基因编码含有DUF640结构域的未知功能蛋白,该基因的突变会形成纺锤形籽粒,内外颖的外层薄壁细胞层中细胞数目减少且变小.该基因主要在穗粒和正在生长的茎中表达,而且,突变体中与细胞分裂相关的基因和GW2表达不同于野生型[31-33].An-1编码bHLH蛋白质,超量表达增加籽粒的长度,抑制或失活该基因能降低籽粒和芒的长度,增加着粒密度.此外该基因是由野生稻到栽培稻重要的驯化位点[34].另外,SERF1编码盐响应的转录因子,该因子能直接与RPBF基因的启动子结合,调控该基因的表达.RPBF调控籽粒的灌浆.SERF1基因的失活,籽粒变大;超表达,籽粒变小[35].Zhang et al[36]研究表明,超表达microRNA-OsmiR397,能提高25%的产量,增加籽粒的大小.
3 水稻粒形调控基因的作用机理
水稻粒形调控基因的克隆为籽粒形成分子机制的研究提供了依据,这些基因对粒形的调控一般是通过影响细胞的分裂或大小.第一类基因主要通过BR信号传导途径调控相关组织细胞的数目和长度.虽然已有一些基因克隆,不同作者基于其克隆的基因,对其分子机制也作了一些研究.但总的来说,还是了解较少.GS3被认为是细胞分裂的负调控因子,其不同结构域间存在功能差异,其中OSR是主要的负调控区[15,37].GL3.1能加速细胞的分裂,它直接和 CyclinT1;3 互作,去除该蛋白的磷酸化.GL3.1 的突变,CyclinT1;3磷酸化水平升高,籽粒变长;抑制CyclinT1;3基因的表达,籽粒变短[17].GS5能影响细胞周期调控基因的表达,GS5基因表达的上升或降低,同样伴随着这些细胞周期相关基因CYCT1、CAK1、CAK1A、CDKA1和H1表达的上升或降低[21].同样,GW8基因的变异同样伴随着细胞周期相关基因的改变[23].
目前,对于已经克隆的粒形基因间的关系研究甚少.但已有的研究表明,一些大粒和长粒材料中含有多个已克隆的第二类基因[16,38].在本研究团队所研究的超大粒材料,已经发现了6个已克隆的第二类基因(未发表),但这些基因间的关系还不清楚.而不同类型的基因间相互关系的研究至今尚未见报道.
4 水稻粒形基因突变体在水稻资源内的分布
粒形调控基因在水稻育种中具有广泛的用途,了解突变体在现有水稻资源中的分布具有重要的意义.本文仅讨论第二类基因的分布.明恢63类型的GS3突变在栽培稻中分布较广泛,Takano-Kai et al[37]对235份栽培稻和284份野生稻的分析表明,34%的栽培稻和4%普通野生稻带有该基因的突变体.其中,这一突变体主要分布在热带粳稻和籼稻中,占栽培稻突变体品种的83%.Mao et al[15]在川7中发现另一种类型的突变体,1 bp缺失造成GS3缺少VWFC结构域,籽粒变得比正常的更短.GW5的突变体主要分布在粳稻和宽粒籼稻中[19,20],而GW8的突变体大多分布在Basmati类型的栽培稻中[23].另一个影响粒宽的基因GS5,通过对35份栽培稻的该基因启动子的分析,仅有8份属于窄粒类型(H94型),均为籼稻;13份中等宽粒(珍汕97型),主要是籼稻(85%);14份宽粒类型(中花11型),主要为粳稻(86%)[21].对于GS6的分析表明,突变体基因主要出现在粳稻中[22].不同于上述的基因,GW2和qGL3属于稀有基因,qGL3在94份测试品种中,仅发现1份[16];而Yan et al[39]对156份籼粳栽培稻筛选发现,未发现含有GW2突变体基因的材料.
5 展望
目前,仅有第二类粒形基因可以直接应用于育种,gs3、gw5和gw8已经为人们有意或无意的应用到育种实践中;而qgl3和gw2属于稀有基因,这2个基因的克隆,必将加快它们在育种中的扩散速度.但是,第一类和第三类基因的应用还需要一些时间.与已经定位的QTL相比,已克隆的第二类粒形调控基因的数量太少,只有8个,而基因克隆是粒形形成分子机制研究的前提,因此,克隆更多的粒形调控QTL是必不可少的过程.另外,已克隆的基因之间的相互关系还多不清楚,已有研究表明,超大粒的形成需要多个调控粒形基因的累积[16,38].这些粒形基因是独立起作用还是有相互的影响,是产生性状累加,或者相反;粒形基因是否影响稻米品质,如何影响等等,这些都是今后有待进一步深入研究的重要内容.此外,随着人们对更多粒形基因的克隆和调控机制的了解,未来育种工作者可以根据需要,设计培育不同粒形、不同大小的品种,真正实现分子设计育种.
[1]吴为人,唐定中,李维明.数量性状的遗传剖析和分子剖析[J].作物学报,2000,26(4):501-507.
[2]HUANG R,JIANG L,ZHENG J,et al.Genetic bases of rice grain shape:so many genes,so little known[J].Trends in Plant Science,2013,18(4):218 -226.
[3]宫李辉,高振宇,马伯军,等.水稻粒形遗传的研究进展[J].植物学报,2011,46(6):597-605.
[4]HUANG X,KURATA N,WEI X,et al.A map of rice genome variation reveals the origin of cultivated rice[J].Nature,2012,490(7421):497 -501.
[5]NI J,PUJAR A,YOUENS-CLARK K,et al.Gramene QTL database:development,content and applications[J].Database:the Journal of Biological Databases and Curation,2009:bap005.
[6]ASHIKARI M,WU J,YANO M,et al.Rice gibberellin-insensitive dwarf mutant gene Dwarf 1 encodes the alpha-subunit of GTP-binding protein[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(18):10284-10289.
[7]WANG L,XU Y Y,MA Q B,et al.Heterotrimeric G protein alpha subunit is involved in rice brassinosteroid response[J].Cell Research,2006,16(12):916 -922.
[8]OKI K,INABA N,KITANO H,et al.Study of novel d1 alleles,defective mutants of the alpha subunit of heterotrimeric G-protein in rice[J].Genes & Genetic Systems,2009,84(1):35 -42.
[9]HONG Z,UEGUCHI-TANAKA M,UMEMURA K,et al.A rice brassinosteroid-deficient mutant,ebisu dwarf(d2),is caused by a loss of function of a new member of cytochrome P450[J].The Plant Cell,2003,15(12):2900 -2910.
[10]TANABE S,ASHIKARI M,FUJIOKA S,et al.A novel cytochrome P450 is implicated in brassinosteroid biosynthesis via the characterization of a rice dwarf mutant,dwarf 11,with reduced seed length[J].The Plant Cell,2005,17(3):776 -790.
[11]YAMAMURO C,IHARA Y,WU X,et al.Loss of function of a rice brassinosteroid insensitive1 homolog prevents internode elongation and bending of the lamina joint[J].The Plant Cell,2000,12(9):1591 - 1606.
[12]DUAN P,RAO Y,ZENG D,et al.SMALL GRAIN 1,which encodes a mitogen-activated protein kinase kinase 4,influences grain size in rice[J].The Plant journal:for Cell and Molecular Biology,2014,77(4):547 -557.
[13]OKI K,INABA N,KITAGAWA K,et al.Function of the alpha subunit of rice heterotrimeric G protein in brassinosteroid signaling[J].Plant& Cell Physiology,2009,50(1):161 -172.
[14]FAN C,XING Y,MAO H,et al.GS3,a major QTL for grain length and weight and minor QTL for grain width and thickness in rice,encodes a putative transmembrane protein[J].Theoretical and Applied Genetics,2006,112(6):1164 -1171.
[15]MAO H,SUN S,YAO J,et al.Linking differential domain functions of the GS3 protein to natural variation of grain size in rice[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(45):19579 - 19584.
[16]ZHANG X,WANG J,HUANG J,et al.Rare allele of OsPPKL1 associated with grain length causes extra-large grain and a significant yield increase in rice[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(52):21534-21539.
[17]QI P,LIN Y S,SONG X J,et al.The novel quantitative trait locus GL3.1 controls rice grain size and yield by regulating Cyclin-T1;3[J].Cell Research,2012,22(12):1666 -1680.
[18]SONG X J,HUANG W,SHI M,et al.A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase[J].Nature Genetics,2007,39(5):623 -630.
[19]WENG J,GU S,WAN X,et al.Isolation and initial characterization of GW5,a major QTL associated with rice grain width and weight[J].Cell Res,2008,18(12):1199 - 1209.
[20]SHOMURA A,IZAWA T,EBANA K,et al.Deletion in a gene associated with grain size increased yields during rice domestication[J].Nature Genetics,2008,40(8):1023 -1028.
[21]WANG S,WU K,YUAN Q,et al.Control of grain size,shape and quality by OsSPL16 in rice[J].Nature Genetics,2012,44(8):950-954.
[22]LI Y,FAN C,XING Y,et al.Natural variation in GS5 plays an important role in regulating grain size and yield in rice[J].Nature Genetics,2011,43(12):1266 -1269.
[23]SUN L,LI X,FU Y,et al.GS6,a member of the GRAS gene family,negatively regulates grain size in rice[J].Journal of Integrative Plant Biology,2013,55(10):938 -949.
[24]WANG E,WANG J,ZHU X,et al.Control of rice grain-filling and yield by a gene with a potential signature of domestication[J].Nature Genetics,2008,40(11):1370 -1374.
[25]WANG E,XU X,ZHANG L,et al.Duplication and independent selection of cell-wall invertase genes GIF1 and OsCIN1 during rice evolution and domestication[J].BMC Evol Biol,2010,10:108.
[26]ABE Y,MIEDA K,ANDO T,et al.The SMALL AND ROUND SEED1(SRS1/DEP2)gene is involved in the regulation of seed size in rice[J].Genes & Genetic Systems,2010,85(5):327 -339.
[27]LI F,LIU W,TANG J,et al.Rice DENSE AND ERECT PANICLE 2 is essential for determining panicle outgrowth and elongation[J].Cell Research,2010,20(7):838 -849.
[28]KITAGAWA K,KURINAMI S,OKI K,et al.A novel kinesin 13 protein regulating rice seed length[J].Plant& Cell Physiology,2010,51(8):1315 -1329.
[29]SEGAMI S,KONO I,ANDO T,et al.Small and round seed 5 gene encodes alphatubulin regulating seed cell elongation in rice[J].Rice,2012,5(4):3 - 10.
[30]HEANG D,SASSA H.Antagonistic actions of HLH/bHLH proteins are involved in grain length and weight in rice[J].PloS One,2012,7(2):e31325.
[31]LI X,SUN L,TAN L,et al.TH1,a DUF640 domain-like gene controls lemma and palea development in rice[J].Plant Molecular Biology,2012,78(4 -5):351 -359.
[32]YAN D,ZHOU Y,YE S,et al.Beak-shaped grain 1/TRIANGULAR HULL 1,a DUF640 gene,is associated with grain shape,size and weight in rice[J].Science China Life Sciences,2013,56(3):275 -283.
[33]MA X D,CHENG Z J,WU F Q,et al.BEAK LIKE SPIKELET1 is required for lateral development of lemma and palea in rice[J].Plant Mol Biol Rep,2013,31(1):98 -108.
[34]LUO J,LIU H,ZHOU T,et al.An-1 encodes a basic helix-loop-helix protein that regulates awn development,grain size,and grain number in rice[J].The Plant Cell,2013,25(9):3360 -3376.
[35]SCHMIDT R,SCHIPPERS J H,MIEULET D,et al.SALT-RESPONSIVE ERF1 is a negative regulator of grain filling and gibberellin-mediated seedling establishment in rice[J].Molecular Plant,2014,7(2):404 -421.
[36]ZHANG Y C,YU Y,WANG C Y,et al.Overexpression of microRNA OsmiR397 improves rice yield by increasing grain size and promoting panicle branching[J].Nature Biotechnology,2013,31(9):848 -852.
[37]TAKANO-KAI N,JIANG H,KUBO T,et al.Evolutionary history of GS3,a gene conferring grain length in rice[J].Genetics,2009,182(4):1323 -1334.
[38]YING J Z,GAO J P,SHAN J X,et al.Dissecting the genetic basis of extremely large grain shape in rice cultivar‘JZ1560’[J].Journal of Genetics and Genomics,2012,39(7):325 -333.
[39]YAN C J,YAN S,YANG Y C,et al.Development of gene-tagged markers for quantitative trait loci underlying rice yield components[J].Euphytica,2009,169(2):215 -226.
