骨替代材料的研究方法及进展
2015-12-24
骨替代材料的研究方法及进展
倪卓1,杨莎1,王应2,刘士德2
1)深圳大学化学与化工学院,深圳518060; 2)深圳大学生命科学学院,深圳518060
摘要:评述了骨替代材料的生物相容性.骨替代材料分为自体骨、异体骨和人工骨替代材料.指出成骨细胞MG-63、成纤维细胞3T3和骨髓瘤细胞U2OS是骨替代材料的主要生物环境,可作为研究骨替代材料生物相容性的常用细胞.骨替代材料生物相容性的评价方法主要有体内生物学研究和体外生物学研究.骨替代材料对所处的体内环境有重要影响,包括对细胞形态和对细胞功能的影响等.根据细胞形态特点(如细胞自溶变化、膜破裂和核聚变),可以判断材料的毒性程度,根据细胞功能(跨膜运输、细胞黏附、细胞增殖、周期、凋亡、氧化应激作用以及调节信号传导),可以判断生物材料的生物相容性.
关键词:生物材料;复合材料;骨替代材料;生物相容性;人工骨材料;修复材料
Received: 2015-03-19; Accepted: 2015-05-08
Foundation: Science and Technology Innovation Project of Guangdong Provincial Educational Department(2013KJCX0163) ; Applied Technology Development Project of Shenzhen University(201223)
Corresponding author: Professor Ni Zhuo.E-mail: royzhuoni@ hotmail.com
生物医用材料一般指用于修复人体组织或器官的材料.从材料技术内涵的发展来看,现代意义上用于临床的生物医用材料大致经历了3个阶段[1].第1阶段: 1960—1980年,生物惰性材料,其特征是在人体环境中保持相对稳定,不易分解,力学强度和理化性质能较好与人体环境匹配,如聚乙烯、碳基材料等.第2阶段: 1980—1990年,生物活性或可降解吸收材料,具有生物活性,材料植入体内可以和所处环境发生良性相互作用,如活性陶瓷和生物玻璃等.第3阶段: 1990年至今,具有生物活性和降解性的组织工程材料,将生物活性和降解吸收结合起来,本身又具有较好的生物活性,在生物体内能被内环境降解,并最终参与机体代谢反应被吸收.近年来,将生物材料与药物结合形成载药生物材料,是该领域新的研究方向之一.
自1862年Jobi Meekren利用犬颅骨为一名颅骨缺失的士兵进行移植修复至今,骨及骨替代移植技术成为临床上治疗骨缺损的重要手段,骨替代材料的应用亦逐渐增加.骨替代材料与生物体相互影响,决定了骨替代材料在人体中的应用能否成功.成骨细胞MG-63(osteoblast)、成纤维细胞3T3(fibroblast)和骨髓瘤细胞U2OS(myeloma)是骨替代材料的主要生物环境.生物材料对生物体的影响表现在细胞形态结构的变化,通过观察细胞形态的变化或数量的增减可以直观地判断材料对细胞的毒性作用.根据细胞在光学显微镜或者电镜中的形态特点(如细胞自溶变化、膜破裂和核聚变),可以判断材料的毒性程度.生物材料对生物体的影响还表现在对细胞功能的影响,包括骨替代材料的跨膜运输、细胞黏附、细胞增殖、周期、凋亡以及调节信号传导[1-3].
1 骨结构
骨骼是一种致密的结缔组织,由不同比例的有机物和无机物组成.从材料学看,骨可以被理解为一种纳米羟基磷灰石颗粒填充胶原基质的复合材料,其构造和综合性能都优于人工合成的纳米羟基磷灰石-胶原复合材料[2-3],因为骨是一种多层次的、复杂的结构体系,骨多级结构由低向高发育成熟,包括编织骨(woven bone)、初级骨(primary bone)和哈佛氏系统(Haversian system),如图1[3].

图1 骨的结构[3]Fig.1 Bone structure[3]
2 骨替代及修复材料
根据骨替代与修复材料的来源和性质,目前临床使用的医用材料包括自体骨、异体骨和人工骨材料.它们各有优缺点,目前还没有一种理想的骨移植替代材料可以完全满足临床需求.它们的特点为:①自体骨.这是目前最接近理想标准的骨替代修复材料.它具有骨传导性、骨诱导性以及成骨性能,同时不存在免疫排斥反应、疾病传播或高医疗费用等问题.这种材料数量有限,不能满足大段骨缺损和各类翻修手术的需要,取骨易发生相关并发症等.②异体骨.包括同种异体骨和异种异体骨.同种异体骨来源于其他人的骨,大多数都是从尸体中获取或者募捐获得;异种异体骨大多来源于动物的骨组织.这种材料取材广泛,来源广,与人骨结构相似,但是植入体内后可能存在排斥反应、被机体降解吸收导致不愈合的情况.③人工骨替代材料.包括金属替代材料、高分子植入材料、陶瓷替代修复材料和复合生物材料等.医用金属材料具有高强度、耐疲劳、延展性和重现性好等特点,因此成为骨材料应用中常用的替代材料,该类材料缺点是通常易腐蚀,引起有害离子的释放产生毒性,不能作为长期植入材料.高分子材料近年来迅速发展,成为生物医用机械领域的主要材料,包括天然高分子材料和合成高分子材料.高分子生物材料有较好的延展性、轻量化和易成型等特点[2].陶瓷骨替代修复材料包括生物活性玻璃陶瓷、磷酸三钙和羟基磷灰石等.生物活性玻璃陶瓷在临床上主要用于牙种植体材料和骨填充材料,具有较高的强度,但由于其韧性比自然骨差、弹性模量过高、脆性大和抗疲劳性能较差等特点,不能直接用于承力较大的人工骨.磷酸三钙是目前广泛应用的生物降解陶瓷,具有良好生物相容性和生物可降解性,但也存在低抗疲劳强度等缺陷.羟基磷灰石具有良好的生物活性,但具有脆性大、塑形差和强度低等缺点[4].纳米级羟基磷灰石(hydroxyapatite,HA)具有更高的表面活性,比普通磷灰石更容易被人体降解和吸收,HA纳米粒子高分子复合材料通过模拟天然骨组织结构特点[5],可以综合各组分材料的性能,有效解决在生理环境下强度低、抗疲劳性差的缺点,该材料在硬组织修复领域有着广阔的应用前景.根据生物复合材料中组分材料性质不同,通过设计和制备复合材料,融合各组分材料的性能,获得单组分材料中不具备的新性能,从而研制出理化性质与人体骨组织类似的复合生物材料.
3 骨替代高分子复合材料
理想的人工骨替代修复材料应该具有以下特点:①具有良好的生物相容性,材料利于细胞的黏附增殖或分化;②具有必要的机械性能,材料的降解性可控;③具有与骨组织相似的多孔三维结构,能够为新骨在材料表面扩展生长提供支持(骨传导性),能够诱导骨组织周围的多能干细胞向成骨细胞分化(骨诱导性) ;④材料来源充足,易成型[4].
经过改性的聚合物复合材料作为修复和替换人体硬组织的材料,将具有以下优点:弹性模量通过调整可以达到自然骨水平;材料繁多、品种多样,可以满足人体不同部位需要的植入体;易成型,密度低,韧性高.缺点是作为负载材料时有强度差和易变形等局限性,同时聚合物——碳纤维复合材料的表面没有生物活性[1].Bonfield等[5]首先向高密度聚乙烯中掺入了羟基磷酸钙填料,使得聚合物的弹性模量调整到自然骨水平,具有较高的生物活性,植入体内后能与自然骨形成化学键结合,达到很好的固定效果.目前这种材料已临床应用于颊骨和中耳骨的植入.这类材料的机械强度较低,只能用于承力小的部位.复合材料中的羟基磷酸钙粉体尺寸大、含量高、团聚严重,聚合物基体的结合不良,导致该类聚合物复合材料的微孔隙较多,所以在含水环境中性能不能长期稳定.
聚醚醚酮(polyetheretherketone,PEEK)适合用作新型生物复合材料的基体[6].具有高强度(抗拉强度比聚乙烯高5倍)、高韧性、高耐磨性、抗疲劳性和抗冲击性好;它是一类半结晶热塑性聚合物,无需任何添加剂即可成型,这避免了由于加入其他的化合物可能带来的对人体有害的污染;它对水解与辐射有很强的抵抗力,因此在材料经过高温高压或辐射消毒后,其力学性能不会劣化,这种材料在生理环境中力学性能十分稳定[7].为了使聚醚醚酮表面具有生物活性,Bakar[8]曾尝试将羟基磷酸钙填料加入其中,羟基磷酸钙粉体粗大和用量高,严重减低了聚醚醚酮材料的机械强度,通过熔融共混的方法将平均粒径为25~30 μm的HA加入到PEEK中制备出复合材料,研究了复合材料的各项性能,认为该复合材料对于骨骼移植具有较大的应用价值.蔡卫全等[9]采用原位聚合合成PEEK-HA复合材料,研究HA加入对PEEK力学性能的影响,由于HA的加入,复合材料的抗拉强度减小,硬度增加,红外光谱显示HA与PEEK基体之间并未形成真正的化学结合,只是物理上结合,故易造成复合材料断裂.使PEEK与HA形成有效化学连接或提高2种物质之间的增容,可能是今后研究方向.冯惺等[10]以HA和PEEK为基本原料,添加碳纤维(carbon fiber,CF),在分子间形成交联,制成HAPEEK-CF三元复合材料.CF的引入,可以显著提高PEEK-HA-CF复合材料的拉伸和弯曲性能,其强度和模量随CF含量的增加得到提高,比PEEK-HA复合材料的力学性能更加优异,强度和模量接近人体骨骼;体外活性试验显示该材料具有一定的生物相容性[9].
4 骨替代材料在体内的细胞环境
不同组织来源的细胞对材料的敏感性是有差异的,因此只用软组织来源的细胞来检测材料的细胞毒性,并不能全面反映生物材料的相容性.在骨缺损或疾病的患者体内,骨替代材料必须和原有骨骼匹配并稳定结合(图2),其结合有3种形式:①形态结合.早期生物材料与骨组织或细胞的表面机械结合,这种方式的结合下应力传递是不连续的.②生物结合.生物材料与骨组织或细胞形成嵌合与交联,应力传递不连续.③骨键结合或活性结合.生物材料与骨组织或细胞形成分子水平上的化学键(结合紧密、完全相容和应力传递连续),是长期植入材料的最佳结合方式[11].采用生物学方法评价植入体所接触的骨细胞环境,骨替代材料应选择骨组织来源的细胞,其中最重要的是成骨细胞.成骨细胞主要功能是分泌骨基质并矿化,形成新骨,维持正常骨量.当骨材料对成骨细胞造成损伤时,影响成骨细胞正常功能,会引起原有正常骨骼的病变,导致结合不牢并引发炎症反应等排斥现象,影响骨骼正常功能.因此,体外选择成骨细胞作为实验细胞,能更好地模拟骨骼材料与骨组织在体内的相互作用.MG-63细胞来源人成骨细胞系,是骨替代材料生物相容性研究的常用细胞.
骨替代材料在体内除了与成骨细胞接触外,还直接接触软组织来源的细胞,例如一些纤维性细胞等[12].骨替代材料植入人体必须与周围纤维性组织(肌肉)形成连接和结合,否则会发生肌肉组织萎缩、植入体脱落等,导致骨骼运动功能丧失.小鼠成纤维细胞3T3是一种重要的细胞材料,通常用于由致癌剂等所引起的体外毒性研究.
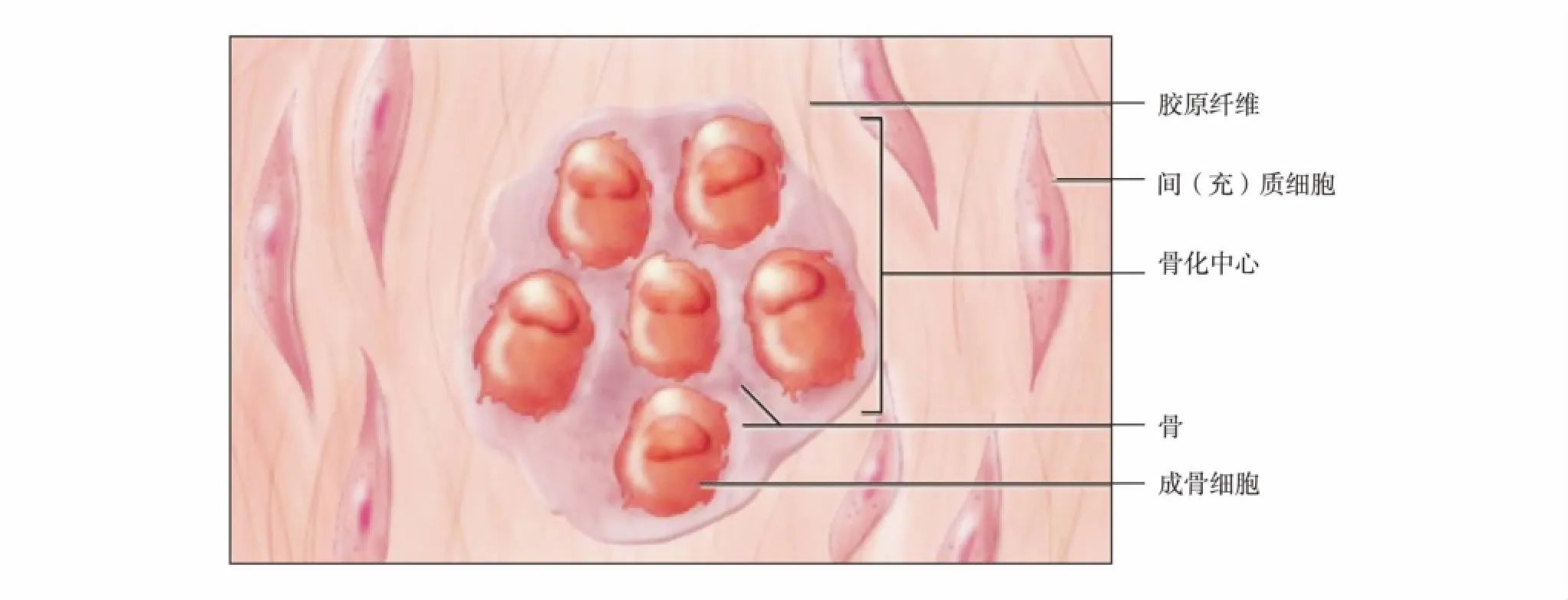
图2 骨替代材料在体内接触的细胞环境[12]Fig.2 In vivo cellular environment of bone substitute material[12]
生物相容性、生物力学适应性和抗肿瘤,是载药生物材料(或材料本身具有抗肿瘤能力)不可缺少的基本因素[13-14].单一组分的生物材料由于其本身的结构,难以满足人体环境的要求,复合材料通常具有复合体系中各个材料的优良性能,故复合型载药生物材料成为国内外的研究热点[15].因此可以将具有抗病的活性分子作为填充修复材料与PEEK基体复合,制备出力学性能和生物相容性优良,同时具备一定抗肿瘤特性的载药生物骨科材料[16].骨髓瘤细胞U2OS是常用作研究载药骨骼材料的重要细胞,通过分析抗骨髓肿瘤特性,为其进一步研究生物材料作为载药骨骼材料提供实验数据和科学依据.
5 细胞形态和结构与材料毒性的关系
细胞的各种生命活动是建立在细胞形态与结构完整的基础之上的,破坏了细胞完整性,细胞的生命活动也就不存在,当细胞形态与结构发生异常,细胞生命活动也将改变[17-18].通过观察细胞形态的变化或数量的增减,可以比较直观地判断材料对细胞毒性的作用,材料毒性成分对细胞的损伤,通常会引起生物分子结构的改变,出现代谢和机能的改变,如线粒体氧化代谢障碍、蛋白质表达异常[19]、细胞膜选择性通透屏障作用消失和细胞器发生形变等,这种变化可以通过形态学观察到.在光学显微镜或电镜下根据镜下形态特点[20],通过细胞自溶性变化、膜破裂和核聚缩等,可以判断材料的细胞毒性程度.图3为细胞形态异常图.用扫描电镜可以观察到细胞表面形貌和生长黏附情况,用透射电镜可以观察生物材料对细胞超微结构的影响.扈盛[21]将人肝癌细胞(Bel-7402)与TiO2纳米粒子共同孵育后,发现细胞内质网过度肿胀,出现线粒体肿胀崩解、峭结构紊乱、核膜周间隙扩大和核固缩等现象.将TiO2和HA两种无机纳米粒子与Bel-7402细胞共同孵育后发现,TiO2纳米粒子进入癌细胞后,在细胞内呈团聚状态并浓缩,不能被细胞代谢分解.随着HA纳米粒子的尺寸逐渐变小,颗粒边缘变模糊圆钝,晶体逐渐被破坏,说明它被细胞降解,证明纳米HA材料可作为理想的生物材料.
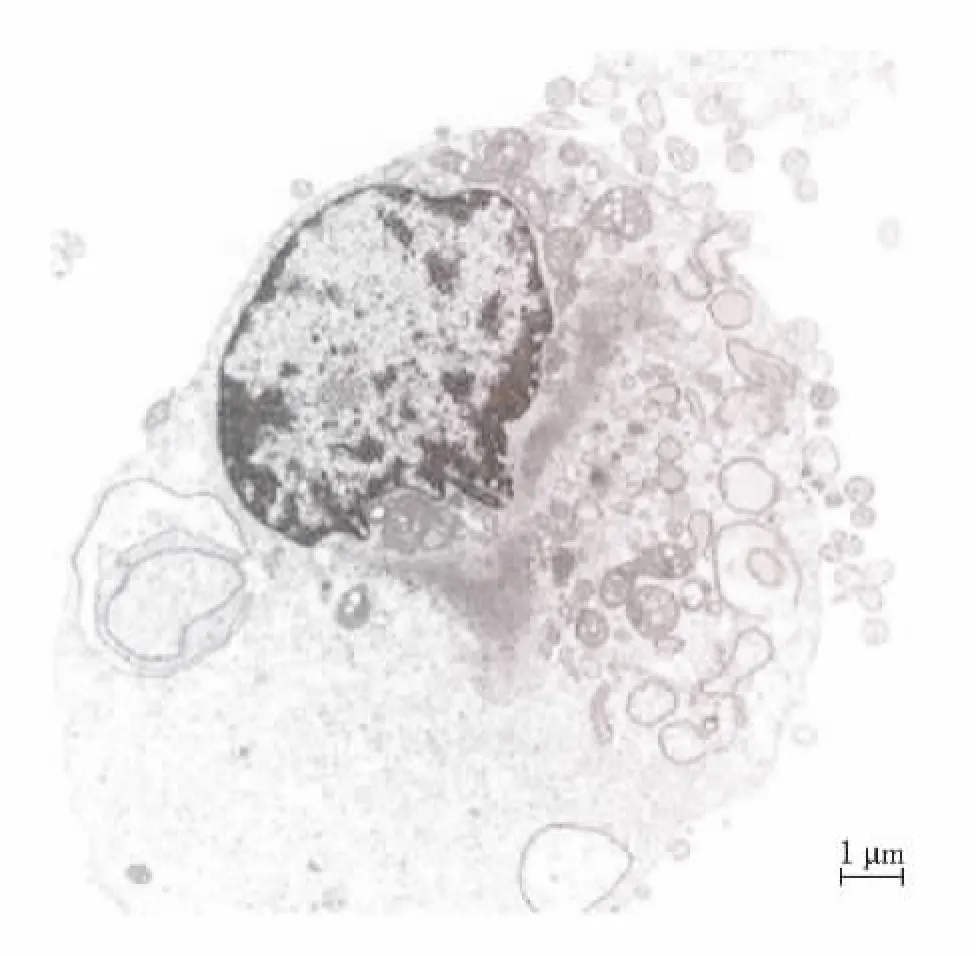
图3 细胞形态异常[20](显示细胞结构紊乱,质膜破裂,内含物泄露)Fig.3 Abnormal cell morphology[20](featured by structural disorder,membrane rupture and contents leak)
6 骨替代材料的跨膜运输
骨替代材料进入体液环境,无法直接被细胞摄取,通常会释放化学基团或小颗粒物质,作为载体与细胞发生作用,这些小颗粒物质进入细胞必须通过细胞膜这层天然屏障[22].Aoki等[23]发现,纳米颗粒共同孵育后,在癌细胞的细胞质内有大量小颗粒物质聚集在一起,包裹在一种特殊的空泡中,在未加入纳米粒子的对照组未发现这种含有颗粒的空泡,而且这些空泡中的颗粒物质的形状、大小与加入的纳米粒子较为相似,证明了纳米颗粒进入了细胞内部.扈盛[21]研究发现,羟基磷灰石纳米粒子进入细胞内需要微丝参与并形成囊泡.图4为HA粒子进入细胞的电镜图片,电镜观察到纳米粒子被肝癌细胞伸出的伪足分成若干小团块,然后被其伪足包围、包埋/吞噬泡形成、内陷,进入肝癌细胞质后脱离细胞膜,纳米粒子被包裹在有膜结构的空泡,是一个完整的吞噬过程,证明了吞噬是纳米粒子进入细胞的主要方式.

图4 HAP粒子进入细胞的TEM图[21]Fig.4 TEM image of HAP particles into cells[21]
7 细胞黏附与材料表面化学的关系
生物材料植入体内后,首先与细胞或组织直接接触的是材料的表面,因此生物材料表面性质对成骨细胞的黏附起非常重要的作用.成骨细胞在生物材料界面上的早期黏附程度和特性,一般决定了骨替代植入材料能否和骨形成长期稳定的骨整合,这对植入材料发挥正常生物学和机械功能具有重要意义[24].目前分子医学细胞生物学认为成骨细胞在种植体表面的黏附过程包括早期的热力学黏附以及晚期的生物学黏附.在离子力、疏水键和范德华力等弱作用力的影响下,热力学上的黏附发生在细胞黏附过程的早期阶段,发生迅速、持续时间短,使得细胞与基体暂时贴附.生物学黏附一般按血浆蛋白吸附—细胞接触—附着—伸展4个过程进行,需要多种黏附大分子蛋白的参与,主要有细胞外基质蛋白(extracellular matrix,ECM)、细胞骨架蛋白和细胞膜蛋白的共同作用,晚期生物学黏附作用不仅有利于材料与组织形成良性结合,而且可以将材料和细胞界面的相互作用信号传递到细胞内,从而调控细胞基因的表达[25].
陶凤娟等[25]发现,经纳米化改性的钛板可以调整合素(β亚基)的表达,从而促进细胞黏附.细胞外基质蛋白主要包括纤维连接蛋白(fibronectin,FN)、I型胶原蛋白(I collagen)和骨桥蛋白(osteopontin)等,上述细胞外基质蛋白为细胞黏附过程提供锚定、黏附位点以及信号传递基础,当细胞发生早期黏附,起黏附信号传递和级联放大作用,形成“生物材料材料—ECM—整合素—细胞骨架”双向信号通路,开始调节细胞骨架蛋白的运动,并形成应力纤维,改变细胞形态,包括细胞伪足的形成、伸展和变平等,使得更多细胞黏附在材料表面,见图5.根据“生物材料材料—ECM—整合素—细胞骨架”黏附模式可知,材料的黏附特性主要取决于对ECM的吸附作用,吸附得越多,越利于材料黏附细胞.影响材料吸附ECM的因素包括材料表面疏水性、电荷和粗糙程度等.其中材料表面的粗糙程度对细胞黏附有重要影响,越粗糙越容易黏附.采用等离子体改性羟基磷灰石表面,发现其不仅可以改变该材料的力学性能如张力,而且可以通过提高表面粗糙度,增加活性基团含量如羟基,这种经改性后的微结构能够使细胞更好发生黏附,提高细胞黏附率,促进增殖,从而改善骨结合能力.

图5 细胞黏附过程[25]Fig.5 Schematic of the cell adhesion process[25]
8 细胞增殖、周期和凋亡
细胞增殖是细胞生命活动的基本特征.测定细胞增殖活性能直接评估材料对细胞的毒性[20].Wang等[26]将来源于兔骨的间充质干细胞(mesenchymal stem cells,MSC)置于n-HA/PA支架材料上孵育,采用MTT法测定细胞增殖活性,发现随着时间延长,n-HA/PA支架材料上细胞增殖加快,2周之后,骨细胞量明显增加,表明该材料对MSCs细胞无毒性,生物相容性良好.细胞增殖的调节发生在细胞周期水平上.细胞周期的长短反映了细胞所处的状态,是细胞物质积累与细胞分裂的循环过程.材料或有毒物质通过改变周期蛋白依赖性激酶(cyclin-dependentkinases,CDK)或周期蛋白的表达影响细胞周期.王智琴等[27]研究表明,苯并芘能诱导DNA损伤,导致S期的周期蛋白cyclin A转录表达水平下调,使得细胞周期进程阻滞于S期,减缓细胞周期,抑制了增殖.近年来有关细胞凋亡的研究被逐渐应用于材料的细胞相容性的研究.曲秋莲[28]采用AnnexinV FITC/PI双染法检测活性炭和二氧化硅对胃癌细胞BGC-823凋亡率影响发现,与对照组相比,随着时间延长和浓度的增加,这2种材料均能促进该细胞发生凋亡,有一定抗胃癌功能.细胞凋亡主要受2条信号通路调节[20]:一是死亡受体介导的信号通路,死亡受体相应的配体结合后,将细胞外凋亡信号向细胞内部传递,引起细胞凋亡的执行者caspase蛋白酶家族的活化,活化后的caspase剪切相应的底物,启动并执行细胞凋亡过程.二是内源性线粒体通路.线粒体信号通路激活凋亡,设计多种非受体调节信号,包括胞内激活信号和胞外信号.这些信号使线粒体内膜电位和通透性改变,释放促凋亡蛋白进入胞质,如图6.王学等[29]研究了硅藻土陶瓷作为牙科材料对L929细胞致凋亡作用,硅藻土陶瓷组Bcl-2和Bax表达水平与阴性组间无显著差异,对细胞凋亡无明显影响,认为该材料无明显细胞毒性,符合临床应用要求.
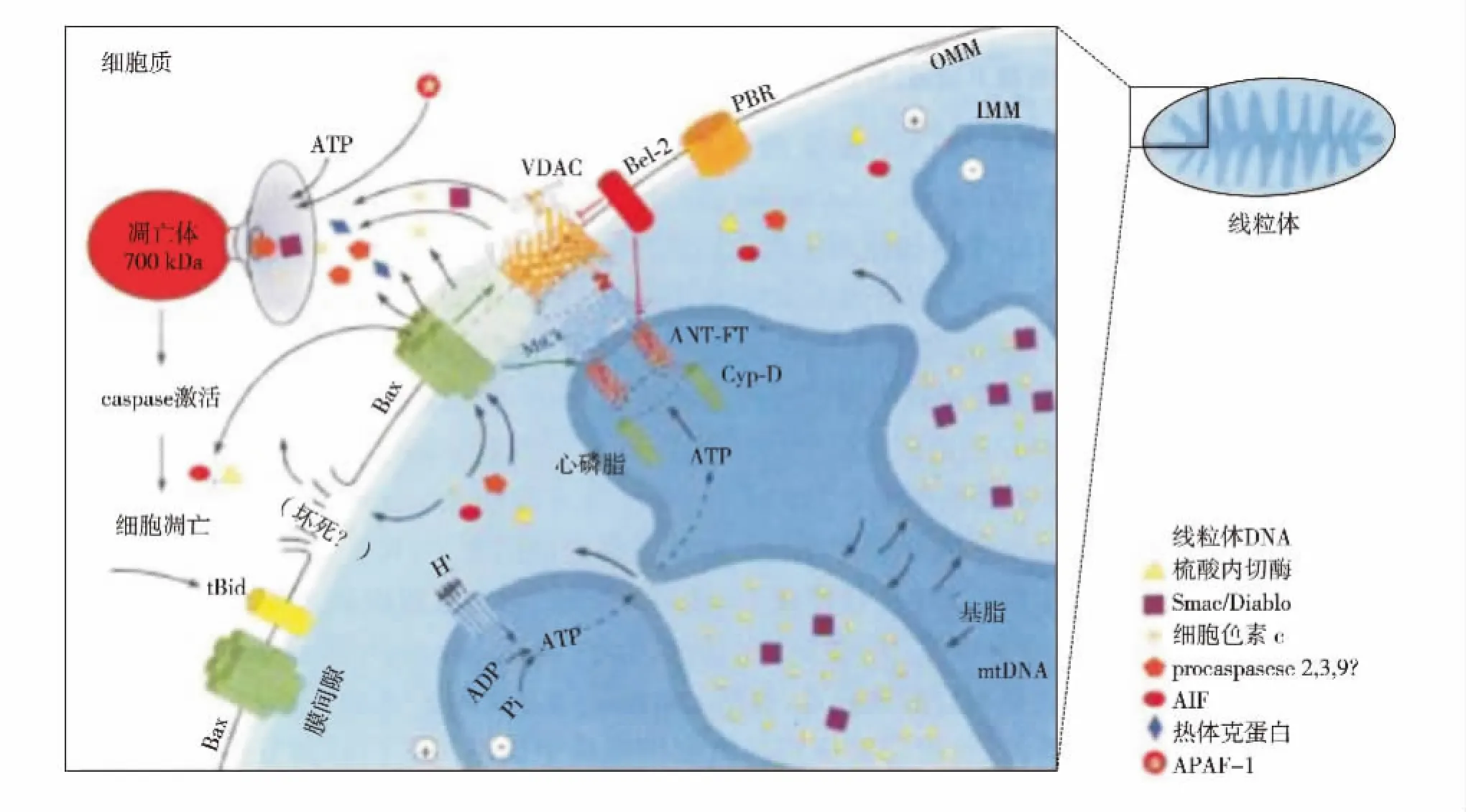
图6 线粒体介导的细胞凋亡途径[20]Fig.6 Endogenous apoptosis pathway mediated by mitochondria[20]
9 氧化应激作用
生物材料诱导产生活性氧自由基(reactive oxygen species,ROS),发生氧化应激,被认为是许多材料最主要的生物学效应,以及产生细胞毒性的一个重要机制[30-31].超大颗粒物质通常不能直接进入细胞,会间接释放Fe3+(Fento反应)、其他有害物质如多环芳烃等,诱导机体产生ROS,从而激活c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK) 和NF-κB信号通路,调节基因表达,决定细胞增殖或凋亡,纳米颗粒通过吞噬进入细胞,被溶酶体消化后或通过还原氢途径产生ROS,引起细胞凋亡等.细胞状态根据氧化应激程度表现为3级,即细胞初期防御状态、促炎性反应和凋亡[32],见图7.当机体产生的ROS超出机体清除能力时,过量的ROS就会将细胞膜上的磷脂以及酶和膜受体上的不饱和脂肪酸侧链氧化,形成丙二醛(malondialdehyde,MDA),从而导致细胞膜的流动性和通透性改变,继而破坏细胞的结构和功能,造成组织损伤和器官病变,因此测试MDA的量常常可以反映细胞氧化程度和损伤程度.生物膜系统如细胞质膜、线粒体膜及膜蛋白结构容易受到活性氧的氧化作用而失活,主要表现在3个方面:①活性氧与生物膜上的酶或跨膜受体蛋白共价结合,影响膜结构、成分和活性,从而导致功能异常;②生物膜的脂质成分被自由基氧化成脂质过氧化物,引起膜结构变化(蛋白和脂质比例失衡),导致膜功能改变,从而影响细胞正常物质运输和信息传递;③攻击核酸分子,包括线粒体DNA和核DNA,造成DNA损伤,引起基因异常表达,细胞发生凋亡或坏死;④线粒体膜脂质过氧化反应、电位改变,激活内源性凋亡途径,从而引起细胞凋亡[33].

图7 ROS介导材料颗粒产生细胞毒性的分子机制[32]Fig.7 Molecular mechanism of cytotoxicity produced by material particles mediated by ROS[32]
10 调节信号转导
正常情况下成骨细胞和破骨细胞数量和功能通过各种细胞因子和信号通路维持一个稳定的水平,从而使它们所介导的骨形成与骨吸收处于平衡状态.当骨替代材料与这些细胞接触时,可能会扰乱这一平衡,导致正常骨骼结构和功能的异常[34-35].一方面,成骨细胞和破骨细胞数量和功能的稳定主要是通过OPG/RANKL/RANK信号转导通路维持的,成骨细胞表达分泌核因子-κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL),破骨细胞的表面具有核因子-κB受体活化因子(receptor activator of nuclear factor κB,RANK),两者结合后激活核因子κB通路(nuclear factor-kappa κB,NF-κB),细胞核内上调c-Fos基因的表达,c-Fos与NFATc1蛋白结合形成复合物,激活破骨细胞特异性基因的表达,促进破骨细胞的分化、功能活化并抑制其凋亡,加快骨吸收过程[36].另一方面,成骨细胞可以表达诱骗受体骨保护素(osteoprotegerin,OPG),竞争性结合RANKL,阻止RANKL与RANK结合,从而使核因子κB通路失活,抑制破骨细胞功能活化.因此,RANKL和OPG比例对于骨吸收和重建具有重要意义,它可以反映骨重建和吸收的速率,当RANKL和OPG的比例上升时骨吸收较快,RANKL和OPG的比例下降时骨吸收减慢,见图8.Abhiram等[37]设计一种能放出长波长的超声装置,刺激成骨细胞,研究NF-κB信号通路中RANKL和OPG比例的变化,发现在3~24 h时,OPG表达量显著升高,而RANKL表达量极低,RANKL和OPG的比例明显降低,表明该超声装置可以使成骨细胞保持较高活性,维持成骨功能.生物材料调节成骨细胞信号转导和分化,能够反映材料对细胞特异性功能的影响.
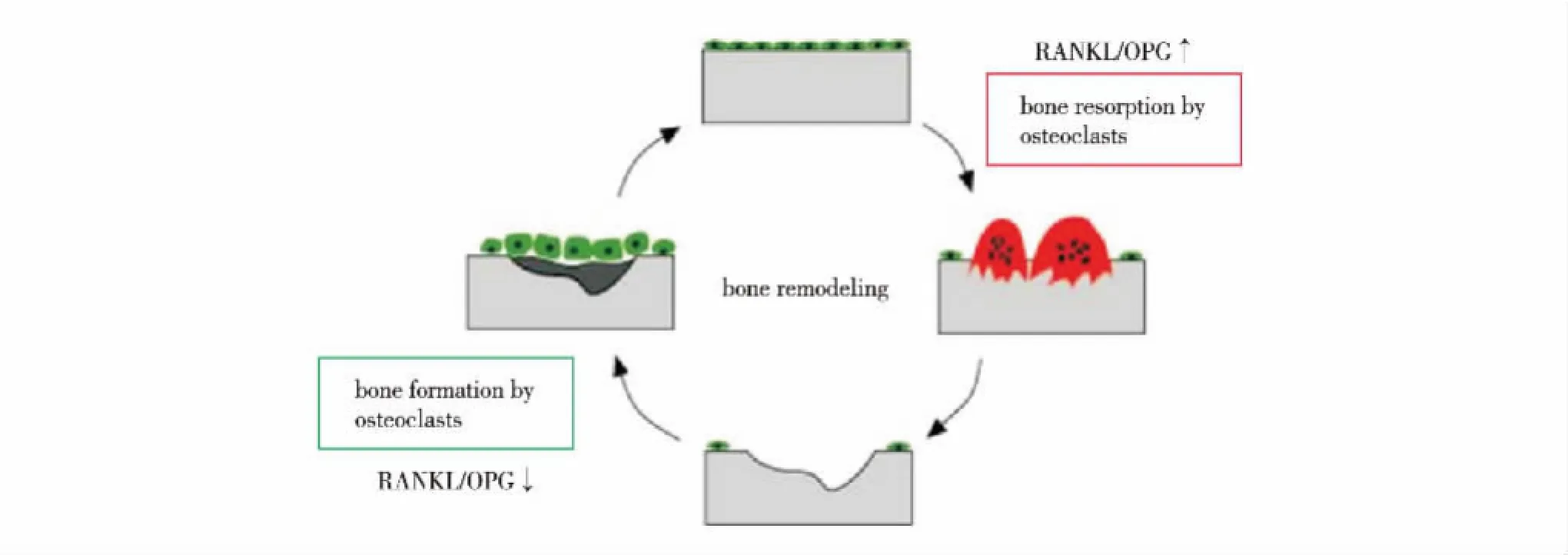
图8 RANKL和OPG的比例调节骨的重建[36]Fig.8 Bone reconstruction by regulating proportions of RANKL/OPG regulate[36]
11 骨替代材料的生物相容性评价方法
生物相容性的评价方式有很多,主要分为体内生物学及体外生物学评价.当材料植入体内与器官组织直接接触时,材料对人体组织将产生多种作用;同时人体具有极其复杂的生理环境,也会对材料造成理化性质的改变,这些影响反过来又会产生新的生物学反应.这种材料与生物体之间动态的相互作用使各自的性质和功能都会受到不同程度的影
响[38],见图9.
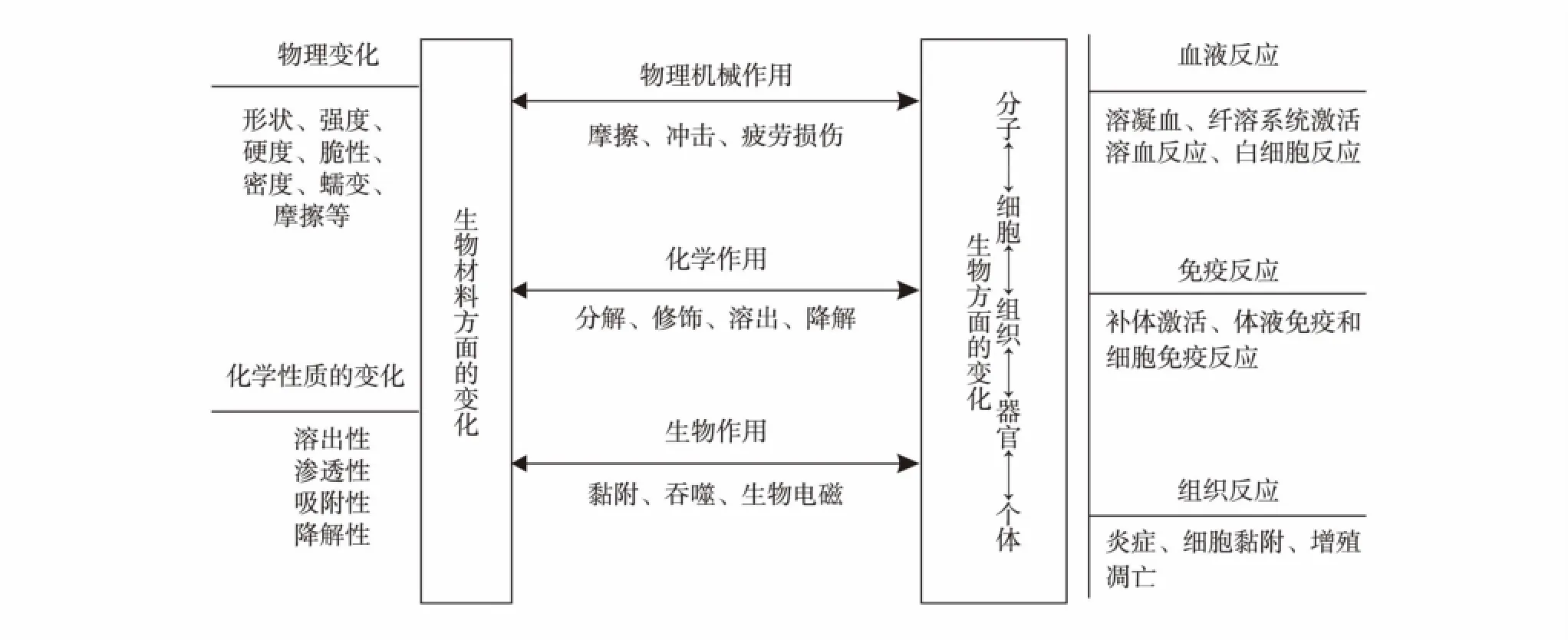
图9 材料与生物体之间相互影响[38]Fig.9 Interaction between the bone substitute material and the organism[38]
生物材料的细胞相容性除了满足ISO(international organization for stardardization)系列标准所推荐的原则和方法外,近年来还发展出了体外细胞毒性试验,从形态学方法检测细胞损伤、细胞生长测定和细胞代谢测定等角度提出了不少实验方法,并从定性体外评价逐渐向定量测定发展[37,39].通过这些体外研究,可以综合判断材料对细胞的影响及其机理,评价材料的生物相容性.随着组学的深入发展,一些学者认为还需从基因组和蛋白质组水平去评价材料的生物相容性[40],见图10.从分子、细胞和整体生物学3个水平评价生物材料的生物相容性,确保生物材料安全有效地应用于人体.
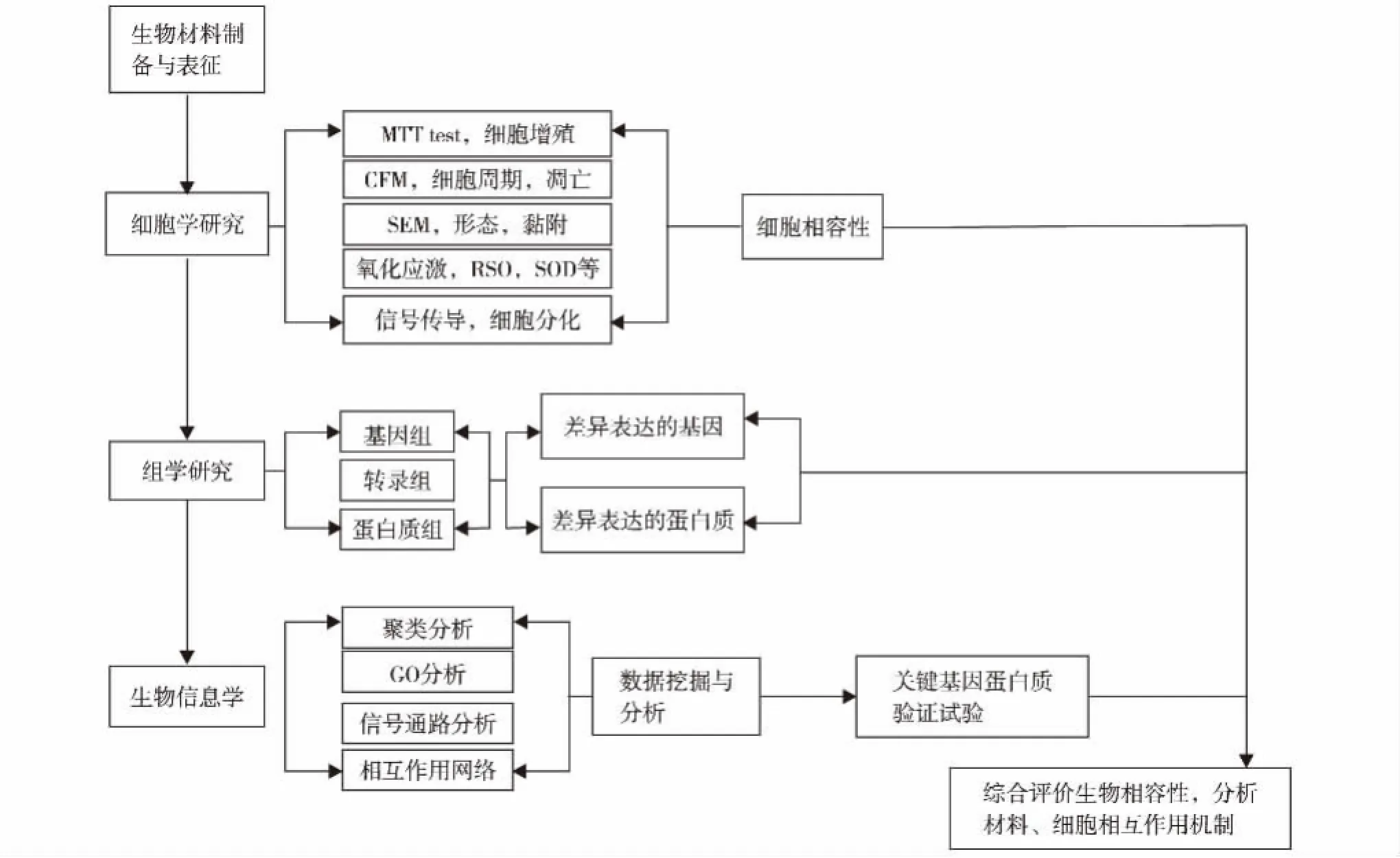
图10 生物材料的体外研究[40]Fig.10 In vitro studies of biological materials[40]
结语
介绍骨替代材料的生物相容性评价方法,从不同角度研究和评价生物材料对细胞的作用与影响.按照生物功能性原则,细胞相容性还应包括材料对细胞生物功能的影响评价,体外方法主要集中在细胞黏附、周期、凋亡测定、分化、细胞生理、氧化应激、信号通路调节和生物合成功能等方面.通过生物材料的体外研究和体内研究,可以保障生物材料应用的安全有效.
引 文:倪 卓,杨 莎,王 应,等.骨替代材料的研究方法及进展[J].深圳大学学报理工版,2015,32(4) : 331-342.
参考文献/References:
[1]Ni Zhuo,Wang Ying,Liu Shide,et al.Study on MG-63 cells proliferation for PEEK/HA composite[J].Orihopaedic Biomechanics Materials and Clinical Study,2013,10(3) : 46-49.(in Chinese) 倪 卓,王 应,刘士德,等.聚醚醚酮/纳米羟基磷灰石生物材料对MG-63细胞增殖作用[J].生物骨科材料与临床研究,2013,10(3) : 46-49.
[2]Ni Zhuo,Hua Wenyu,Wang Ying,et al.Crystallization kinetics of PEEK/HA composite[J].Polymer Materials Science and Engineering,2013,29(2) : 74-77.(in Chinese) 倪 卓,华文语,王 应,等.PEEK/HA生物复合材料的结晶动力学研究[J].高分子材料科学与工程,2013,29(2) : 74-77.
[3]Landis W J,Song M J,Leith A,et al.Mineral and organic matrix interaction in normally calcifying tendon visualized in three dimensions by high-voltage electron microscopic tomography and graphic image reconstruction [J].Journal of Structure Biology,1993,110(1) : 39-54.
[4]Cypher T J,Grossman J P.Biological principles of bone graft healing[J].The Journal of Food and Ankle Surgery,1996,35(5) : 413-741.
[5]Bonfield W,Wang M.Interfaces in analogue biomaterials [J].Acta Materialia,1998,46(7) : 2509-2518.
[6]Lin T,Corvelli A,Frondoza C J,et al.Glass PEEK composite promotes proliferation and osteocalcin production of human osteoblastic cells[J].Journal of Biomedical Materials Research,1997,36: 137-144.
[7]Godara A,Raabe D,Green S,et al.The influence of sterilization processes on the micromechanical properties of carbon fiber-reinforced PEEK composites for bone implant applications[J].Acta Biomater,2007,3(2) : 209-220.
[8]Bakar C K.Mechanical properties of injection molded hydroxyapatite/polyetheretherketone biomaterials[J].Composites Science and Techology,2003,63(12) : 421-425.
[9]Cai Weiquan,Weng Lvqian,Ni Zhuo,et al.In situ polymerization of hydroxyapatite/poly(ether-ether ketone) composites[J].New Chemical Materials,2010,38(6) : 37-38.(in Chinese)蔡卫全,翁履谦,倪 卓,等.原位聚合羟基磷灰石/聚醚醚酮复合材料[J].化工新型材料,2010,38(6) : 37-38.
[10]Feng Xing,Sui Guoxin,Yang Rui,et al.Mechanical properties and in vitro bioactive of polyetheretherketonehydroxyapatite(PEEK-HA) carbon fiber-reinforced composites for biomedical applications[J].Journal of Materials Research,2008,22(1) : 18-25.(in Chinese) 冯 惺,隋国鑫,杨 锐,等.PEEK-HA-CF复合材料的力学性能和体外生物活性[J].材料研究学报,2008,22(1) : 18-25.
[11]Hu Yunyu.A research on osteogenic potential the fibroblast [J].Journal of the Fourth Military Medical University,2001,22(11) : 961-963.(in Chinese)胡蕴玉.成纤维细胞成骨能力的研究[J].第四军医大学学报,2001,22(11) : 961-963.
[12]Vacanti C A,Upton J.Tissue-engineered morphogenesis of cartilage and bone by means of cell transplantation using synthetic biodegradable polymer matrices[J].Clinics in Plastic Surgery,1994,21(3) : 445-462.
[13]Liu Jingting,Han Yingchao,Li Shipu,et al.Research advances of anti-osteosarcoma nano drag carriers[J].Orthopaedic Biomechanics Materials and Clinical Study,2006,3(3) : 44-46.(in Chinese)刘静霆,韩颖超,李世普,等.抗骨肉瘤药物纳米载体的研究进展[J].生物骨科材料与临床研究,2006,3(3) : 44-46.
[14]Kubo T,Sugita T.Acetabular osteosarcoma treated by irradiation-vascularized hybrid bone graft[J].Anticancer Research,2004,24(3b) : 1889-1892.
[15]Feng Xin.Controlled released drug carrier material used in the field or department of orthopedics[J].Tianjin Phamacy,2009,21(1) : 63-68.(in Chinese) 冯 鑫.应用于骨科领域的缓控释药物载体材料[J].天津药学,2009,21(1) : 63-68.
[16]Pan Guoliang,Guo Qiang,Tong Juying,et al.Effect of solvens on properties of SPEEK proten exchange membranes prepared with the solution method[J].Materials Science and Techology,2008,16(5) : 642-645.(in Chinese)潘国梁,郭 强,童菊英,等.溶剂对溶液法制备的SPEEK质子交换膜性能的影响[J].材料科学与工艺,2008,16(5) : 642-645.
[17]Andre N,Tian Xia,Lutz M,et al.Toxic potential of materials at the nanolevel[J].Science,2006,311(3) : 622-627.
[18]Yang Xiaoming,Yin Huishui,Zhang Yu,et al.Biocompatibity of silicon containing micro-arc oxidation coatend magnesium alloy ZK60 with osteoblasts cultured in vitro [J].Chinese Journal of Reconstructive Surgery,2013,27(5) : 612-618.(in Chinese)杨小明,尹惠水,张 余,等.表面含硅微弧氧化涂层镁合金ZK60体外与成骨细胞生物相容性的研究[J].中国修复重建外科杂志,2013,27(5) : 612-618.
[19]Tao Fengjuan,Yu Youcheng,Chen Wantao,et al.The effects of nanostructed titanium fabricated via surface plastic deformation on MC3T3 cell adhesion[J].Fudan University Journal Medicion Science,2006,36(2) : 206-211.(in Chinese)陶凤娟,余优成,陈万涛,等.钛表面塑性变形纳米化对MC3T3细胞黏附的影响[J].复旦学报医学版,2006,36(2) : 206-211.
[20]Chen Yuanxiao,Chen Junxia.Medical cell biology[M].Beijing: Science Press,2013: 145-201.(in Chinese)陈元晓,陈俊霞.医学细胞生物学[M].北京:科学出版社,2013: 145-201.
[21]Hu Sheng.The process of hepatoma cells absorbing inorganic nanoparticles and the change of cells[D].Wuhan: Wuhan University of Techology,2005.(in Chinese) 扈 盛.无机纳米粒子进入肝癌细胞的过程及肝癌细胞的变化[D].武汉:武汉理工大学,2005.
[22]John D,Hood M B,Ricardo F,et al.Tumor regression by targeted gene delivery to the neovasculature[J].Science,2002,296(5577) : 2404-2407.
[23]Aoki H,Masaru A,Seisuke K,et al.Effects of hydroxyapatite-sol cell growth[J].Report of the Institute for Medical and Dental Engineering,1992,26: 15-21.
[24]Webster T J,Ergun C,Doremus R H,et al.Enhanced osteoclast-like cell functions on nanophase ceramics[J].Biomaterials,2001,22(11) : 1327-1333.
[25]Tao Fengjuan.The effects of nanostructured titanium fabricated via surface plastic deformation on biolology behavour of MC3T3 cell[D].Shanghai: Fudan University,2009.(in Chinese)陶凤娟.纯钛表面塑性变形纳米化对MC3T3细胞生物学行为的影响[D].上海:复旦大学,2009.
[26]Wang Huanan,Li Yubao,Yi Zuo,et al.Biocompatibility and osteogenesis of biomimetic nano-hydroxyapatite/polyamide composite scaffolds for bone tissue engineering [J].Biomaterials,2007,28: 3338-3348.
[27]Wang Zhiqin,Qi Yitao,Yang Di,et al.The effect of benzo pyrene exposure on cell cycle and related genes in HELF cells[J].Carcinogenesis,Teratogenesis,Mutagenesis,2009,21(1) : 42-45.(in Chinese)王智琴,齐以涛,杨 迪,等.苯并芘对HELF细胞周期及相关基因表达的影响[J].癌变·畸变·突变,2009,21(1) : 42-45.
[28]Qu Qiulian.Biological effects of four kinds of nanoparticles on human gastric carcinoma cell line BGC-823[D].Beijing: Institute of Pharmacology and Toxicology of AMMS,2009.(in Chinese)曲秋莲.4种纳米颗粒对人胃癌BGC-823细胞的生物学效应[D].北京:军事医学科学院毒物药物研究所,2009.
[29]Wang Xue,Zhang Feimin,Liu Mei,et al.Introduction of apoptosis and ralated genes by five kinds of dental materials on L929 cell[J].West China Journal Stomatology,2010,28(3) : 250-253.(in Chinese) 王 学,章非敏,刘 梅,等.5种牙体修复材料对L929细胞凋亡及相关基因的影响[J].华西口腔医学杂,2010,28(3) : 250-253.
[30]DeCoursey T E,Ligeti E.Regulation and termination of NADPH oxidase activity[J].Cellular and Molecular Life Science,2005,62: 2173-2193.
[31]Sayre L M,Perry G,Smith M A,et al.Oxidative stress and neurotoxicity[J].Chemical Research in Toxicology,2008,21(1) : 172-188.
[32]Li Ning,Tian Xia,Andre E N,et al.The role of oxidative stress in ambient particulate matter-induced lung diseases and its implications in the toxicity of engineered nanoparticles[J].Free Radical Biology and Medicine,2008,44(9) : 1689-1699.
[33]Zhao Jingxia.Influences of nanoparticle zinc oxide in the eletrophysiological properties of hippocampal neurons and the mechanism of the biological effects on PC12 cells [D].Tianjin: Nankai University,2010.(in Chinese)赵景霞.纳米氧化锌对海马神经元电生理特性的影响及对PCI2细胞生物学效应的机制研究[D].天津:南开大学,2010.
[34]Li Shuyu,Wang Zhigang.Progress in focal adhesion kinase singaling pathway[J].Biotechology Bulletin,2009,12(2) : 6-10.(in Chinese)李树裕,王志钢.黏附斑激酶(FAK)及其信号通路研究进展[J].生物技术通报,2009,12(2) : 6-10.
[35]Keselowsky B G,Collard D M,Garcia A J,et al.Surface chemistry modulates focal adhesion composition and signaling through changes in integrin binding[J].Biomaterials,2004,25(28) : 5947-5954.
[36]Aido R,Gersldine I,Imad N,et al.Effect of particle size on hydroxyapatite crystal-induced tumor necrosis factor alpha secretion by macrophages[J].Atherosclerosis,2008,196(1) : 98-115.
[37]Abhiram M,HoKee H,Siew-Tin O,et al.Long wave ultrasound may enhance bone regeneration by altering OPG/RANKL ratio in human osteoblast-like cells[J].Bone,2006,39: 283-288.
[38]Li Shipu.Introduction of biomedical materials[M].Wuhan: Wuhan University of Technology Press,2000.(in Chinese)李世普.生物医用材料导论[M].武汉:武汉工业大学出版社,2000.
[39]Song J H,Kim J H,Park S,et al.Signaling responses of osteoblast cells to hydroxyapatite: the activation of ERK and SOX9[J].Journal of Seoul National University,2008,26(2) : 138-142.
[40]Lyu(Lü) Xiaoying,Huang Yan,Yu Yadong,et al.Application of genomics/proteomics technologies in the research of biocompatibility of biomaterials[J].Journal of Inorganic Materials,2013,28(1) : 21-28.(in Chinese)吕晓迎,黄 炎,俞亚东,等.基因/蛋白质组学技术在生物材料生物相容性研究中的应用[J].无机材料学报,2013,28(1) : 21-28.
【中文责编:坪 梓;英文责编:远 鹏】
【材料科学/Materials Science】
Citation: Ni Zhuo,Yang Sha,Wang Ying,et al.Research methods and advances on bone substitute materials[J].Journal of Shenzhen University Science and Engineering,2015,32(4) : 331-342.(in Chinese)
Research methods and advances on bone substitute materials
Ni Zhuo1,Yang Sha1,Wang Ying2,and Liu Shide2
1) College of Chemistry and Chemical Engineering,Shenzhen University,Shenzhen 518060,P.R.China
2) College of Life Science,Shenzhen University,Shenzhen 518060,P.R.China
Abstract:This paper reviews the biocompatibility of bone substitute materials classified as autologous bone,allograft bone and artificial bone substitutes.Osteoblasts MG-63,fibroblast 3T3,myeloma cells U2OS are the main biological environments of these biological materials.Therefore,these three kinds of cells are common cells for the biocompatibility research of bone substitute materials.The evaluations of the biocompatibility of bone substitute materials include in vitro and in vivo biologics.The artificial bone substitute materials have important effects on the in vivo environment.These effects include the impacts on cell morphology and cell function.The characteristics of the cell morphology such as cell autolysis changes,rupture of membranes,nuclear fusion can determine the toxicological grade of biomaterials.The cell functions including membrane transport,cell adhesion,cell proliferation,cell cycle,apoptosis,oxidative stress and regulating signal transduction can determine the biocompatibility.
Key words:biomaterials; composite materials; bone substitute materials; biocompatibility; artificial bone material; repair materials
作者简介:倪 卓(1963—),男(汉族),吉林省通化市人,深圳大学教授、博士生导师.E-mail: royzhuoni@ hotmail.com
基金项目:广东省教育厅科技创新资助项目(2013KJCX0163) ;深圳大学应用技术开发资助项目(201223)
doi:10.3724/SP.J.1249.2015.04331
文献标志码:A
中图分类号:TB 332
