三种鯻科鱼类同工酶组织特异性及群体遗传结构分析
2015-12-24张健东何国清汤保贵潘传豪黄建盛
张健东,何国清,陈 刚,汤保贵,潘传豪,周 晖,黄建盛
(1. 广东海洋大学水产学院,中国 湛江524025;2.广东省普通高校南海水产经济动物增养殖重点实验室,中国 湛江 524025)
三种鯻科鱼类同工酶组织特异性及群体遗传结构分析
张健东1,2,何国清1,陈刚1,2,汤保贵1,2,潘传豪1,2,周晖1,2,黄建盛1,2
(1. 广东海洋大学水产学院,中国 湛江524025;2.广东省普通高校南海水产经济动物增养殖重点实验室,中国 湛江524025)
摘要采用聚丙烯酰胺垂直板不连续电泳法对3种鯻科鱼类6种组织(脑、眼、心、肾、肝和肌肉)的9种同工酶(ADH,EST,GDH,LDH,MDH,ME,POD,SDH,SOD)进行分析,结果显示具有明显组织特异性.此外,对每种鱼40个个体的肝脏的8种同工酶进行群体遗传结构分析,共记录15个基因位点,其中呈多态性的位点有 2个(m-Pod-1,s-Sod-1),多态座位比例(P)为0.133,位点平均有效等位基因数(Ae)分别为1.004,0.997和1.015,平均每个位点预期杂合度(He)值分别为0.068,0.066和0.045,平均每个位点实际杂合度(Ho)值分别为0.098,0.083和0.08.与其他鱼类研究结果相比较,表明3种鯻科鱼类的遗传多样性居于中等水平.
关键词鯻科鱼类;同工酶;组织特异性;遗传结构
TheTissue-SpecificitiesofIsozymesandtheGenetic
鯻科鱼类(Theraponidae) 属硬骨鱼纲(Osteichthyes),鲈形目(Perciformes),鲈亚目(Percoidei),为热带区沿岸性鱼类,主要分布于印度西太平洋地区及澳洲、新几内亚、印尼等沿岸海域[1].常见种类有细鳞鯻(Therapon jarbua)、鯻(Terapon theraps)、列牙鯻(Pelates quadrilineatus)和尖吻鯻(Rhynchopelate oxyrhynchus)4种,在中国发现了4属8种[2-4],鯻科鱼类肉质鲜美香滑,经济价值高,有很大的市场开发潜力[5-6].
同工酶在生物界广泛存在,变异丰富,且呈共显性遗传,能比较客观地代表基因组的变异,因而能较客观地度量群体的遗传变异大小,且实验条件较为简单,成本较低,结果快速可靠等优点,该技术已成为一种经济有效的群体遗传学研究手段,是近20年来检测遗传多样性研究最普遍的方法[7-10].本实验研究了3种鯻科鱼类部分同工酶的组织特异性并探讨其群体生化遗传结构,以期为该物种的种质调查提供有价值的生化遗传参数,同时也为种质资源的合理开发利用和遗传育种等提供部分理论依据.
1材料与方法
1.1试验样本
试验用鱼采自湛江附近海域,通过《中国鱼类系统检索》[11]和世界鱼类信息检索系统(http://www.fishbase.org)中的形态学描述确定为鯻科的细鳞鯻、鯻和列牙鯻,各取5尾,细鳞鯻平均体长15.45±1.18cm,平均体质量52.03±11.07g;鯻平均体长10.20±0.87cm,平均体质量14.10±3.98g;列牙鯻平均体长11.24±1.70cm,平均体质量20.58±11.30g.
活体解剖取其心脏(H)、肝脏(L)、脾脏(S)、肾脏(K)、肌肉(M)、鳃(G)、眼(E)、脑(B)和鳍(F)9种组织或器官,0.1mol/L磷酸盐缓冲液(pH7.0,4 ℃预冷)冲洗,编号装袋,保存于-80 ℃冰箱.
1.2样品制备
称取适量组织,按1∶3g/mL比例加入4 ℃预冷的0.1mol/L磷酸盐缓冲液(pH7.0 ),用玻璃匀浆器冰浴中充分匀浆后置离心管中,于4 ℃,15 000r/min离心30min,取上清液,置于1.5mL离心管中(肝脏离心两次,以去脂肪).加入等体积40%蔗糖及2.5μL溴酚蓝指示剂混匀,-80 ℃超低温冰箱中保存直至电泳前取出于-22 ℃冰箱中备用.
1.3电泳溶液配制
1.3.1电泳缓冲液配制
(1) 分离胶缓冲液TM1:Tris 72.6 g,加蒸馏水至180 mL,充分溶解,用1 mol/L HCl调节pH值至8.9,定容到200 mL.
(2) 浓缩胶缓冲液TM2:Tris 6.05 g,加蒸馏水溶解至180 mL,用1 mol/L HCl调节pH至6.7,定容到200 mL.
(3) 电极缓冲液TG:Tris6g,Gly28.8g,蒸馏水溶解,调pH至8.3,定容到1L.
1.3.2凝胶制备
(1) 30%凝胶储液配制:Acr90g,Bis2.4g,加蒸馏水至300mL,37 ℃温浴溶解,查证pH<7.0,用0.45μm孔径滤膜过滤除菌,棕色瓶4 ℃保存.
(2) 分离胶(30mL)和浓缩胶(10mL)配制方法见表1.
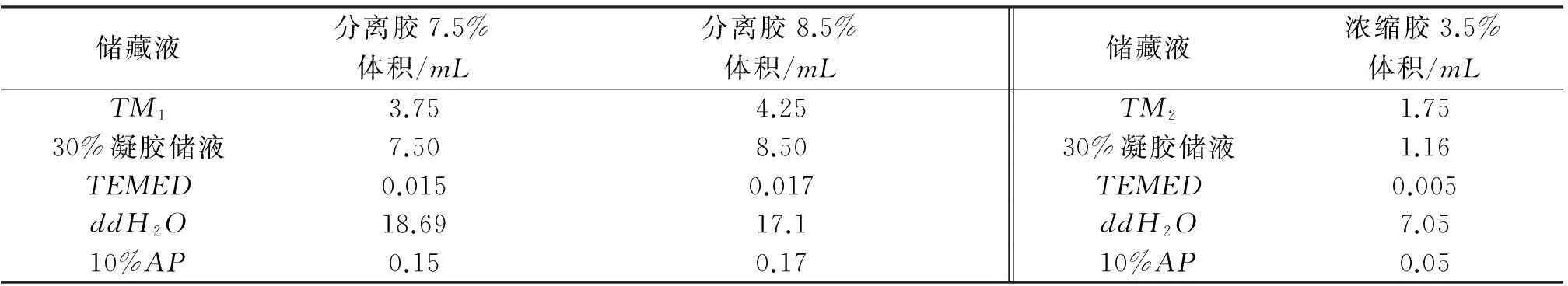
表1 分离胶和浓缩胶的配制
1.4电泳
采用聚丙烯酰胺垂直板不连续电泳法,所分析酶的名称、缩写和编号见表2.

表2 实验所分析同工酶的名称、编号及结构
注:D-二聚体;M-单体;T-四聚体.
1.5染色
显色方法参照小川和郎[12]等的方法稍做修改.按下列显色系统进行:
(1)乙醇脱氢酶(ADH)
染色液配制:0.05mol/LTris-HCl(pH8.0) 48mL,无水乙醇0.2mL,1%NAD1mL, 1%NBT1mL,染色前加1%PMS0.2mL,搅拌混匀.显色:将电泳后的胶板浸入染色液,于暗室37 ℃保温直至显示深蓝色区带.
(2)酯酶(EST)
染色液配制:0.1mol/LTris-HCl(pH7.1) 47mL,1%α-乙酸萘酯 1mL,1%β-乙酸萘酯 1mL,1%固蓝RR盐 1mL,搅拌混匀.显色:将电泳后的胶板浸入染色液,室温下直至显示棕色或红棕色区带.
(3)葡萄糖脱氢酶(GDH)
染色液配制:0.1mol/LTris-HCl(pH8.0) 43mL,葡萄糖9g,1%NAD1mL, 1%NBT1mL,染色前加1%PMS0.2mL,搅拌混匀.显色:将电泳后的胶板浸入染色液,室温下直至显示蓝色区带.
(4)乳酸脱氢酶(LDH)
染色液配制: 0.1mol/LTris-HCl(pH7.1) 43mL,1mol/L乳酸钠(pH7.0) 5mL,1%NAD1mL, 1%NBT1mL,染色前加1%PMS0.2mL,搅拌混匀.显色:将电泳后的胶板浸入染色液,于暗室37 ℃保温直至显示蓝紫色区带.
(5)苹果酸酶(ME)
染色液配制:0.05mol/LTris-HCl(pH8.0) 42mL,2mol/LDL-苹果酸钠(pH8.0) 5mL,10%MgCl20.5 mL,0.5%NADP 1 mL,1%NBT 1 mL,染色前加1%PMS 0.2 mL,搅拌混匀.显色:将电泳后的胶板浸入染色液,于暗室37 ℃保温直至显示深蓝色区带.
(6)苹果酸脱氢酶(MDH)
染色液配制: 0.05mol/LTris-HCl(pH8.0) 43mL,2mol/LDL-苹果酸钠(pH8.0) 5mL,1%NAD1mL,1%NBT1mL,染色前加1%PMS0.2mL,搅拌混匀.显色:将电泳后的胶板浸入染色液,于暗室37 ℃保温直至显示深蓝色区带.
(7)过氧化物酶(POD)
染色液配制:ddH2O 43 mL,2%醋酸联苯胺 5 mL,3%H2O22 mL,搅拌混匀.显色:将电泳后的胶板浸入染色液,室温下直至显示蓝色区带,显色很快,应尽快固定,拍照.
(8)山梨醇脱氢酶(SDH)
染色液配制:0.2mol/LTris-HCl(pH8.0) 45mL,15% D-山梨醇 1mL,10%MgCl21 mL,1 mol/L EDTA 0.05 mL,1%NAD 1 mL,1%NBT 1 mL,染色前加1%PMS 0.2 mL,搅拌混匀.显色:将电泳后的胶板浸入染色液,于暗室37 ℃保温直至显示深蓝色区带.
(9)超氧化物歧化酶(SOD)
染色液配制:0.05mol/LTris-HCl(pH8.0) 49mL,1mol/LEDTA0.05mL,0.002g核黄素,1%NBT1mL,搅拌混匀.显色:将胶板浸入染色液,室温光照下反应直至胶板底色变深而酶带透明清晰.
1.6酶谱分析与遗传学分析
(1) 酶谱分析对照片进行处理后,确定酶谱基因位点和等位基因,并做好标记记录,同工酶的缩写、基因座位和等位基因的命名采用Shaklee等[13]推荐的方法.
(2)遗传学分析中,多态位点比例、等位基因频率、平均杂合度(Ho,He)和Hardy-Weinberg遗传偏离指数等参照文献[14]计算.
a. 多态位点比例(percentageofpolymorphicloci, P):P=(k/n) × 100%,其中k为多态座位数,n为所测位点总数.
b. 等位基因频率(allelefrequency, qi):qi= (2nii+∑nij)/(2N) (i≠j),其中nii为具有纯合aiai基因型的个体数,nij为具有杂合aiaj基因型的个体数,N为总个体数.



f.Hardy-Weinberg遗传偏离指数(Geneticdeviationindex, d):d=(Ho- He) / He,其中Ho为位点实际杂合度,He为位点预期杂合度.
2结果与分析
2.1组织特异性
试验分析了3种鯻科鱼类的9种同工酶(ADH,EST,GDH,LDH,MDH,ME,SOD,POD,SDH),有明显组织特异性.在6种器官与组织中肝脏的同工酶表达最多且较稳定清晰,心、肾、脑次之,眼和肌肉较少(表3).试验所分析酶中EST,LDH,MDH,POD,SOD在各器官组织中都有表达,ADH,GDH,SDH仅在肝脏中有表达.ME在3种鱼间表达差异较大.部分同工酶在各组织中的表达情况见图1~图6.

图中从左到右依次为细鳞鯻、列牙鯻、鯻;脑(B);眼(E);心脏(H);肾(K);肝脏(L);肌肉(M);下同图1 3种鯻科鱼类乙醇脱氢酶的组织分布Fig.1 Eelectrophorogram of ADH in tissues of three species Theraponidae

图2 3种鯻科鱼类酯酶的组织分布Fig.2 Eelectrophorogram of EST in tissues of three species Theraponidae

图3 3种鯻科鱼类葡萄糖脱氢酶的组织分布Fig.3 Eelectrophorogram of GDH in tissues of three species Theraponidae
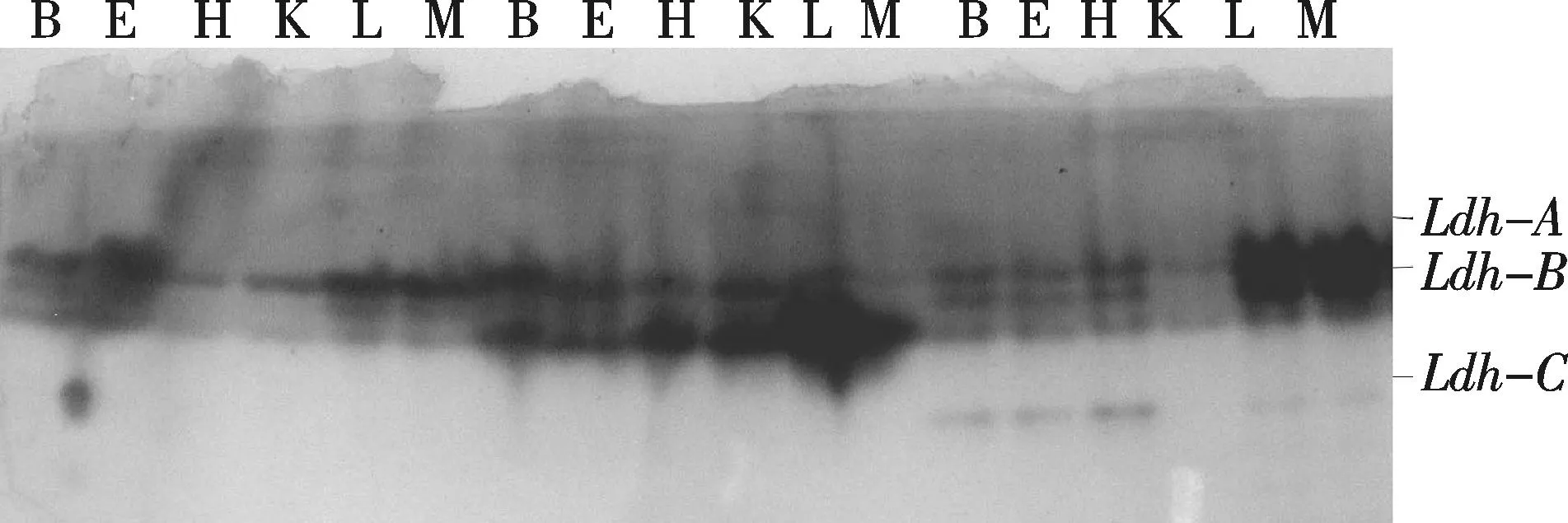
图4 3种鯻科鱼类乳酸脱氢酶的组织分布Fig.4 Eelectrophorogram of LDH in tissues of three species Theraponidae

图5 3种鯻科鱼类苹果酸酶的组织分布Fig.5 Eelectrophorogram of ME in tissues of three species Theraponidae

图6 3种鯻科鱼类超氧化物歧化酶的组织分布Fig.6 Eelectrophorogram of SOD in tissues of three species Theraponidae
3种鯻鱼的酯酶非常丰富,可能由6个位点编码,组织特异性明显.所测6种组织中,肝脏和肾脏中的酶活性较强且酶带较多.葡萄糖脱氢酶是磷酸戊糖途径的关键酶,当机体需要NADPH和磷酸核糖的时候,葡萄糖就会流入磷酸戊糖途径,在3种鯻科鱼类中仅在肝脏观测到其活性.鱼类的LDH为四聚体,在3种鯻科鱼类各组织中广泛存在,在心、肝、脑中活性较强.C位点仅在肝、眼等特异性组织中存在.
鱼类的ME为四聚体,也可分为细胞质型(s-ME) 和线粒体型(m-ME)两种[15].本研究中的3种鯻科鱼类ME酶谱中,位点m-Me-1在肝脏中活性最强,脑、心脏和肾次之.鯻的所有被检测组织中都有表达,在眼中最弱,而在细鳞鯻和列牙鯻的眼中没有检测到其活性.s-Me-1组织特异性较强,只在肝脏中有表达.
3种鯻科鱼SOD有s-Sod-1和m-Sod-1两位点,都为二聚体.s-Sod-1在6种组织中都有检出,肝脏活性最强,肌肉中活性最弱; m-Sod-1在肝脏中活性最强,心脏中表达最弱.
2.2遗传多样性
依据组织特异性分析结果选取肝脏对3种鯻科鱼类8种同工酶(EST,GDH,LDH,MDH,ME,POD,SDH,SOD)进行群体遗传结构分析.
2.2.1酯酶(Esterase,EST)EST是催化酯类化合物水解并进入中间代谢的重要酶系,认为可能与机体的解毒作用密切相关[16].鱼类的EST多为单体,一般由两个以上的位点编码,多态现象相当广泛.从本实验的EST电泳图谱中可以看出在6个位点中,Est-3和Est-4活性最强,Est-6表达最广.
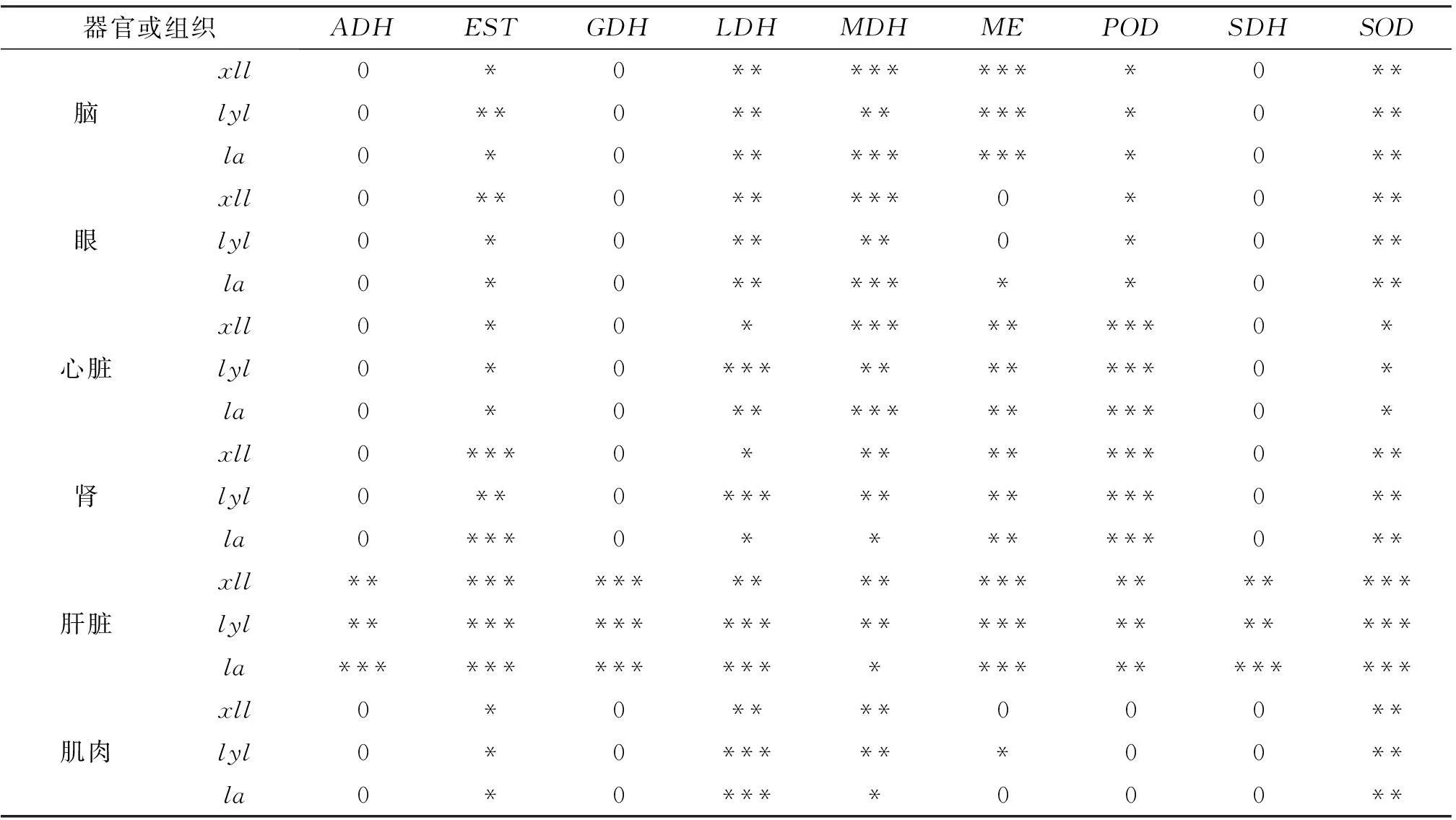
表3 3种鯻科鱼类9种同工酶的组织表达情况
注:***: 强;**: 中;*: 弱; 0: 无;xll:细鳞鯻;lyl:列牙鯻;la:鯻.
2.2.2葡萄糖脱氢酶(Glucosedehydrogenase,GDH)葡萄糖脱氢酶是磷酸戊糖途径的关键酶,帮助脂肪酸和固醇合成.GDH为二聚体酶,由1个基因位点编码.
2.2.3乳酸脱氢酶(Lactatedehydrogenase,LDH)LDH是参与糖酵解的酶,可使细胞在氧气不足时仍能进行正常的生理活动[17].鱼类的LDH为四聚体,由A,B和C共3个位点控制,A和B两个位点编码的亚基能形成A4,A3B,A2B2,AB3和B45种多肽聚合体,C位点仅在肝、眼等特异性组织中存在.LDH在3种鯻科鱼类各组织中广泛存在,在心、肝、脑中活性较强.
2.2.4苹果酸脱氢酶(Malatedehydrogenate,MDH)MDH是细胞中三羧酸循环重要的脱氢酶之一[18].硬骨鱼类的MDH分为上清液型(s-MDH) 和线粒体型(m-MDH)两种,均为二聚体.在3种鯻科鱼类的各组织中都有表达,组织间的特异性不明显(图7).
2.2.5苹果酸酶(Malicenzyme,ME)ME是生物氧化的重要酶类.鱼类的ME为四聚体.本研究中的3种鯻科鱼类ME酶谱中,位点Me-1在肝脏中活性最强,Me-2组织特异性较强,只在肝脏中有表达.
2.2.6过氧化物酶(Peroxidase,POD)该酶在H2O2的存在下催化一系列氧化反应.一般认为,植物的POD由一个位点控制,为单体或二聚体,近年来在鱼类中的研究逐渐增多,大多认为可能由两个位点编码且为二聚体[18].鯻科鱼类POD酶谱可能由6个位点控制,其中Pod-2和Pod-3表达的范围比较广也比较稳定.在分析的6种组织中,心脏和肾脏活性最强,肝脏和脑、眼的活性次之,肌肉中不表达(图8).

图7 鯻科鱼类群体苹果酸脱氢酶电泳图Fig.7 Eelectrophorogram of MDH in species of Theraponidae

图8 鯻科鱼类群体过氧化物酶电泳图Fig.8 Eelectrophorogram of POD in species of Theraponidae
2.2.7山梨醇脱氢酶(Sorbitoldehydrogenase,SDH)SDH与山梨醇代谢有关,除山梨醇外,还对一些糖醇的氧化有催化作用[19].3种鯻科鱼类的SDH只在肝脏中有检出,由一个基因座位Sdh-1,2编码(图9).

图9 鯻科鱼类群体山梨醇脱氢酶电泳图Fig.9 Eelectrophorogram of SDH in species of Theraponidae
2.2.8超氧化物歧化酶(Superoxidedismutase,SOD)SOD能清除体内产生的氧自由基O2-,是生物体防御氧化损伤的重要酶类,为二聚体酶,有两个基因座位编码,可分为线粒体型和上清液型[19].
本研究共记录了15 个基因座位,其中呈多态性的座位有2个(Pod-2、s-Sod-1),多态座位比例(P)为0.133,位点平均有效等位基因数(Ae)分别1.004,0.997和1.015,平均每个位点预期杂合度(He)值分别为0.068,0.066和0.045,平均每个位点实际杂合度(Ho)值分别为0.098,0.083,0.08.s-Sod-1和pod-2遗传偏离指数(d)大于零,等位基因频率分布偏离Hardy-Weinberg平衡,表明该位点处于杂合子过剩状态(表4) .
3讨论
3.1组织特异性
同工酶在不同组织器官中的特异性表达是基因及其调控机制对组织功能演化的响应[17],特异基因的表达产生了成体组织特异的同工酶,各种组织中同工酶的不同表达与各组织的代谢功能密切相关,即与特定组织的重要代谢途径有关[18].肝脏集消化、分泌、解毒等功能于一体,因此表达的同工酶也较丰富、复杂,试验所选9种酶全部在肝脏表达且活性较强即可证明.
在本研究中,乙醇脱氢酶(ADH)、葡萄糖脱氢酶(GDH)和山梨醇脱氢酶(SDH)只在肝脏中检出,说明3种鯻科鱼类的的乙醇代谢、膦酸戊糖途径和山梨醇代谢主要在肝脏中进行,这与肝脏的氧化乙醇成乙醛、脂肪酸和固醇合成、糖醇的氧化等生理功能密切相关.此外苹果酸酶(ME)的s-Me-1位点和酯酶(EST)的多个位点仅在肝脏中表达,有明显的组织特异性.
3.2遗传多样性
本研究中只发现过氧化氢酶(POD)和超氧化物歧化酶(SOD)中存在多态位点,这可能与所选的酶比较保守和采样范围不够大有关.动物的POD研究较少,鱼类的POD研究仅见寡龄新银鱼、美国红鱼和褐菖鲉的研究[16, 20-21].POD-1为一条纯合的酶带,POD-2由3个等位基因控制,在酶谱上的5条带,其酶型分别是AA,AB,AC,BB和CC,其中AB和AC的带明显比其他3条带粗.

表4 3种鯻科鱼类群体基因频率、多态位点比例(P)和平均杂合度(H)
鯻科3种鱼类SOD酶谱中,仅见两条酶带,靠近阳极的s-Sod-1位点比m-Sod-1位点粗一倍,作者推测m-Sod-1为纯合酶带而s-Sod-1为杂合酶带.s-Sod-1出现一条酶带的情况可能是[16]:该位点纯合子失活,以致全表现为杂合型.
多态位点比例(P)和平均杂合度(Ho)是有效反映鱼类种群遗传变异及其种质资源状况的两个重要参数.据统计,脊椎动物多态位点比例一般为0.15~0.3,平均杂合度一般为0.03~0.08,淡水鱼类的多态位点比例为0.118~0.333,106种海水鱼类的平均杂合度平均值为0.055[22-23].本试验得出3种鯻科鱼类的多态位点比例为0.133,水平较低.平均杂合度是度量遗传变异的最简单、最直接、最富信息的方法,由于它与测定样品量的大小的关系不大,因而比多态位点比例好些.3种鯻科鱼类的平均杂合度分别0.098,0.083和0.08,高于106 种海水鱼类的均值(0.055±0.036),这可能与样品s-Sod-1位点检测全为杂合型有关[16].结合比较上述研究报道,表明湛江海域3种鯻科鱼类群体遗传多样性处于中等水平.
3.3同工酶分析
相对于一些DNA水平的遗传标记,同工酶遗传标记检测到多态性较低,但同工酶可以确定样本中的个体是何种基因型、纯合子有多少及是何种等位基因的纯合或杂合子,可用于探讨基因控制个体发育的机理等方面的内容[24].由于同工酶检测的是基因的表达产物,检测的位点有限,表达产物的基因在生物体的整个基因组只占极少部分,还有大量的遗传变异未能检测出来;此外,从基因到表达产物存在转录、翻译等中间环节,同时受到自然选择或人工选择的影响,因而同工酶所反映的遗传变异往往较低,同工酶数据反映的亲缘关系有时可能不够全面.因此,有必要再结合RAPD、线粒体DNA及微卫星等分子生物学技术进行更加全面的研究.
参考文献:
[1]NELSONJS.Fishesoftheworld[M]. 3rded.NewYork:WileyPress, 1994.
[2]周佳怡,章群,唐优良,等.中国近海鯻科鱼类系统发育初探[J].海洋渔业, 2010,32(4):351-355.
[3]中国科学院动物研究所,中国科学院海洋研究所,上海水产学院.南海鱼类志[M].北京:科学出版社, 1962.
[4]李明德,罗阳,马若燕.中国鱼类名录Ⅸ——魣亚目、马鲅亚目、鲈亚目(部分)[J].海洋通报, 2003,22(2):69-75.
[5]张健东,宋蓓玲,陈刚.细鳞鯻年龄与生长的研究[J].海洋科学, 2002,26(7):62-66.
[6]赵建,陈昆慈,朱新平,等.高体革鯻肌肉营养成分的分析与评价[J].大连海洋大学学报, 2011,26(1):93-96.
[7]杨元昊,周继术,李蕾,等.兰州鲇不同组织同工酶及群体遗传结构初步分析[J].淡水渔业, 2015, 45(1):25-29.
[8]向兵, 文菊华. 狼蛛体躯不同部位及不同地域、海拔高度酯酶同工酶的研究[J]. 湖南师范大学学报:医学版, 2004,1(1):65-69.
[9]韩庆,赵东海.洞庭湖区不同体色鲇不同组织同工酶的比较研究[J].广东农业科学, 2015,42(2):104-107.
[10]庄轩. 斜带石斑鱼和赤点石斑鱼线粒体基因组全序列研究[D]. 厦门:厦门大学, 2008.
[11]成庆泰, 郑葆珊. 中国鱼类系统检索[M]. 北京: 科学出版社, 1987.
[12]小川和郎,中根一穗. 酶组织细胞化学技术[M]. 上海:上海医科大学出版社, 1989:14-31.
[13]SHAKLEEJB,ALLENDORFFW,MORIZOTDC, et al.Genenomenclatureforprotein-codinglociinfish[J].TransacAmFisheriesSoc, 1990,119(1):2-15.
[14]ASSOCIATIONJFRC.Populationdifferentiationofmarineorganismbyisozymeanalysis[R].Tokyo:JapanFisheriesResourceConservationAssociation, 1989:28-209.
[15]董宏标, 陈刚, 张明辉, 等. 褐菖鲉同工酶的组织特异性及群体遗传结构[J]. 广东海洋大学学报, 2008,28(4):15-20.
[16]邓思平, 刘楚吾. 赤点石斑鱼 4 种同工酶的组织分布及基因位点分析[J]. 浙江海洋学院学报: 自然科学版, 2004,23(2):103-106.
[17]GUOX,LIUS,LIUY.ComparativeanalysisofthemitochondrialDNAcontrolregionincyprinidswithdifferentploidylevel[J].Aquaculture(Amsterdam), 2003,224(1-4):25-38.
[18]余祥勇, 王梅芳, 梁飞龙, 等.企鹅珍珠贝不同组织同工酶表达的差异[J]. 中国水产科学, 2005,12(2):201-206.
[19]戈志强, 宋学宏, 许爱国, 等. 红鲌属 3 种鲌鱼同工酶的比较研究[J]. 水利渔业, 2005,25(6):23-24.
[20]林信伟,熊全沬. 寡齿新银鱼同工酶及其与幼态持续的关系[J]. 遗传学报, 1991,18(3):214-218,289-290.
[21]邬勇, 李明云, 范华, 等. 美国红鱼 (Sciaenops ocellatus) 鳍条组织的同工酶表达[J]. 宁波大学学报:理工版, 2005,18(4):463-466.
[22]李思发. 长江, 珠江, 黑龙江鲢, 鳙, 草鱼种质资源研究[M]. 上海:上海科学技术出版社, 1990.
[23]徐成, 王可玲. 鲈鱼群体生化遗传学研究Ⅰ: 同工酶的生化遗传分析[J]. 海洋与湖沼, 2001,32(1):42-49.
[24]杨洁.中华绒螯蟹体内几种同工酶及在不同发育阶段的研究[D].上海:上海师范大学, 2010.
(编辑王健)
StructureinThreeSpeciesofTheraponidae
ZHANG Jian-dong1,2*, HE Guo-qing1,CHENGang1,2, TANG Bao-gui1,2,
PAN Chuan-hao1,2, ZHOU Hui1,2, Huang Jian-sheng1,2
(1.FisheriesCollege,GuangdongOceanUniversity,Zhanjiang524025,China; 2.KeyLaboratoryofAquacultureinSouth
ChinaSeaforAquaticEconomicAnimal,RegularHighEducationInstituteofGuangdongProvince,Zhanjiang524025,China)
AbstractHorizontal starch gel electrophoresis was used to investigate the tissue-specificities of isozymes and the genetic structure of Theraponidae. 9 isozymes (ADH, EST, GDH, LDH, MDH, ME, POD, SDH and SOD) in 6 kinds of tissues (brain, eye, heart, kidney, liver and muscle) of three Theraponidae species were screened and the results showed that the screened isozymes displayed remarkable tissue-specificities. Besides, 8 enzymes from liver tissues in 40 individuals were selected for the genetic analysis. The 8 isozymes systems were encoded by 15 loci, and 2 (m-Pod-1 and s-Sod-1) of them were polymorphic. The proportion of polymorphic loci was 0.133. The average effective numbers of alleles (Ae) were 1.004(at T.jarbua),0.997 (at T.theraps) and1.015(at P.quadrilineatus), respectively. The mean expected heterozygosities per locus (He) were 0.068, 0.066 and 0.045. The mean actual heterozygosities per locus (Ho) were 0.098,0.083 and 0.08, respectively. This result indicated that there was a middle level of genetic variation in Theraponidae.
Key wordsTheraponidae; Isozyme; tissue specificity; genetic structure
中图分类号S917.4
文献标识码A
文章编号1000-2537(2015)05-0027-08
通讯作者*,E-mail:yzxzjd@126.com
基金项目:广东省科技计划资助项目(2006B20201003,2010B020308006);广东海洋与渔业科技兴渔资助项目(B200601 G02)
收稿日期:2014-05-11
DOI:10.7612/j.issn.1000-2537.2015.05.005
猜你喜欢
杂志排行
湖南师范大学自然科学学报的其它文章
- XML文档的聚类研究尹路修
- Weighted Pseudo Almost Automorphic Mild Solutions to Abstract Functional Differential Equations
- Boundedness of Vector-Valued Multilinear Singular Integral Operators on Generalized Morrey Spaces
- 基于城市流视角的泛珠江三角洲经济圈空间联系分析
- Synthesis, Characterization and Thermal Decomposition of Co(Ⅱ) Complexes Based on Biuret Ligand
- 翘嘴鳜miR-146a在胚胎发育过程中的表达及温度对其表达的影响
