一例猪腹泻病的诊断及免疫防控评估
2015-12-24邹运乾周春陵库旭钢何启盖
邹运乾,刘 洋,许 拓,周春陵,库旭钢,何启盖
(1.农业微生物学国家重点实验室,武汉 430070;2.华中农业大学动物医学院,武汉 430070)
一例猪腹泻病的诊断及免疫防控评估
邹运乾1,2,刘 洋1,2,许 拓1,2,周春陵1,2,库旭钢1,2,何启盖1,2
(1.农业微生物学国家重点实验室,武汉 430070;2.华中农业大学动物医学院,武汉 430070)
猪流行性腹泻(PED)是猪流行性腹泻病毒(PEDV)引起的一种猪的急性肠道传染病。该病主要呈现哺乳仔猪高发病率、高致死率的特点。2014年11月开始至2015年6月,河北某猪场长期暴发仔猪腹泻病,死亡率高达50%以上。通过现场调查、病理解剖、实验室病原诊断,确定该疾病主要由PEDV造成。并针对该场实际情况采用本实验室研制的PEDV新毒株弱毒疫苗与某商品灭活疫苗,以3种不同免疫方案进行免疫效果评估,综合安全性、免疫效力与生产成绩情况,结果显示两种疫苗联合使用及弱毒疫苗组免疫方案较仅使用商品灭活疫苗的灭活疫苗组有较高安全性、免疫保护效果及生产成绩。
猪流行性腹泻;诊断;免疫防控
1 试验材料与方法
1.1 疫苗、试剂、实验动物来源
试验所用弱毒疫苗为本实验室试制的猪流行性腹泻新毒株弱毒疫苗,商品灭活疫苗为猪传染性胃肠炎-猪流行性腹泻二联灭活疫苗。总RNA提取试剂盒购自Genemark公司,猪流行性腹泻 IgA和IgG间接ELISA检测试剂盒为本实验室研制[1],细胞培养相关试剂与材料购自gibco和hyclone公司。本研究实验动物来源于河北某规模化猪场。
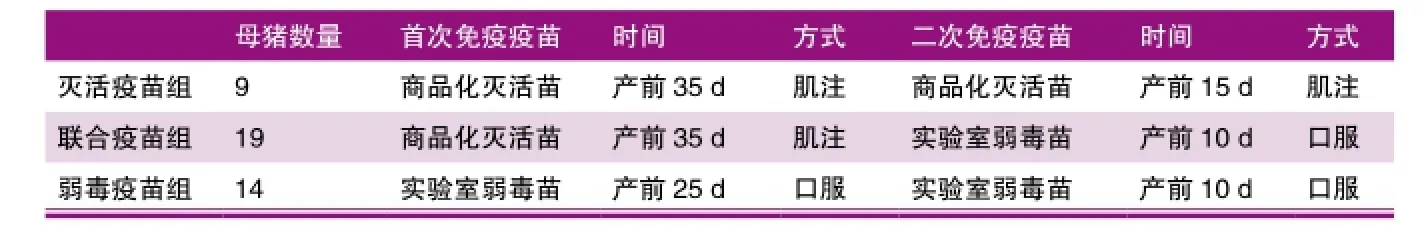
表1 不同疫苗组合免疫程序表
1.2 临床观察及病理解剖
观察该场患病仔猪临床表现,包括精神、食欲状况及是否腹泻、消瘦。解剖腹泻严重仔猪,观察病理变化,并取材备用。
1.3 实验室病原学检测
采集患病仔猪小肠样品,研磨后反复冻融3次,采用TRIzol法提取总RNA,使用同时可扩增PEDV M基因、TGEV(猪传染性胃肠炎病毒)N基因、GAR(猪A群轮状病毒)VP7基因的多重RT-PCR方法检测样品[2]。
1.4 免疫评估内容
本试验主要对该场选用的母猪3种不同免疫程序的防控效果进行评估。根据所使用疫苗种类我们将此3组分为灭活疫苗组,联合疫苗组,弱毒疫苗组。相关免疫程序见表1。
免疫防控的评估内容主要包括:安全性评价,即RT-PCR病原学检测母猪粪样中PEDV排毒情况,观察母猪及新生仔猪精神、食欲及腹泻情况等;免疫效力实验室评价,即通过ELISA检测抗PEDV IgA抗体、IgG抗体及通过中和试验检测中和抗体水平;临床生产成绩评价,即统计母猪产后7 d窝均活仔数和存活率。
1.5 间接ELISA
采集该3组母猪初乳共计42份,于4 ℃,12 000 r/min离心5 min,弃去上层乳脂层,用灭菌枪头小心吸取中间层的乳清,分离后使用本实验室研制的试剂盒检测猪流行性腹泻病毒的IgA、IgG抗体,检测方法依据试剂盒说明书。各抗体结果判定依据如下所述,以S/P值作为衡量IgA水平的标准,S/P值≥0.148为阳性;S/P值<0.148为阴性。以OD值作为衡量IgG水平的标准,OD值≥0.433为阳性;OD值<0.433为阴性。
1.6 中和试验
将测好TCID50的PEDV-YN144毒株病毒液稀释成200 TCID50/50μL的病毒悬液。在96孔微量培养板中将上述处理的乳清作连续2倍倍比稀释,在上述各孔内加入50 μL稀释好的病毒液,混匀后放入37 ℃ 5% CO2培养箱中作用60 min。同时设乳清对照,阴、阳性血清对照,病毒对照和正常细胞对照,其中病毒对照作200、20、2、0.2 TCID50共4个梯度对照。操作完成后弃去混合液并用DMEM洗涤2次,后每孔加入200 μL DMEM维持液,于37 ℃ 5% CO2培养箱培养,逐日观察并按Reed-Muench两氏法计算结果,稀释液、洗涤液和维持液均为含10μg/mL胰酶的DMEM。
2 结果
2.1 临床观察及病理解剖结果
临床可见部分仔猪发病严重,主要表现为呕吐且多发于吃奶后,排黄白或灰色水样稀便(图1A),粪便恶臭。病猪表现为精神沉郁、食欲衰退,消瘦,脱水,患病仔猪常抱团(图1B)。新生仔猪多发,且死亡率高达50%以上,一般腹泻3~4 d后死亡,严重时常有整窝发病死亡情况。母猪未见腹泻症状。剖检主要病变为小肠膨胀,肠壁变薄(图1C),充满淡黄色液体或灰黄色液体(图1D),个别小肠黏膜有出血点,肠系膜淋巴结水肿。胃内容物少,或充满胆汁样的黄色液体。其他实质性器官无明显病变。
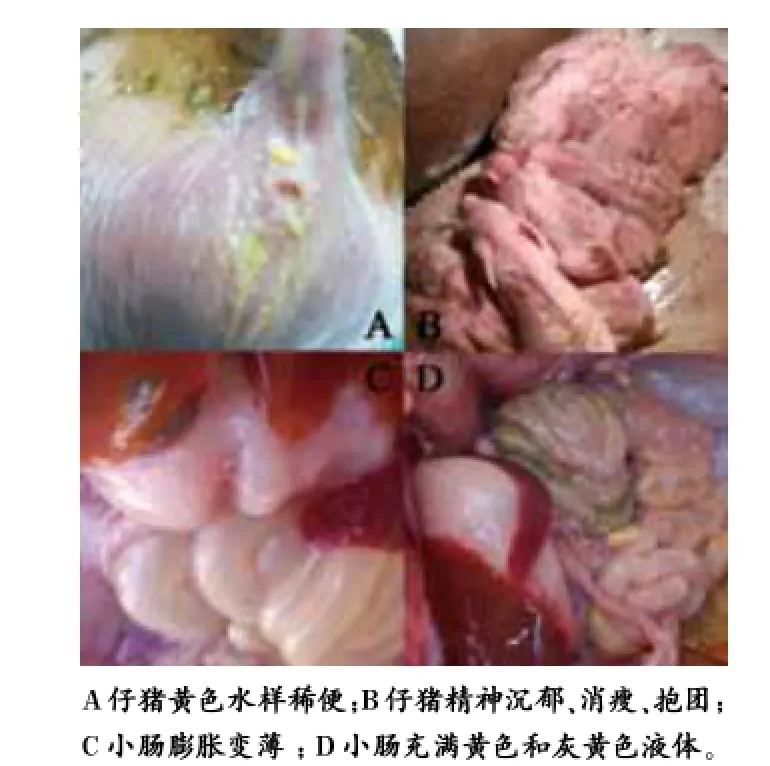
图1 临床表现与剖检变化
2.2 病原学检测结果
患病仔猪小肠样品RT-PCR检测结果如图2所示,7份小肠样品种有6份均为PEDV阳性(85.7%),TGEV与GAR均为阴性。
2.3 免疫防控效果评估
2.3.1 安全性
RT-PCR检测疫苗免疫前后母猪粪样,在无PEDV疫情区域内观察结果显示3个组中免疫母猪均未出现排毒情况,且母猪精神、食欲等表现正常,无腹泻现象。疫苗免疫母猪所产仔猪,精神、食欲良好,无腹泻情况,显示出各免疫程序均有较高安全性。
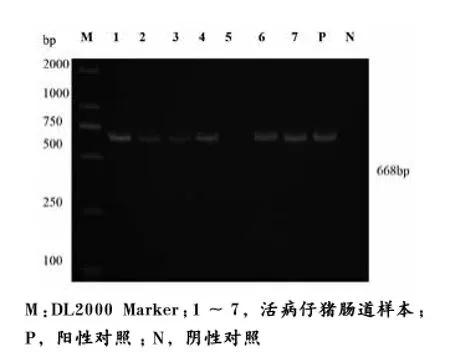
图2 腹泻仔猪肠样病原检测电泳图

图3 抗PEDV IgA、IgG抗体水平
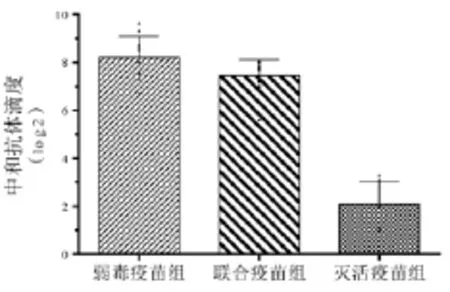
图4 中和抗体效价水平
2.3.2 抗体水平
ELISA检测抗PEDV IgA抗体结果表明,所有组的母猪初乳样品IgA抗体均为阳性,其中弱毒疫苗组初乳S/P平均值为0.77,联合疫苗组与灭活疫苗组相近,S/P值分别为0.63与0.62,差异均不显著。所有样品均为抗PEDV IgG抗体阳性,弱毒疫苗组、联合疫苗组和灭活疫苗组OD值分别为2.00,1.84和2.10,组间差异不显著(图3)。
中和试验结果如图4所示,弱毒疫苗组平均中和效价为1∶351,联合疫苗组中和抗体平均效价为1∶188,灭活疫苗组平均中和效价为1∶4.1,3组组间差异显著(P<0.05)。
2.3.3 临床观察及生产成绩
观察该3组中母猪对应窝内仔猪腹泻情况,弱毒疫苗组仔猪腹泻率为35.7%,少数腹泻仔猪食欲较弱,精神较差;联合疫苗组仔猪无腹泻情况,仔猪精神状况良好;灭活疫苗组仔猪腹泻情况最严重,腹泻率为55.6%,对应腹泻仔猪消瘦、畏寒、扎堆,精神差。
考虑到可行性,本研究主要从产后7 d窝均活仔数、存活率方面评价各组生产成绩。如图5所示,窝均活仔数与存活率最高的为联合疫苗组(9.4头,99.2%);其次为弱毒疫苗组(9.3头,84.9%);灭活疫苗组表现最差(8.3头,77.3%),其中存活率指标联合疫苗组与灭活疫苗组差异显著(P<0.05)。
3 讨论
3.1 病原诊断
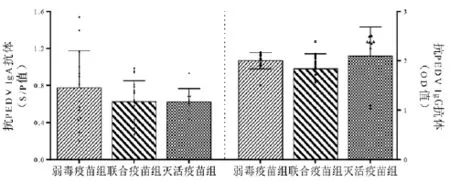
图5 窝均活仔数及平均存活率比较
PEDV、TGEV、GAR以及其他病原均可引起高度接触性腹泻疾病,其临床症状、病理变化和流行病学较为相似,在临床和组织病理学上很难区分。本案例在分析实地调查、实验室剖检结果的基础上,采用PEDV、TGEV、GAR三重RT-PCR方法诊断,结果显示患病仔猪小肠样品中PEDV阳性、TGEV和GAR均为阴性,说明该场腹泻疫病由PEDV引起。
3.2 免疫防控评估
在该场PED疫病出现后,选择使用本实验室研制的PEDV 新毒株弱毒疫苗以及商品灭活疫苗组成不同的免疫程序比较安全性、抗体水平及生产成绩,希望可以为猪场解决PED疫病提供较好的解决方法。本试验中,各免疫程序安全性良好,接种后怀孕母猪均未出现排毒及腹泻现象,对应仔猪也表现正常,无腹泻现象。本研究所用弱毒苗在Vero细胞系上连续传代144F致弱,此前使用初生仔猪进行动物试验已证明本弱毒疫苗对仔猪有较高安全性,此结论在本试验中亦被证明。灭活苗安全性高众所周知,因此,本试验中3种免疫程序均有较高安全性。
疫苗免疫效力主要通过ELISA方法测定初乳中抗PEDV IgA、IgG抗体,中和试验测定中和抗体效价,观察使用效果及比较生产成绩(窝均活仔数、产后7 d存活率)予以综合考量。PED发病机理是病毒通过口感染后,进入小肠绒毛上皮细胞浆中复制,造成细胞器损伤,导致肠绒毛萎缩,进而引起营养物质吸收障碍,严重腹泻引起脱水导致猪发病死亡。因此,在病毒性腹泻的免疫机制中,黏膜免疫具有非常重要的作用。肠道黏膜分泌的分泌型IgA(sIgA)抗体能在小肠上皮细胞表面抵御入侵的病原菌。口服疫苗能刺激黏膜免疫,产生黏膜和血清保护性IgA抗体,直接从肠道阻断受体与病毒的结合,是预防肠道传染病的有效途径[3]。另外,从被动免疫角度考虑,初乳中的IgA的含量决定了疫苗对小猪的保护效果,当母猪肠道受到PEDV刺激后,分泌IgA的免疫细胞就迁移至乳腺,在乳腺定居后向乳汁中分泌IgA抗体。通过肠-乳腺轴途径,仔猪获得IgA,从而让仔猪获得针对PEDV的特异性免疫。另外,与IgM和IgG相比,IgA能够有效抵抗消化道蛋白水解酶的降解,所以IgA是中和通过肠道感染的病毒的最主要的抗体[4]。
本试验中,3组母猪初乳均为阳性,但弱毒疫苗组母猪初乳中有最高的IgA抗体,联合疫苗组与灭活疫苗组相当,一定程度上佐证了上述理论,但与其他2组差异不显著,分析可能是由于弱毒疫苗口服后部分在消化道被降解而降低了效果。而IgG作为辅助指标,3组之间差异不明显,但均呈较高阳性。3组母猪初乳中和抗体差异显著,弱毒疫苗组平均中和效价显著高于联合疫苗组和灭活疫苗组,且仅免疫一次弱毒苗的联合疫苗组中和抗体也显著高于完全使用灭活疫苗的灭活疫苗组,说明口服本弱毒疫苗效果较好,显著优于灭活苗。分析认为灭活疫苗存在固有劣势,免疫效果不确实,免疫效力相对较弱,所能激发的局部黏膜免疫十分有限。另外,PEDV S基因变异频繁[5],已有研究表明临床出现变异株,与商品灭活疫苗所使用的CV777毒株之间存在较大变异,一定程度上也影响该灭活疫苗临床使用效果。
就免疫后临床效果观察及比较生产成绩方面,弱毒疫苗组母猪所产仔猪少数出现腹泻,联合疫苗组仔猪无腹泻情况,精神良好,而灭活疫苗组超过50%仔猪仍出现腹泻、食欲不振及消瘦现象,与抗体水平结果基本保持一致。由于新生仔猪腹泻后多在2~4 d内死亡[6],因此本研究统计各组母猪产后7 d窝均活仔数和存活率。产后7 d存活率窝均活仔数与存活率最高的为联合疫苗组,与弱毒疫苗组差异不显著,但存活率指标与灭活疫苗组差异显著,说明联合疫苗组与弱毒疫苗组免疫程序均能对仔猪提供优于灭活疫苗组的保护力。
综合看来,母乳中抗PEDV特异性抗体水平越高,中和抗体水平越高,仔猪腹泻率越低,对应仔猪存活率也相应越高,使用本实验室试制的弱毒疫苗与商品灭活苗的联合疫苗组或单独使用该弱毒疫苗的弱毒疫苗组免疫方案相对较好,明显优于灭活疫苗组。该弱毒疫苗通过口服免疫虽然可以更好地激发肠道局部黏膜免疫,但如何合理的解决致弱病毒安全通过自口腔开始前往肠道的过程问题,还有待继续研究。同时,提示猪场需及时关注临床PEDV变异情况,且应加快PEDV新型疫苗的研发速度。
[1] 丁振江,库旭钢,闫贵伟,等. 猪流行性腹泻IgA抗体间接ELISA检测方法的建立[J].畜牧与兽医,2014(11):1-5.
[2] 张坤,何启盖.猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪A群轮状病毒多重RT-PCR检测方法的建立及临床应用[J].畜牧兽医学报,2010,41(8):1001-1005.
[3] Song D S, Park B K,et al.Oral efficacy of Vero Cell Attenuated Porcine Epidemic Diarrhea Virus DR13 Strain[J]. Res Vet Sci, 2007. 82(1): 134-140.
[4] De Arriba M L,Carvajal, Pozo J,et al.Mucosal and systemic isotypespeci- fic antibody responses and protection in conventional pigs exposed to virulent or attenuated porcine epidemic diarrhea virus[J]. Vet Immunol Immunopathol,2002. 85:85-97.
[5] Sun M, Ma J, Wang Y,et al. Genomic and epidemiological characteristics provide new insights into the phylogeographical and spatiotemporal spread of porcine epidemic diarrhea virus in Asia. Journal of clinical microbiology. 2015;53:1484-92.
[6] 甘振磊,汤德元,李春燕,等. 猪流行性腹泻流行特点及流行现状的研究[J].猪业科学,2010,27(12):24-28.
2015-09-24)
国家生猪产业技术体系(CARS-36)
邹运乾(1991-),男,湖北荆州人,硕士,研究方向:动物传染病。
何启盖,男,教授,博士生导师,从事动物细菌性及病毒性传染病研究,E-mail:he628@mail.hzau.edu.cn
