雄激素受体基因腺病毒载体的构建及对人毛乳头细胞增生的影响
2015-12-23兰雪梅钟白玉杨希川
兰雪梅,谭 欢,钟白玉,冯 林,杨希川
雄激素性脱发(androgenetic alopecia)是一种常见的脱发性疾病,其发病机制主要涉及脱发区雄激素受体(AR)表达增加、AR 活性增加、Ⅱ型5α 还原酶活性增加、下游细胞因子分泌异常等[1]。除毛囊干细胞[2],毛乳头细胞(DPC)对毛囊的形态学发生及周期性生长调控具有重要的意义。体外培养人DPC,传代至3 代以后DPC 表达AR 的能力逐渐减弱[3], DPC 作为雄激素性脱发的体外研究模型的可靠性有待进一步的提高。本研究通过构建AR 过表达腺病毒载体,并且转染DPC,为体外研究雄激素性脱发提供更理想的研究模型。
1 材料和方法
1.1 材料
1.1.1 标本来源 标本来源于整形科手术且患有男性雄激素性脱发患者的顶部头皮。
1.1.2 主要试剂 AR 基因质粒(重庆金麦生物技术有限公司),胶原酶(Sigma 公司),分离酶(Sigma公司),AR 抗体为兔抗人单克隆抗体(Abcam 公司),CCK-8 试剂盒(碧云天公司),胎牛血清(Gibco 公司)。
1.2 方法
1.2.1 AR基因重组质粒的构建、腺病毒的包装及扩增 BglⅡ、XbaⅠ双酶切穿梭载体Adtrack-CMV及AR目的基因,酶切质粒转化E.coli DH10B细胞。筛选出具有抗卡那霉素的质粒,命名为Adtrack-AR。将鉴定正确的质粒用PmeⅠ线性化, pAdeasy和线性化的Adtrack-AR共电转感受态细菌BJ5183中,筛选出卡那霉素+氨苄青霉素+链霉素抗性的质粒,最终获得pAdeasy-Adtrack-AR酶切产物。将回收质粒转染密度为70%~80%的293T细胞,6~8 h后换含1%FBS的培养基,每日观察荧光的变化,待荧光增多,2/3细胞浮起时离心收集病毒液,将收集的病毒液加入密度为80%左右的293T细胞中,最后将收集的病毒液-80 ℃反复冻融3~5次,使细胞成分破裂,病毒释放出来,上清即为病毒原液。
1.2.2 二步酶法分离及培养 头皮标本用PBS 反复冲洗并剃净毛发,以无菌含1%青霉素-链霉素的D-hanks 液漂洗3 ~5 次,每次5 min。分离皮下筋膜,用无菌手术剪剪成0.3 ~0.5 cm 宽、3 ~4 cm 长的皮条,弃去真皮部分,将皮下脂肪保留。加入0.5%的分离酶4 ℃浸泡过夜,再放入37 ℃恒温冰箱消化30 min,D-hanks 液清洗及挤出毛干,再将脂肪条剪成浆糊状,加入0.2%Ⅳ型胶原酶37 ℃消化4 ~6 h,当出现梨形的毛乳头时即可终止消化。最后离心获得毛乳头,接种于含1%FBS 的高糖DMEM 培养基中,在37 ℃、5%CO2条件下培养。3 ~6 代毛乳头细胞用于实验。
1.2.3 免疫荧光检测AR的表达 将DPC接种于6孔板盖玻片上,制作细胞AR重组腺病毒转染DPC的细胞爬片,加入AR抗体4 ℃过夜,加入FITC标记的二抗,孵育,封片,最后共聚焦显微镜下观察转染情况。
1.2.4 蛋白质印迹法(Western blot) 收集AR 重组腺病毒组、空载体腺病毒组、对照组(未添加病毒)的DPC,加入蛋白裂解液,收集蛋白,AR 单克隆抗体孵育过夜,二抗孵育。
1.2.5 CCK-8法 AR重组腺病毒组、空载体腺病毒组、对照组分别于转染后48 h加入10 μl的CCK-8溶液,37 ℃培养箱孵育1 ~4 h,酶标仪450 nm处测吸光度(A)值。
1.3 统计学方法
AR 蛋白灰度值除以内参蛋白灰度值得到A 值,即AR蛋白的相对含量,以均数±标准差表示。应用SPSS 18.0统计软件进行分析,多组均值比较用单因素方差分析,P <0.05 表示差异有统计学意义。
2 结果
2.1 pAdeasy-Adtrack-AR腺病毒载体的鉴定
质粒由重庆金麦生物技术有限公司测序,证实pAdeasy-Adtrack-AR 腺病毒载体的序列正确,说明AR 基因的重组腺病毒载体构建正确。
2.2 第3、6、9代毛乳头细胞AR检测
同一瓶原代DPC 传代至3、6、9 代,然后进行蛋白质印迹检测。3 代DPC 的AR A 值(0.466±0.131)明显高于6 代(0.209±0.051)及9 代(0.334±0.11)DPC 的AR A 值,且3 代AR A 值与6 代AR A 值差异有统计学意义(P=0.025),表明在传代过程中AR蛋白的表达量不稳定(图1)。
2.3 腺病毒转染后免疫荧光检测
重组腺病毒组于转染后48 h 在共聚焦显微镜下观察病毒转染效率,转染效率达80%以上(图2)。
2.4 腺病毒转染后蛋白质印迹检测

图1 第3、6、9代毛乳头细胞AR表达电泳图
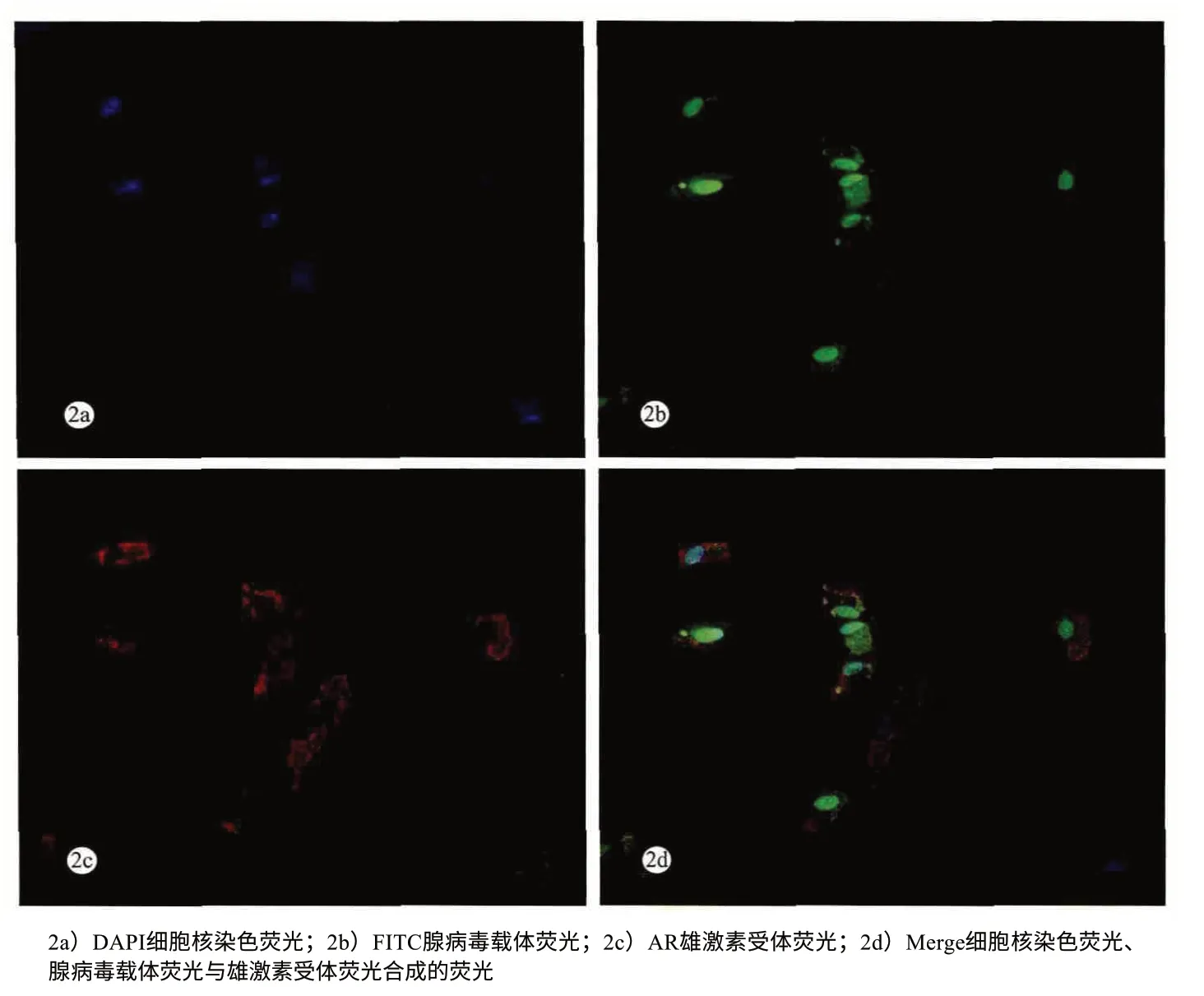
图2 AR重组腺病毒组转染48 h后免疫荧光图(×200)
腺病毒转染DPC 后24、48、72 h 分别检测其AR 的表达量。重组腺病毒转染后48 h 时,AR 蛋白的表达量明显升高,转染72 h 时AR 蛋白的表达量较48 h 时明显降低,转染后48 h 组与空载体组、空白对照组、转染后24 h 组、转染后72 h 组相比差异有统计学意义(P=0.006),说明转染后48 h AR 表达最高(表1,图3)。

表1 AR重组腺病毒转染后蛋白质印迹检测AR的表达

图3 各组DPC转染后AR的表达电泳图
2.5 腺病毒转染后CCK-8法检测
腺病毒转染后24、48、72 h,采用CCK-8 法检测其对DPC 增生的影响。AR 重组腺病毒组、空载腺病毒组、对照组DPC 细胞增生率差异无统计学意义(表2)。

表2 AR重组腺病毒转染后CCK-8检测结果
3 讨论
雄激素性脱发的发病依赖于多种因素,包括遗传、雄激素量、雄激素受体、Ⅱ型5α 还原酶等[4]。研究发现雄激素性脱发的发病与血液循环中的雄激素量无关,而与局部的雄激素量有关。毛囊是雄激素的作用位点,同时它作为一个外周器官可通过自分泌或旁分泌的形式合成雄激素。在头皮顶部雄激素由Ⅱ型5α 还原酶转变为双氢睾酮,后者与雄激素受体结合导致了雄激素性脱发的发生。雄激素性脱发患者头顶部Ⅱ型5α 还原酶的含量高于健康志愿者[5],由于头皮局部Ⅱ型5α 还原酶的差异导致了头皮枕部及顶部毛发生长存在差异。有研究者发现雄激素性脱发患者头顶部DPC 内AR 的量要明显高于正常人头顶部[6]。在雄激素性脱发发病机制中,AR 和Ⅱ型5α 还原酶均作为发病的关键调控点[7]。
AR 是一种细胞内转录因子,它属于类固醇/核受体超家族[8]。AR 由热休克蛋白70、90、56 组成,当雄激素与AR 相结合后热休克蛋白分解,从而暴露了核转录信号,使雄激素受体配体复合物运输至核内,进而与雄激素调控基因相结合[9]。在此过程中刺激或抑制信使蛋白或者AR,均可以刺激或者抑制毛囊的生长[10]。
本次实验观察到,第6 代DPC 内的AR 明显降低,从而影响了体外研究雄激素性脱发的发病机制的可靠性。并且既往研究证实了DPC 传代至第3 代以后AR 的表达量会逐渐降低甚至消失[11]。与文献报道不同的是,本实验同一瓶细胞传至第9 代时,AR 的表达量较第6 代DPC 的AR 量升高,但两者的差异无统计学差异,可能是由于AR 的合成还存在着一定的代偿机制。
蛋白质印迹检测结果显示,毛乳头细胞转染AR重组腺病毒载体后,AR 蛋白的表达量较对照组及空载体组会升高,尤其在转染后48 h,充分说明了AR重组腺病毒载体构建成功。当腺病毒转染毛乳头细胞72 h 后,AR 蛋白表达下降,这可能是由于腺病毒不整合至毛乳头细胞的基因组,病毒基因组在宿主细胞内不能进行扩增,AR 基因瞬时表达,因而AR 的表达最终会因为细胞的增生分裂而稀释;也可能是由于有负反馈调节机制参与AR 基因的复制、转录、翻译。
在既往研究中,当干扰前列腺癌细胞中AR 的表达时,前列腺癌细胞的增生率会下降[12]。而在本次实验中,AR 重组腺病毒载体未抑制毛乳头细胞的生长,说明转染并未明显影响DPC 的正常增生功能,且更能接近毛乳头细胞的正常生理状态。
在以往的研究中,研究者通过AR 质粒型表达载体来弥补毛乳头细胞AR 基因衰减这一难题,但是前者的转染效率低[11,13],且转染困难。本实验通过构建AR 重组腺病毒载体,转染效率高,在一定程度上为研究雄激素性脱发提供了更理想的体外研究模型。但是本研究也存在一定的局限性:腺病毒表达系统仅瞬间表达,AR 基因不能稳定表达,不能完全解决AR 蛋白随着传代而衰减的问题,可以通过重复瞬时转染腺病毒或者通过构建AR 慢病毒载体来进行下一步的研究;并且本次实验着重以AR 为研究点,而未全面涉及到雄激素性脱发发病的其他因素,AR 表达量增加是否会影响Ⅱ型5α 还原酶的表达,是否使下游信号通路发生转变[14],还有待今后进一步的研究。
[1] Inui S, Itami S. Molecular basis of androgenetic alopecia: From androgen to paracrine mediators through dermal papilla [J]. J Dermatol Sci, 2011, 61(1):1-6.
[2] Leiros GJ, Attorresi AI, Balana ME. Hair follicle stem cell differentiation is inhibited through cross-talk between Wnt/β-catenin and androgen signalling in dermal papilla cells from patients with androgenetic alopeciaa [J]. Br J Dermatol, 2012, 166(5):1035-1042.
[3] Kwack MH, Sung YK, Chung EJ, et al. Dihydrotestosterone-inducible dickkopf 1 from balding dermal papilla cells causes apoptosis in follicular keratinocytes [J]. J Invest Dermatol, 2008, 128(2):262-269.
[4] Piraccini BM, Alessandrini A. Androgenetic alopecia [J]. G Ital Dermatol Venereol , 2014, 149(1):15-24.
[5] Bayne EK, Flanagan J, Einstein M, et al. Immunohistochemical localization of types 1 and 2 5alpha-reductase in human scalp [J]. Br J Dermatol, 199,141(3):481-491.
[6] Urysiak-Czubatka I, Kmieć ML, Broniarczyk-Dy a G. Assessment of the usefulness of dihydrotestosterone in the diagnostics of patients with androgenetic alopecia [J]. Postepy Dermatol Alergol, 2014, 31(4):207-215.
[7] 郭金竹, 李邻峰. 雄激素性秃发治疗进展 [J]. 实用皮肤病学杂志, 2012, 5(6):347-350.
[8] Lavery DN, Villaronga MA, Walker MM, et al. Repression of androgen receptor activity by HEYL, a third member of the Hairy/Enhancer-of-split-related family of Notch effectors [J]. J Biol Chem, 2011, 286(20):17796-17808.
[9] Jehle K, Cato L, Neeb A, et al. Coregulator control of androgen receptor action by a novel nuclear preceptor-binding motif [J]. J Biol Chem, 2014, 289(13):8839-8851.
[10] Chang C, Yeh S, Lee SO, et al. Androgen receptor(AR) pathophysiological roles in androgen-related diseases in skin, bone/muscle, metabolic syndrome and neuron/immune systems: lessons learned from mice lacking AR in specific cells [J]. Nucl Recept Signal, 2013, 11:e001.
[11] Inui S, Fukuzato Y, Nakajima T, et al. Identification of androgeninducible TGF-beta1 derived from dermal papilla cells as a key mediator in androgenetic alopecia [J]. J Investig Dermatol Symp Proc, 2003, 8(1):69-71.
[12] 颜艳灵, 钟雪云, 钟振宇, 等. 利用RNA干扰技术研究雄激素受体在人前列腺癌细胞增殖中的作用 [J]. 中国病理生理杂志, 2004, 20(4):580-583.
[13] Itami S, Inui S. Role of androgen in mesenchymal epithelial interactions in human hair follicle [J]. J Investig Dermatol Symp Proc, 2005, 10(3):209-211.
[14] Yang YC, Fu HC, Wu CY, et al. Androgen receptor accelerates premature senescence of human dermal papilla cells in association with DNA damage [J]. PloS One, 2013, 8(11):e79434.
