ELISA鉴别条件下的野生羊肚菌菌种分离方法*
2015-12-23肖江勇何秀霞刘春洋王一东
肖江勇,何秀霞,王 丹,刘 欢,刘春洋,王一东
(长春理工大学生命科学技术学院,吉林 长春 130022)
〈育种与驯化〉
ELISA鉴别条件下的野生羊肚菌菌种分离方法*
肖江勇,何秀霞,王 丹,刘 欢,刘春洋,王一东**
(长春理工大学生命科学技术学院,吉林 长春 130022)
为了提高分离的羊肚菌菌种的可靠性,在传统菌种分离的基础上,增加了酶联免疫吸附试验(ELISA)鉴别检验。对采自于吉林省吉林市的野生羊肚菌发生地的羊肚菌土壤基质及子实体分别进行了菌种分离,对分离得到的3株疑似羊肚菌的菌株进行了间接酶联免疫吸附法(间接ELISA)免疫学方法检测,确定其中的2株纯培养菌丝为羊肚菌菌种。
羊肚菌;酶联免疫吸附试验(ELISA);菌种分离
羊肚菌(Morchella)是世界知名的食用菌,属于子囊菌亚门 (Ascomycotina)、盘菌纲 (Discomycetes)、盘菌目 (Pezizales)、羊肚菌科(Morchellaceae)、羊肚菌属(Morchella),因其味美、稀缺、具有保健价值而受到人们的重视,具有巨大的市场价值和商业前景[1-2]。由于羊肚菌出菇所需要条件很难掌握,目前还难于实现完全人工栽培[3-8]。影响羊肚菌人工栽培的诸多因素中,羊肚菌菌种的分离与采用是关键因素之一。有效、准确地分离菌种对实现羊肚菌的人工栽培意义重大[9]。由于出菇周期较长,不易出菇,且缺少形态学鉴别手段,这给羊肚菌菌种的鉴定造成了一定困难。目前有研究报道对羊肚菌ITS区测序来鉴定羊肚菌菌丝的方法[10-11],这样的检测技术虽然精确,但操作手续繁琐,对设备要求高,不便于广大羊肚菌研究者及菇农使用,本研究所采用的ELISA免疫学鉴定方法[12-14],可弥补这一不足。
1 材料与方法
1.1材料
1.1.1 标准菌株、羊肚菌子实体及土壤样本
羊肚菌(Morehella esculenta)菌株(51589号),购于中国农业微生物菌种保藏中心。
毛柄金钱菌(Flammulina velutiper)菌种、黑木耳(Auricularia auricula) 菌种,购于吉林农业大学菌物研究所。
野生羊肚菌子实体及其发生地土壤样本,2012年5月采自于吉林市松花湖地区,现保存于本实验室。
1.1.2 主要试剂
HRP标记山羊抗鼠IgG(H+I),购于北京中杉金桥生物技术有限责任公司;TMB,Sigma公司产品;培养基,用于普通真菌菌丝培养的马铃薯培养基(PDA);抗羊肚菌单克隆抗体(W8C9株腹水),长春理工大学生命科学技术学院制备并保存于该实验室[15]。
1.1.3 主要仪器与设备
HZQ-QX型恒温振荡培养箱、MDF-192型低温冰箱,SANYO公司;ELx800TM酶标仪,美国伯腾仪器有限公司,等。
1.2方法
1.2.1 标准羊肚菌菌丝的培养及标准抗原的制备
将51589号羊肚菌菌种在无菌条件下转接到PDA液体培养基中培养,转速110 r·min-1、温度23.5℃。3 d后在无菌条件下挑取少量培养液转接至PDA固体平皿中进行培养,观察菌落形态,镜下观察菌丝形态。
对上述PDA液体培养基培养获得的菌丝球进行离心收集,将收集的菌丝放入研钵中,加适量的灭菌海砂及pH7.4的磷酸盐缓冲液(以下简称PBS),进行充分研磨破碎,收集研磨后液体进行离心,5 000 r·min-1离心5 min,离心上清液即为羊肚菌抗原原液。用同样的方法制备金针菇及木耳抗原液。
1.2.2 ELISA间接法检测羊肚菌抗原方法的建立
包被:将羊肚菌抗原原液用0.05 mol·L-1pH9.6的碳酸盐包被缓冲液进行适量稀释,在酶标板每孔中加入0.1 mL,4℃包被过夜,弃去孔内溶液,用含有吐温20的PBS(以下简称PBS-T)洗涤缓冲液浸泡、冲洗3次,3 min·次-1。同时做金针菇、木耳及空白包被对照。
将抗羊肚菌单克隆抗体W8C9使用PBS进行适量稀释(一抗),于上述已包被的反应孔中每孔加0.1 mL,置于37℃温育1 h,PBS-T洗涤4次,3 min·次-1。
将HRP标记的山羊抗鼠IgG用PBS稀释3 000倍(二抗),于每个反应孔中加入0.1 mL,37℃温育50 min,PBS-T洗涤4次,3 min·次-1。
在各反应孔中加入现配的底物TMB显色液0.1 mL,室温下避光反应10 min。
终止反应,在各个孔中加入0.05 mL 2 mol·L-1的硫酸。
结果检测,利用酶标仪检测450 nm波长处OD值。
1.2.3 野生羊肚菌菌种分离
(1)土壤基质菌种分离法
将土壤基质样本用无菌生理盐水按10-1、10-2、10-3、10-4、10-5、10-6不同稀释度,稀释成土壤样本悬液,无菌条件下用无菌移液器分别由上述稀释液中各吸取0.1 mL,加入到已标记好稀释度的固体PDA平皿中进行涂布;挑取10-1的土壤悬液,直接在平皿上进行划线分离,室温下避光进行培养,观察。
(2)子实体孢子分离法
用新鲜羊肚菌子实体,在无菌条件下收集羊肚菌孢子,将收集的孢子制成孢子悬液并镜检,并用无菌移液器吸取孢子液0.1 mL加入到平皿培养基中进行涂布,室温下避光培养,观察。
(3)分离疑似羊肚菌菌落
无菌挑取上述平皿上疑似羊肚菌的白色菌落进行显微检查,将疑似羊肚菌的菌落做好标记后,分离培养并接种至PDA液体培养基中进行培养,收集培养物,参照标准抗原的处理方法,按标号制备成待检抗原。
1.2.4 ELISA间接法检测分离菌株
按方法1.2.2,将待检抗原替代标准羊肚菌抗原进行包被,其他步骤相同。检测待检样品的OD值,以P/N比(样本与阴性对照的OD值比值)≥2.1为阳性,<2.1为阴性。
1.2.5 菌种的扩大培养与保存
将经过常规菌种分离得到的疑似羊肚菌菌种,经ELISA检测,结果为阳性的菌株确定为分离得到的羊肚菌菌种。按编号接种至试管斜面培养基培养,待菌丝长出后,作为分离得到的羊肚菌菌种,转到4℃进行保存。
2 结果与分析
2.1标准羊肚菌菌丝形态
PDA液体培养基培养3 d开始形成菌丝球,初期为乳白色,此时培养液较为澄清,其菌丝在显微镜下为丝状体形态,具有隔膜,分枝较多,胞内的细胞器清晰可见。随着培养时间的加长,菌丝球逐渐增大,颜色变暗。
PDA固体平皿培养3 d开始出现白色菌落,7 d后菌丝长满。显微镜下可见气生菌丝相对营养菌丝较细,隔膜不明显,胞内细胞器亦清晰可见。
2.2ELISA间接法检测标准羊肚菌抗原方法的建立
采用ELISA间接法分别对标准羊肚菌抗原、木耳及金针菇进行检测,以P/N比≥2.1判定为阳性,结果见表1。
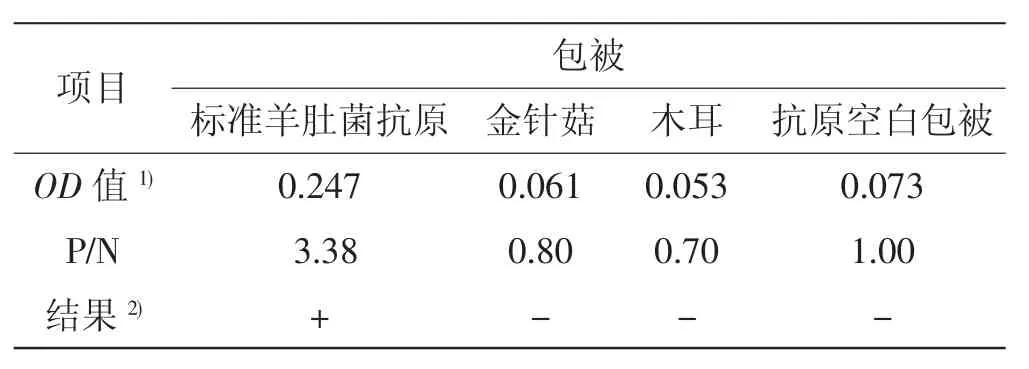
表1 ELISA间接法检测标准羊肚菌抗原结果Tab.1 The results of morel antigen detection by indirect ELISA
由表1可以看出,标准羊肚菌抗原经ELISA间接法检测后,显示出相对较高的阳性(以P/N>2.1为阳性),金针菇、木耳经过同浓度包被,其OD值与阴性对照相比(P/N比)的值远小于2.1,可见单抗W8C9与木耳、金针菇等食用菌之间没有交叉反应。经过多次检测,结果均表现较好的重复性。
2.3菌种分离结果
参照羊肚菌平皿菌落及菌丝显微形态,分离得到3个疑似羊肚菌菌丝的菌株,分别编号T-01、T-02、B-01。按照标准羊肚菌抗原的处理方法,处理得到3个对应编号的待检抗原,4℃保存。
2.4ELISA间接法鉴定分离菌株
采用ELISA间接法对分离的菌株进行检测,以P/N比≥2.1判定为阳性,检测结果见表2。
由表2可见,以标准羊肚菌抗原为阳性对照,抗原空白包被为阴性对照进行了ELISA间接法检测,检测结果显示T-01、B-01为阳性,T-02、金针菇、木耳为阴性(以P/N>2.1为阳性)。经过多次检测,结果均表现出较好的重复性,确定T-01、B-01为羊肚菌菌丝。对分离得到的T-01、B-01羊肚菌菌株进行菌种扩大,保存。

表2 ELISA间接法检测分离菌株检测结果Tab.2 The results of isolated stains detection by indirect ELISA
3 讨论
与传统的担子菌食用菌菌种分离不同,由于羊肚菌还不能实现完全人工栽培,不易通过栽培出菇的形态学方法对分离的菌种进行鉴定,因此对其菌种的分离鉴定就显得尤为困难。本研究对野生羊肚菌样本材料进行常规菌种分离,对分离得到的疑似菌株进行免疫学方法检测,排除了无羊肚菌特异性抗原的疑似菌株,确定了2株含有羊肚菌特异性抗原的纯培养物为羊肚菌菌种。
本研究所用的W8C9株单克隆抗体,是以51589号羊肚菌菌种为抗原,经细胞融合筛选得到的单克隆杂交瘤细胞株制得,对该单克隆抗体进行多次该单抗与其他羊肚菌标准菌株(51536#、51537#)及近10种常见食用菌菌丝抗原交叉试验,检测结果表明该单抗对标准羊肚菌菌丝及采集的羊肚菌子实体样本表现出良好的特异性结合、与其他食用菌不结合。本实验中表1即为特异性检验的结果。
与常规检测抗原的双抗体夹心ELISA法相比,间接ELISA法在检测少量抗原样本时具有方法简单、影响因素少、成本低、快速的特点,故本研究采用间接ELISA法进行羊肚菌菌丝的鉴别检测。
本研究方法的建立,为羊肚菌菌种的快速鉴别提供了一个可行的参考方法,同时也为更加便捷快速的羊肚菌金标检测试纸条、ELISA快速定量检测试剂盒等免疫学方法的建立提供实验参考。
实验中发现从羊肚菌子实体孢子分离得到的羊肚菌菌丝,在固体培养基培养初期菌丝为白色,随着培养时间的延长,其菌丝连同培养基颜色转变为褐色,与有关研究报道相符;但购买的标准羊肚菌菌丝和羊肚菌基质土壤分离得到的菌丝,在固体培养基上培养始终呈现为白色,引起这种差别的原因,有待进一步探讨。
在实验中还发现,无论是标准羊肚菌菌种还是经分离鉴定为羊肚菌的菌种,其在液体培养基中培养及处理得到的抗原过程中,均散发着一股独特的清香气味,这可能与羊肚菌分泌的挥发性氨基酸有关。这种现象可否作为实际工作中羊肚菌菌丝的快速鉴定指标之一还有待验证。
[1]朱林,程显好,田吉腾.羊肚菌的研究进展[J].安徽农业科学,2008,36(10):4054-4057.
[2]谢占玲,谢占青.羊肚菌研究综述[J].青海大学学报:自然科学版,2007,25(2):36-40.
[3]朱斗锡.羊肚菌人工栽培研究进展[J].中国食用菌,2008,27(4):3-5.
[4]李华,包海鹰,李玉.羊肚菌研究进展[J].菌物研究,2004,2(4):53-60.
[5]Brock TD.Studies on culture of Morchella[J].Mycologia,1951(43):402-422.
[6]马向东.食用菌栽培新技术[M].开封:河南大学出版社,2002:270.
[7]Ower R.Notes on the development of the morel aseoea RP:Morchella esculenta[J].Myeologia,1982,74(1):35-38.
[8]戴玉淑,徐方杰,赵艳春.羊肚菌的栽培技术[J].中国农村小康科技,2008(3):40-41.
[9]王广耀,蒋晓成,程喆.羊肚菌菌种分离及母种培养基的筛选[J].食用菌,2009(9):211-214.
[10]沈洪,陈明杰,赵永昌,等.云南羊肚菌rDNA的ITS序列与亲缘关系分析[J].食用菌学报,2007,14(2):15-18.
[11]Daniel Wipe,JC Munch,B Botton,etc.DNA polymorphism in morels:complete sequences of the internal transcribed spacer of genes coding for rRNA in Morchella esculenta (Yellow Morel) and Morchella conica (Black Morel)[J]. Applied And Environmental Microbiology,1996:3541-3543.
[12]田雪,刘建,孙桦男,等.以羊肚菌茵丝为抗原的不同免疫程序对Balb/c鼠抗体水平的影响[J].长春理工大学学报:自然科学版,2012,35(1):156-160.
[13]于秋丽,赵晓娥,胡林勇,等.间接EILSA法检测羊促乳素抗体方法的建立[J].西北农林科技大学学报:自然科学版,2009,37(2):48-50.
[14]马帅,陈华林,王雅文,等.免疫酶染色法对羊肚菌菌丝特异性靶位的初步定位与分析[J].菌物研究,2014,12(6):115-118.
[15]王一东,刘建.一株抗羊肚菌单克隆抗体及其制备方法:中国,200910218152.8[P].2010-06-09.
云南:昆明食用菌研究所努力促进产业升级转型
据悉,昆明食用菌研究所多举措服务于特色食用菌产业的“最后一公里”,为云南高原特色食用菌产业升级转型发展夯实了基础。
据了解,该研究所先后构建完善食用菌技术支撑研发平台4个,改造建设食用菌资源库、优良菌种选育、精深加工和新产品开发、检验检测服务等实验室400多平方米,配套购置仪器19件(台)。并建立4个首席科学家牵头的技术服务团队,设立5个专家工作站和技术服务组,选派5组10个科技特派员,开展包括人工栽培食用菌、食用菌精深加工、羊肚菌原生境扩繁促产、野生食用菌保护利用、人工食用菌高产优质栽培5个方面的技术指导、培训及技术服务。
同时,该研究所还建设了培育食用菌良种繁育及新品种(菌种)栽培、食用菌标准化栽培、食用菌精深加工等3个示范基地,在昆明双龙、马龙等地改造大棚33 000多平方米;在昆明双龙、永胜、马龙、保山施甸等地建立香菇、平菇、木耳、金针菇、双孢菇等栽培示范基地15个,示范面积60多万平方米,生产优质菇逾2 200 t;在野生食用菌主产区,建立松茸、羊肚菌、牛肝菌、大红菇等野生食用菌保护培育及扩繁基地13个,面积超过8 400亩。
此外,该研究所还筛选了食用菌良种19个:黑木耳良种3个、香菇良种7个、茶树菇良种6个、平菇良种1个、金针菇良种1个、金耳优良菌种1个;建立了食用菌良种繁育生产线1条,年产300万瓶(袋)以上,完成优良菌种制种200万瓶(袋),示范良种配套栽培20万平方米。同时,还开展了食用菌精深加工研发示范,研发产品42个,共计生产5 050 t。研究所还制(修)食用菌菌种生产技术规程5项,食用菌标准化生产技术规程6个,企业标准3项,通过标准的实施服务菇农2 0000多人次。
中国食用菌信息网
2015.04.30
The Methods of Vegetative Mycelium Isolated from Wild Morchella under the Identification of ELISA
XIAO Jiang-yong,HE Xiu-xia,WANG Dan,LIU Huan,LIU Chun-yang,WANG Yi-dong
(Changchun University of Science and Technology,School of Life Science and Technology,Changchun 130022,China)
In order to improve the dependance of strains isolation from the Morchella,the ELISA was added to identification on the basis of traditional strains separation.Isolating strains from fruit body and the soil collected from Jilin.Three strains that were similar to Morchella hyphae have been got.The uncertain isolated strains were detected by the way of ELISA.Two of them were proved to be Morchella.
Morel;Enzyme-linked immunosorbent(ELISA);strains isolation
S646.9
A
1003-8310(2015)03-0011-04
10.13629/j.cnki.53-1054.2015.03.003
长春理工大学“大学生创新创业训练计划项目”(2012S46、2013x108)。
肖江勇(1990-),男,本科,研发工程师,主要从事珍稀食药用真菌栽培研究。E-mail:XJY_job5983@163.com
**通信作者:王一东(1962-)男,本科,高级实验师,主要从事食品与卫生检验研究。E-mail:wyd@cust.edu.cn
2015-03-10
