分子印迹聚合物在傅克酰基化反应中的底物识别性和区位选择性
2015-12-22吴萃艳祝贞科银董红
吴萃艳,祝贞科,谭 蓉,银董红
(湖南师范大学化学化工学院,石化新材料与资源精细利用国家地方联合工程实验室,中国长沙 410081)
邻乙酰基苯甲醚作为重要的精细化工产品和有机合成中间体,被广泛应用于染料,医药,农药,塑料,化妆品等领域.傅克酰基化反应是合成芳酮最有效的方法之一,具有反应简单及选择性高等优点[1].Lewis 酸(AlCl3,FeCl3,TiCl4,BF3等)或质子酸(HF,H2SO4,HCl)[2]通常用于催化苯甲醚乙酰化反应制备乙酰基苯甲醚.但传统苯甲醚乙酰化催化反应体系中产物大多为对位酰基化产物,几乎得不到邻位酰基化产物[3].因此,提高苯甲醚乙酰化反应中邻乙酰基苯甲醚的选择性具有非常重要的理论意义和实际应用价值.
自从Dickey 提出了“分子印迹”这一概念以来[4],以分子识别为基础的新型材料在催化合成、手性物质分离和环境分析中潜在的应用价值引起了许多领域的关注,成为国内外研究的热点[5-7].分子印迹技术(Molecular imprinting technique,MIT)是以目标分子为模板分子,将具有结构上互补的功能化聚合物单体通过共价键或非共价键与模板分子结合,并加入交联剂进行聚合反应,反应完成后洗脱模板分子,获得在空间立体结构和结合位点上与模板分子完全匹配的分子印迹聚合物(Molecularly imprinted polymer,MIP).Wulff[8]和Mosbach[9]分别在共价型分子印迹技术和非共价型分子印迹技术方面做出了开创性的工作.分子印迹聚合物的选择性识别位点和印迹空穴赋予其专一识别性、构变预定性及高度选择性[10].因此,通过选择合适的模板分子,可制备出具有专一分子识别功能的分子印迹聚合物,即可实现有机合成反应中高区位选择性[11-12].
Alexander 等[13]以硼酯为底物类似物模板,制备出对类固醇乙酰化具有高选择性的分子印迹聚合物,使三元类固醇酯在特定的羟基处有选择性的酰基化.此外,分子印迹聚合物具有亲和位点的可接近性、机械稳定性和热稳定性等优点,更显示出其在催化和有机合成领域的巨大潜力[14-17].
基于分子印迹技术,本文首次以2-乙酰基环己酮与Co(Ⅱ)的配合物为模板,制备对苯甲醚乙酰化反应的邻位产物有一定识别性能的Co(Ⅱ)配位分子印迹聚合物Co(Ⅱ)-MIP.目的在于考察在苯甲醚乙酰化反应中,Co(Ⅱ)-MIP 的底物识别性以及基于区位选择性,为在傅克反应中得到特殊位点取代的产物提供高效的催化试剂.
1 实验部分
1.1 试剂与仪器
甲基丙烯酸(MAA),4-乙烯基吡啶(4-VP),二乙烯基苯(DVB),2-乙酰基环己酮,氯化钴均为Alfa Aesar试剂;苯甲醚,乙酰氯,乙酸酐,苯乙酰氯,三氯化铝,偶氮二异丁腈(AIBN)为国产药品;反应溶剂经Na 或CaH2除水后使用.产物用Agilent 6890 型气相色谱仪分析,并采用GC-MS(HP5790)对产物进行定性分析.
1.2 分子印迹聚合物的制备
1.2.1 Co(Ⅱ)-MIP 的制备 Co(Ⅱ)-MIP 的制备如图1所示.取4 mmol 2-乙酰基环己酮与2 mmol 氯化钴溶于7.5 mL 氯仿中,振荡静置形成配合物,向该氯仿溶液中加入8 mmol 4-乙烯基吡啶,然后加入40 mmol二乙烯基苯及0.1 g AIBN,充分振荡摇匀,将溶液转移至50 mL 硬质试管中,超声,通氮除氧15 min,真空封管,60 ℃热引发聚合.聚合物研碎后过200 目筛,用丙酮倾泻法除去过细颗粒,用甲醇和乙酸(体积比7∶3)混合液作洗脱液,索氏提取,直至洗液中紫外光谱检测不出模板分子的特征吸收峰,在40 ℃真空干燥24 h,得钴配位分子印迹聚合材料Co(Ⅱ)-MIP[18].

图式1 Co(Ⅱ)-MIP 的制备Scheme 1 Procedures for the preparation of the Co(Ⅱ)-MIP
1.2.2 MIP 和NIP 的制备 取4 mmol 2-乙酰基环己酮溶于7.5 mL 氯仿中,向该氯仿溶液中加入8 mmol 甲基丙烯酸,然后加入40 mmol 二乙烯基苯及0.1 g AIBN,充分振荡摇匀,将溶液转移至50 mL 硬质试管中,超声,通氮除氧15 min,真空封管,60 ℃热引发聚合.聚合物研碎后过200 目筛,用丙酮倾泻法除去过细颗粒,用甲醇和乙酸(体积比7∶3)混合液作洗脱液,索氏提取洗脱模板分子,直至洗液中用紫外光谱检测不出模板分子,洗脱后,40 ℃真空干燥24 h,得普通分子印迹聚合物MIP(见图式2)[19].

图式2 MIP 的制备Scheme 2 Procedures for the preparation of the MIP
参考分子印迹聚合物(空白聚合物NIP)的制备除不加模板分子外其他操作与MIP 的制备过程相同,但无须进行索氏萃取.
1.3 聚合物的表征
红外光谱测定在AVATAR 370 红外光谱仪上进行,摄取4 000~400 cm-1红外光谱,分辨率为2 cm-1.催化剂的形貌特征用扫描电子显微镜(JSM-6360LV)观察.样品的比表面积和孔结构,在液氮温度为-196 ℃,10-6mmHg 和80 ℃下脱气12 h,在TriStar 3000 物理吸附仪上测定.产物用GC-MS(HP5790)定性分析.产物分布用Agilent Technologies 6890 N 气相色谱分析,采用DP-35 毛细管柱(30 m× 0.25 mm),氢火焰检测器,N2作载气,检测器的温度为250 ℃.
1.4 傅克酰基化反应
将分子印迹聚合物(0~1.0 g),苯甲醚(1 mmol),酰基化试剂(1.5 mmol),AlCl3(0~3.0 mmol)和二氯甲烷(20 mL)加入50 mL 圆底烧瓶中,密封,60 ℃下搅拌6 h,然后倒入冰水-盐酸混合液中酸解.过滤后,将滤液用水和质量分数5%的碳酸氢钠洗至中性,用无水氯化钙干燥以备气相色谱分析.

图1 Co(Ⅱ)-MIP(a),MIP(b),NIP(c)和2-乙酰基环己酮(d)的红外光谱图Fig.1 IR spectra of the Co(Ⅱ)-MIP(a),MIP(b),NIP(c)and template(d)
2 结果与讨论
2.1 聚合物的表征
2.1.1 样品的FT-IR 表征 模板分子2-乙酰基环己酮,空白聚合物(NIP),普通分子印迹聚合物(MIP)和钴离子配位分子印迹聚合物(Co(Ⅱ)-MIP)的红外光谱表征见图1.
如图1所示,钴配位分子印迹聚合物(Co(Ⅱ)-MIP)在1 690 cm-1出现了 C=N 的吸收峰,在1 600~1 450 cm-1出现了吡啶环的骨架伸缩振动吸收[24],证实了Co(Ⅱ)-MIP 结构中吡啶作为功能结合位点的存在(Fig.1 a),普通分子印迹聚合物(MIP)在3 460 cm-1和1 700 cm-1处有明显的红外吸收峰为羧基结合位点的红外特征吸收峰,证明以羧基为结合位点的普通分子印迹聚合物(MIP)已成功合成(Fig.1 b).此外,MIP 和Co(Ⅱ)-MIP 的红外谱图中只有很弱的模板分子的红外特征吸收峰,证明模板剂分子已基本除去.空白聚合物(NIP)尽管表现出与分子印迹聚合物(MIP)类似的红外谱图,但是因聚合过程中没有加入模板剂,导致其不具有空间立体结构和结合位点的印迹孔穴(Fig.1 d).这与样品的SEM 结果一致.
2.1.2 样品的SEM 表征 为探究分子印迹在聚合物结构中造成的特定影响,获得有关孔穴的形貌和尺寸,用扫描电镜(SEM)进行微观形貌研究.图2 为空白聚合物(NIP)、普通分子印迹聚合物(MIP)和金属钴配位分子印迹聚合物(Co(Ⅱ)-MIP)的SEM 照片.可以看出,MIP 和Co(Ⅱ)-MIP 由于制备过程中,模板分子的使用改变了分子印迹聚合物的表面形貌,使得形成了较多的大空隙结构,而这些大孔结构中也包括印迹模板洗脱后留下的空穴.与之相比,空白聚合物(NIP)由于制备过程中没有印迹分子的参与,从SEM 照片上看不到明显的孔穴.该结果佐证了分子印迹聚合物的孔穴和模板分子的“锁”和“钥匙”的关系.

图2 NIP,MIP 和Co-MIP 的SEM 照片Fig.2 SEM images of the NIP,MIP and Co-MIP
2.1.3 分子印迹聚合物孔结构分析 表1 为空白印迹聚合物NIP,普通分子印迹聚合物MIP 和钴配位分子印迹聚合物Co(Ⅱ)-MIP 的孔结构分析.从表1 可以看出,MIP 和Co(Ⅱ)-MIP 的比表面积明显大于空白聚合物NIP,这说明有模板分子参与聚合时,聚合物去模板后留下更多的空穴结构,因此比表面积远大于NIP,而对比MIP 和Co(Ⅱ)-MIP,由于在Co(Ⅱ)的参与下形成了相对较大的模板分子,所以Co(Ⅱ)-MIP 的孔径和孔容都略大于MIP[20].
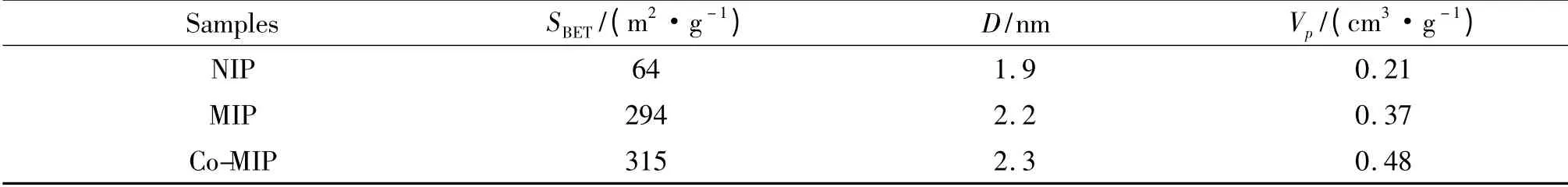
表1 样品NIP,MIP,Co(Ⅱ)-MIP 的物理性质Tab.1 Physical properties of the NIP,MIP and Co(Ⅱ)-MIP
2.2 催化反应研究
2.2.1 Co(Ⅱ)-MIP 的用量对苯甲醚邻位酰基化反应的影响 为了考察Co(Ⅱ)-MIP 的用量对苯甲醚酰基化反应的影响,选择乙酰氯为酰基化试剂与苯甲醚反应.从表2 可知,增加Co(Ⅱ)-MIP 的用量,苯甲醚的转化率逐渐降低,但是苯甲醚邻位产物的选择性逐渐提高,当Co(Ⅱ)-MIP 用量为1.0 g 时,邻甲氧基苯乙酮选择性达到9.1%.这是由于增加Co(Ⅱ)-MIP 用量有利于反应底物有效进入印迹空腔发生邻位酰基化反应.进一步增Co(Ⅱ)-MIP 用量,一方面导致AlCl3在聚合物的空腔外部被吡啶氮原子大量吸附络合;另一方面,过量的AlCl3也会造成聚合物空腔的堵塞[21],所以转化率和邻位产物选择性都出现下降趋势.

表2 Co(Ⅱ)-MIP 的不同用量对苯甲醚邻位酰基化反应的影响aTab.2 Effect of different amounts of Co(Ⅱ)-MIP on anisole acylation reactiona
2.2.2 反应时间对苯甲醚邻位酰基化反应的影响 以乙酰氯为酰基化试剂,考察了反应时间对Co(Ⅱ)-MIP 参与的苯甲醚邻位酰基化反应的影响,结果见表3.由表3 可见,随着时间的延长,苯甲醚转化率逐渐增加.反应6 h 时苯甲醚的转化率达到98%,且邻位产物2-甲氧基苯乙酮的选择性达到9.1%.这是因为反应时间的延长有利于底物扩散到印迹空腔中的与邻位产物匹配的识别位点结合,生成邻位酰基化产物;进一步延长反应时间,底物向空腔中的扩散速度下降,而在空腔外部反应,导致邻位选择性下降.

表3 反应时间对苯甲醚邻位酰基化反应的影响aTab.3 Effects of reaction time on anisole acylation reactiona
2.2.3 反应温度对苯甲醚酰基化反应的影响 反应温度对苯甲醚酰基化反应的影响较大(见表4).随着温度的升高,苯甲醚的转化率和邻位异构体产物选择性增强,在60 ℃时,苯甲醚的转化率达到98%,其中邻位产物2-甲氧基苯乙酮选择性达到最大值9.1%.这可能是因为温度升高,在室温下不能被利用的空腔由于聚合物的溶胀而被利用,继而可以大幅度提高分子印迹聚合物对邻位产物2-甲氧基苯乙酮的选择性[22];其次,底物从聚合物进入结合位点主要依靠扩散作用,扩散速度和温度有着密切的关系,温度升高可以提高扩散速度,缩短响应时间[23],而进一步提高反应温度,苯甲醚与乙酰氯在空腔外的反应速率加快,导致邻位产物的选择性相对下降.分子印迹聚合物不论是用于催化还是分离或其他目的,被选择的底物是否能顺利进入聚合物空腔都非常重要.

表4 温度对傅克酰基化反应选择性的影响aTab.4 Effects of temperature on Friedel-Crafts acylation reactiona
2.2.4 Co(Ⅱ)配位型分子印迹聚合物的底物识别性和区位选择性 分子印迹聚合物应用于催化反应,其主要的功能是具有优异的底物选择性.为了考察Co(Ⅱ)-MIP 的底物选择性和空间识别性,本工作对照了不同印迹聚合物(NIP,MIP 和Co(Ⅱ)-MIP)的催化能力,以及对不同底物(乙酰氯,乙酸酐和苯甲酰氯)的识别能力.从表5 中可以看出,空白聚合物(NIP)在苯甲醚酰基化反应中邻位选择性差,其选择性仅为0.5%.而在相同条件下,MIP 和Co(Ⅱ)-MIP 可明显提高邻位乙酰化产物的选择性,其选择性分别达到4.2%和9.1%.可见,分子印迹聚合物对提高苯甲醚酰基化反应邻位选择性起着至关重要的作用.这是因为分子印迹聚合物具有与邻位产物空间立体结构相似的空腔,空腔中与邻位产物匹配的结合位点可提高该反应的邻位选择性,在AlCl3催化的苯甲醚乙酰化反应过程中,Co(Ⅱ)-MIP 的空腔结构与反应底物具有最佳的匹配位点,因而表现出最高的区位选择能力.
表5 的结果还表明,Co(Ⅱ)-MIP 的邻位乙酰化产物选择性是NIP 的18.2 倍,而使用没有Co(Ⅱ)离子配位的分子印迹材料(MIP),邻位乙酰化产物选择性仅是NIP 的8.4 倍,这是由于在制备Co(Ⅱ)-MIP 过程中,Co(Ⅱ)作为自组装枢轴更能有效地抑制合成过程中模板分子运动,提高自组装构建的稳定性,促进分子印迹聚合物的识别能力.此外,反应过程中,Co(Ⅱ)-MIP 中的吡啶氮原子结合位点有利于AlCl3在印迹空腔中与底物进行邻位自组装,提高邻位产物的选择性[24-26].Co(Ⅱ)-MIP 具有比NIP 和MIP 更大的平均孔径,使底物更容易进入与邻位产物类似的空腔[27],是提高邻位产物选择性的另一个原因.

表5 苯甲醚酰基化反应中邻位产物选择性的影响aTab.5 Effects of ortho product selectivity on anisole acylation reactiona
表5 中还考察了印迹聚合物对不同酰基化试剂的底物选择性.结果表明,当使用乙酰氯时,Co(Ⅱ)-MIP对邻位产物的提高率为18.2 倍,当使用乙酸酐和苯酰氯时Co(Ⅱ)-MIP 对邻位产物的提高率分别为4.6 倍和3.7 倍.由于乙酰氯作为苯甲醚的邻位酰基化试剂是与印迹空腔的立体空间和结合位点最匹配的结构,而乙酸酐和苯乙酰氯由于其分子体积较大,印迹空腔难以与其形成有效的匹配,减少了其与苯甲醚在空腔内乙酰化反应的概率,因而表现出很好的印迹效应[27].此外,尽管有部分AlCl3被固定在Co(Ⅱ)-MIP 印迹空腔中的Co(Ⅱ)位置,但仍有大量外加的AlCl3在Co(Ⅱ)-MIP 腔外部,直接参与乙酰氯与苯甲醚间没有区位选择性的酰基化反应,直接生成对位酰基化产物,这样所得邻位产物的选择性最大仅为9.1%,但是仍然大于MIP 或是NIP 参与下的邻位产物产率,证明了Co(Ⅱ)-MIP 具有较强的区位选择性.
3 结论
设计了以2-乙酰基环己酮-Co(Ⅱ)配合物为模板分子的分子印迹聚合物,并将其应用于苯甲醚邻位酰基化反应中,考察了其对苯甲醚酰基化反应邻位选择性的影响.结果表明,该分子印迹聚合物具有特殊的空腔结构,其功能基团可与邻位产物匹配,一定程度上提高了反应的邻位选择性.在最佳反应条件下,苯甲醚酰基化反应的最高邻位选择性为9.1%,Co(Ⅱ)-MIP 的邻位选择性相对于MIP 提高了18.2 倍,显示出明显的印迹效应.但是,由于识别位点的活性比较低,且聚合物空腔内没有固定的催化活性中心,导致苯甲醚邻位酰基化反应的选择性不高.因此,后续研究工作将考虑在分子印迹聚合物空腔中引入Lewis 酸,以合成出不仅具有结合位点,且具有催化活性中心的分子印迹聚合物仿生催化剂,以期进一步提高苯甲醚酰基化反应的邻位产物选择性.
[1]BANDGAR B P,KASTURE S P.Chem inform abstract:environmentally friendly arylmethylation of aromatics with benzyl halides using envirocat EPZ10®as the Catalyst[J].Monatsh Chem,2000,131(8):913-915.
[2]KARTHIK G,KULANGIAPPAR K,FRANK MARKEN,et al.Electrochemically promoted friedel-crafts acylation of aromatic compounds[J].Tetrahedron Lett,2008,49(16):2625-2627.
[3]PIVSA A S,OKURO K,MIURA M,et al.Acylation of 2-methoxynaphthalene with acyl chlorides in the presence of a catalytic amount of lewis acids[J].J Chem Soc,1994,13(12):1703-1707.
[4]DIEKEY F H.The preparation of specific adsobents[J].Proc Natl Acad Sci USA,1949,35(5):227-229.
[5]WULFF G.Enzyme-like catalysis by molecularly imprinted polymers[J].Chem Rev,2002,102(1):1-28.
[6]WULFF G,SARHAN A,ZABROCKI K.Enzyme analogue built polymers and their use for the resolution of racemates[J].Tetrahedron Lett,1973,14(44):4329-4332.
[7]GAO B,BI C,FAN L.Designing and preparation of cytisine alkaloid surface-imprinted material and its molecular recognition characteristics[J].Appl Surf Sci,2015,332:430-439.
[8]WULFF G.Molecular imprinting in cross-linked materials with the aid of molecular templates-away towards artificial antibodies[J].Angew Chem Int Ed,1995,34(17):1812-1832.
[9]NORRLON O,GLAD M,MOSBACH K.Acrylic polymer preparations containing recognition sites obtained by imprinting with substrates[J].J Chromatogr,1984,299(1):29-41.
[10]WULFF G,GROSS T,SCHONFELD R.Enzyme models based on molecularly imprinted polymers with strong esterase activity[J].Angew Chem Int Ed,1997,36(18):1962-1964.
[11]DEEPTHI K P,MATHEW B.Effect of porogen on the catalytic activity of molecular imprinted polymers[J].Asian J Chem,2013,25(4):1985-1990.
[12]CHO H J,DORNATH P,FAN W.Synthesis of hierarchical Sn-MFI as lewis acid catalysts for isomerization of cellulosic sugars[J].ACS Catalysis,2014,4(6):2029-2037.
[13]ALEXANDER C,SMITH C R,WHITCOMBE M J.Imprinted polymers as protecting groups for regioselective modification of polyfunctional substrates[J].J Am Chem Soc,1999,121(28):6640-6651.
[14]LIU J Q,WULFF G.Novel molecularly imprinted polymers with strong caboxypapetase-like activity[J].Angew Chem Int Ed,2004,43(10):1287-1290.
[15]LIU J Q,WULFF G.Functional mimicry of carboxypeptidase a by a combination of transition state stabilization and a defined orientation of catalytic moieties in molecularly imprinted polymers[J].J Am Chem Soc,2008,130(25):8044-8054.
[16]SVENSON J,ZHENG N,NICHOLLS I A.A molecularly imprinted polymer based synthetic transaminase[J].J Am Chem Soc,2004,126(27):8554-8560
[17]YANG W,LIU L,ZHOU Z,et al.Development of surface imprinting polymer as a selective adsorbent for adsorbing and separating dibenzothiophene from fuel oil[J].Res Chem Intermed,2015,41(4):2619-2633.
[18]MATSUI J,NICHOLLS I A,KARUBE I,et al.Carbon-carbon bond formation using substrate selective catalytic polymers prepared by molecular imprinting:an artificial class Ⅱaldolase[J].J Org Chem,1996,61(16):5414-5417.
[19]ZHANG D N,LI W K,LI W K,et al.Biomimic recognition and catalysis by an imprinted catalysts:arational design of molecular self-assembly toward predetermined high specificity[J].Catal Lett,2007,115(3-4):169-175.
[20]LI S J,GONG S Q.A substrate-selective nanoreactor made of molecularly imprinted polymer containing catalytic silver nanoparticles[J].Adv Funct Mater,2009,19(16):2601-2606.
[21]DAVIS M E,KATZ A,AHMAD W R.Rational catalyst design via imprinted nanostructured materials[J].Chem Mater,1996,8(8):1820-1839.
[22]ALEXANDER C,ANDERSSON H S,ANDERSSON L I,et al.Molecular imprinting science and technology:a suivey of the literature for the yeers up to and inccluding 2003[J].J Mol Recognit,2006,19(2):106-180.
[23]LIN J M,NAKAGAMA T,WU X Z,et al.Temperature effect on chiral recognition of some amino acids with molecularly Biomed[J].Chromatography,1997,11(5):298-302.
[24]BURRI E,ÖHM M,DAGUENET C,et al.Site-isolated porphyrin catalysts in imprinted polymers[J].Chem Eur J,2005,11(17):5055-5061.
[25]PAULING L.Molecular architecture and biological reactions[J].Chem Eng News,1946,24:1375-1377.
[26]HEDIN-DAHLSTROM J,ROSENGREN-HOLMBERG,LEGRAND J P,et al.A class Ⅱaldolase mimic[J].J Org Chem,2006,71(13):4845-4853.
[27]EMGENBROICH M,WULFF G.A new enzyme model for enantioselective esterases based on molecularly imprinted polymers[J].Chem Eur J,2003,9(17):4106-4117.
