丹参多糖对急性肝损伤小鼠肝窦内皮细胞窗孔的影响
2015-12-22卢艳娴宋雨鸿陈育尧翁立冬潘锦瑶
卢艳娴 宋雨鸿 徐 霞 阳 金 陈育尧 翁立冬 潘锦瑶
(1广州医科大学附属广州市第一人民医院,广东 广州 510180;2南方医科大学中医药学院,广东 广州510515)
丹参(Salvia miltiorrhiza),又名赤参、山参、红根等,首载于《神农本草经》,为双子叶植物唇形科的干燥根及根茎。味苦,气微寒,无毒,归心、肝经。丹参具有活血化瘀、痛经止痛、清热安神的功效[1]。由于丹参有保护肝细胞、改善肝脏微循环、促进肝细胞的修复与再生的药理作用,因此丹参及其复方制剂常用于肝脏疾病中[2]。丹参多糖为丹参的有效成分,研究表明,丹参多糖对LPS诱导的急性肝损伤小鼠具有保护作用,但其作用机制尚未明确[3]。本实验通过研究丹参多糖对急性肝损伤小鼠肝窦内皮细胞窗孔的影响,探讨其作用机制,为其进一步开发研究奠定一定的理论依据。
1 材料
1.1 动物
昆明小鼠,体质量(20±2)g,50 只,SPF 级,雌雄各半,购于广东省实验动物中心,动物许可证号:SCXK(粤)2013-0002。颗粒饲料购于广东省实验动物中心。动物房保持通风,干燥,室温22~25℃,湿度50%~70% ,自由饮水,鼠料定量饲养。
1.2 药物
丹参多糖由南方医科大学中医药学院中药制剂教研室翁立冬老师提供。按照专利(一种从丹参中提取多糖的方法,公开号:200810026249.4)的方法提取丹参多糖。本实验所提取的丹参多糖为粗提物,纯度>70%。
1.3 试剂
脂多糖 L2880(LPS,美国 Sigma),AST试剂盒(南京建成生物工程研究所,批号:20141103),ALT试剂盒(南京建成生物工程研究所,批号:20141103),NO试剂盒(南京建成生物工程研究所,批号:20141110),抗Cav-1抗体(美国Abcam)。
1.4 仪器
Ultrospec2001紫外/可见分光光度计(AMERSHAM)、酶标仪(美国Sigma)、DK-8D型电热恒温水槽(上海精宏实验设备有限公司)、低温高速离心机(美国Eppendorf)、XTJ-4400光学显微镜(深圳市斯威冠光学仪器有限公司)、S-3000N扫描电子显微镜(日立)等。
1.5 方法
1.5.1 实验分组及模型的建立 昆明小鼠50只,按体质量随机分为正常对照组、模型组、丹参多糖高剂量组、丹参多糖中剂量组、丹参多糖低剂量组,每组各10只。采用小鼠尾静脉注射LPS诱导肝损伤,按5 mg·kg-1的剂量给予模型组和丹参多糖组,正常组小鼠尾静脉注射同等剂量生理盐水。
1.5.2 动物处理 造模同时开始灌胃直到动物处死前一天,丹参多糖高、中、低剂量组分别按10.4 g·kg-1,5.2 g·kg-1,2.6 g·kg-1灌胃给药。 正常对照组和模型组给予同等剂量生理盐水。灌胃7 d后摘眼球采血,经门静脉灌注固定肝脏,取相同部位肝脏分别放于2.5%的戊二醛固定液和10%甲醛固定液以备电镜样本和病理切片,剩余肝脏超低温冰箱冻存以备肝组织匀浆。血液3 000 r·min-1×10 min离心,取血清,超低温冰箱冻存以备下一步检测所需。
1.6 指标检测
1.6.1 血清学检测 小鼠血清稀释后按试剂盒说明检测AST、ALT、NO。以下列公式计算血清中NO的含量:血清中NO含量=(测定OD值-空白OD值)/(标准OD值-空白OD值)X标准品浓度X样品测试前稀释倍数。
1.6.2 病理学观察 取小鼠肝左叶大致相同部位的肝组织,常规固定、包埋、切片、染色,然后在光镜下观察肝脏的组织学变化。
1.6.3 肝组织Cav-1的免疫组化 采用免疫组织化学SP法,实验步骤按试剂盒说明书进行。
图象定量分析:每组免疫组化染色切片随机选择3张,取互不重叠的5个视野,在20×10放大倍数下,测定标准测量窗口中肝组织阳性区域的面积比。
1.6.4 扫描电镜观察 取小鼠肝中叶大致相同部位的肝组织,放入2.5%戊二醛固定液固定,然后用0.1 mol/L二甲胂酸钠缓冲液(PH7.4)反复漂洗后梯度酒精脱水,迸一步的浸透、包埋切片和临界点干燥。
1.7 统计学处理
实验结果计量资料用±s表示,组间比较用one-way ANOVA。方差齐性时,采用LSD方法进行组间多重比较;方差不齐时,采用DunnettT3方法进行组间多重比较。用统计软件SPSS13.0进行分析,以P<0.05定为差异有统计学意义。
2 结 果
2.1 丹参多糖对急性肝损伤小鼠转氨酶及NO的影响
与正常组相比,模型组血清AST、ALT水平显著升高(P<0.01),表明尾静脉注射LPS后对小鼠肝细胞造成了损伤,动物模型建立成功。丹参多糖高、中剂量组与模型组比较有明显下降(P<0.05)。丹参多糖低剂量组与模型组比较也有下降(P<0.05)。与正常组相比较,模型组 NO水平显著升高(P<0.01)。与模型组比较,丹参多糖高剂量组NO水平显著下降(P<0.01),而丹参多糖中剂量组NO水平也有下降(P<0.05),但丹参多糖低剂量组NO下降不显著(P>0.05)。见表1。

表1 丹参多糖对急性肝损伤小鼠转氨酶及NO的影响
2.2 丹参多糖对急性肝损伤小鼠肝脏病理改变的影响
病理切片结果表明,正常组小鼠的肝组织结构正常,肝细胞没有变性、坏死等病理性变化(图1-A)。模型组小鼠的肝组织结构明显被破坏,大部分肝细胞肿胀,细胞质疏松化,肝细胞灶性或片状坏死,汇管区及周围有大量炎性细胞浸润等病理性改变(图1-B)。丹参多糖高、中剂量组小鼠的肝细胞坏死,变性以及炎性细胞浸润等病变得到了很大程度的减轻(图1-C、D),丹参多糖低剂量(图1-E)组病变程度较模型组减轻。所以丹参多糖对急性肝损伤小鼠肝细胞有修复的作用。

图1 丹参多糖对急性肝损伤小鼠肝脏病理改变的影响
2.3 肝组织Cav-1的免疫组化结果
从表2可知,正常组肝组织表达少量Cav-1,模型组蛋白表达显著增加。丹参多糖各组肝组织表达Cav-1较模型组有不同程度的减少。
3.4 扫描电镜观察
根据图2可知,正常组(3-A)肝窦内皮细胞窗孔数目多,孔径大,肝细胞表面可见清晰地毛细小胆管结构。模型组(3-B)肝窦内皮细胞窗孔明显减少,甚至消失,内皮细胞与肝细胞有分离改变,狄氏腔内胶原沉积。丹参多糖高、中剂量组(3-C、3-D)中,肝窦内皮细胞窗孔数目较模型组显著增多。丹参多糖低剂量组(3-E)中肝窦内皮细胞窗孔较模型组稍增多,但内皮细胞出现变形、破损。这表明丹参多糖能够开放急性肝损伤小鼠肝窦内皮细胞闭合的窗孔,使窗孔数目增加,孔径变大。
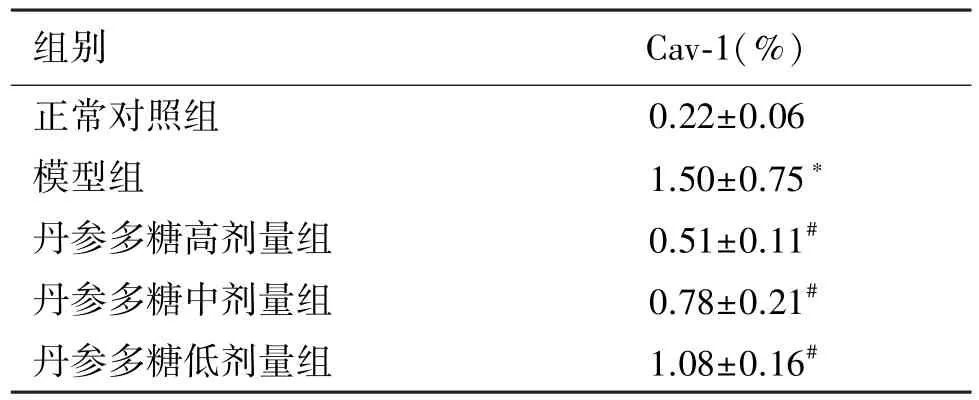
表2 肝组织表达Cav-1的阳性面积百分数

图2 丹参多糖对急性肝损伤小鼠肝窦内皮细胞窗孔的影响
3 讨 论
我国是肝病大国,主要以乙型肝炎为主,而慢性肝炎很多是由急性肝炎未及时治疗而导致的,所以治疗急性肝炎在控制乙肝发病率中尤为重要。肝有门静脉和肝动脉双重血供,但两者最终都是通过终末微静脉和微动脉与肝血窦相连,完成与肝细胞的物质交换后汇集于肝静脉,因此肝窦是完成肝脏物质交换的主要场所[4]。LSEC由WISSE在电镜下首次发现,其外形呈扁平细长状,表面有不同于其他内皮细胞的筛状窗孔结构和不连续的基膜,是构成肝窦壁的主要组成部分[5]。LSEC的主要功能是在肝细胞和血细胞之间形成了一道屏障,控制肝窦微循环,调节物质代谢并参与维持肝脏内环境的稳定,对肝脏物质代谢起重要的“调节器”作用[6]。LSEC受两种细胞内结构的调节——窗孔和小窝。窗孔是LSEC最具特征的结构,正常LSEC的通透性主要以窗孔为主,窗孔在血液和肝细胞的物质交换中发挥筛选屏障作用,调节物质进出血窦的速度[7]。小窝介导大分子跨细胞转运起辅助作用。病理情况下,窗孔减少消失,小窝运送为主,肝窦璧小窝蛋白(Cav-1)表达增多。研究表明,LPS能通过激活枯否细胞、释放炎症因子,导致肝损伤的发生[8]。NO能够促进或加重内毒素介导的肝细胞损伤,而肝组织中NO含量增加可改变微循环,可能对肝细胞具有保护作用[9]。
本实验中小鼠尾静脉注射脂多糖后,模型组小鼠肝内AST、ALT、NO活性增高,Cav-1表达增多,从病理角度观察,肝细胞肿胀、坏死、炎细胞浸润等,电镜结果显示肝窦内皮细胞窗孔数目减少,孔径变小,表明了脂多糖诱导小鼠急性肝损伤模型成功。丹参多糖能明显降低小鼠肝组织AST、ALT、NO含量,使Cav-1表达减少,病理改变明显减轻,电镜结果显示肝窦内皮细胞数目增多,孔径变大。说明丹参多糖通过开放肝窦内皮细胞窗孔,改善肝窦微循环,达到保护肝脏的作用。
[1]国家药典委员会.中华人民共和国药典2010年版一部[M].北京:中国医药科技出版社,2010:70-71.
[2]辛淑杰.丹参的药理作用及临床应用探讨[J].中国民族民间医药,2013(5):26-27.
[3]姚莹华,刘 强,陈育尧,孙学刚,吕志平.丹参多糖对小鼠急性肝损伤的保护作用[J].中国实验方剂学杂志,2010(6):227-230.
[4]王宝恩,张定凤.现代肝脏病学[M].北京科学出版社,2003,17.
[5]Wisse E.An electron microscopic study of the fenestrated endothelial lining of rat liver sinusoids[J].Ultrastruct Res,1970,31:125-50.
[6]Fraser R,Dobbs BR,Rogers GWT.Lipoproteins and the liver sieve: the role of the fenestrated sinusoidal endothelium in lipoprotein metabolism,atherosclerosis,and cirrhosis[J].Hepatology,1995,21:863-74.
[7]Braet F,Wisse E.Structural and functional aspects of liver sinusoidal endothelialcellfenestrae: areview.Comp Hepatol,2002,1(2):124-126.
[8]Landmann R,Scherer F,Schumann R,et al.LPS directlyinduces oxygen radical p roduction in human monocytesvia LPS binding p rotein and CD14[J].J Leukoc Biol,1995,57(3):440.
[9]陈仁洪,张经良.肝炎患者一氧化氮异常及其临床意义[J].中国实用医药,2012(08):83-84.
