4 种虾脂肪的提取及其脂肪酸组成的气相色谱分析
2015-12-21丛宝磊曾晓雄
周 莉,丛宝磊,侯 双,曾晓雄*
(南京农业大学食品科技学院,江苏 南京 210095)
4 种虾脂肪的提取及其脂肪酸组成的气相色谱分析
周 莉,丛宝磊,侯 双,曾晓雄*
(南京农业大学食品科技学院,江苏 南京 210095)
采用混合有机溶剂法从南极磷虾、对虾、河虾和罗氏虾中提取脂肪,分别考察提取溶剂、提取时间、料液比和提取温度对虾脂肪得率的影响,确定虾脂肪的最佳提取条件为:提取溶剂为石油醚-乙酸乙酯(2∶1,V/V)、提取时间60 min、料液比1∶5(g/mL)、提取温度50 ℃。在此条件下南极磷虾、对虾、河虾和罗氏虾的脂肪得率分别为4.39%、2.80%、2.98%和3.30%。采用气相色谱法分析4 种虾脂肪的脂肪酸组成,结果表明,4 种虾脂肪的不饱和脂肪酸含量较高,且都在60%以上,其中单不饱和脂肪酸的含量为17.08%~34.23%,多不饱和脂肪酸的含量为36.89%~48.28%。4 个虾品种间脂肪的脂肪酸组成和含量存在一定的差异,南极磷虾的二十碳五烯酸和二十二碳六烯酸总量最高,达31.27%,而河虾的油酸和花生四烯酸的含量最高。
虾脂肪;提取;脂肪酸;气相色谱
不饱和脂肪酸是对身体健康至关重要的一类脂肪酸,具有抗炎症、降低胆固醇水平、预防动脉粥样硬化等功能[1-3]。不饱和脂肪酸分为单不饱和脂肪酸和多不饱和脂肪酸,其中多不饱和脂肪酸包括ω-3族脂肪酸和ω-6族脂肪酸,两者的区别在于第一个双键出现在碳链甲基端的位置不同。这类脂肪酸在人体内不能正常合成,只能从食物中摄取,因此被认为是人体的必需脂肪酸。虾富含不饱和脂肪酸,尤其是ω-3族脂肪酸,如二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)等[4-6],因此,虾是人体不饱和脂肪酸的重要来源之一。
虾可分为淡水虾和海水虾。河虾(Macrobranchium nipponense)和罗氏虾(Macro brachium rosenbergii)属于淡水虾,隶属于节肢动物门,甲壳纲,十足目,长臂虾科[7-8],广泛分布于江河、湖泊、水库和池塘中,是优质的淡水虾类,肉质紧密细嫩。对虾(Penaeuschinesis),又名东方对虾,为广温广盐海产动物,隶属于节肢动物门、甲壳纲、十足目、对虾科。对虾是世界三大名虾之一,是中国海的特有品种,为分布最广的对虾类,主要分布在黄海、渤海和朝鲜西部沿海。对虾体长大而侧扁,甲壳薄,光滑透明,雌体青蓝色,雄体呈棕黄色,形态美、风味独特[9]。南极磷虾(Euphausia superba)隶属节肢动物门、甲壳纲、磷虾目,广泛分布在南冰洋的南极洲水域。据统计,南极磷虾每年的捕捞量为1300万t。南极磷虾估计生物量为4000~15 500万t,其可持续捕捞量为700~2 000万t[10-12],已成为备受关注的潜在渔业资源。
本研究利用混合溶剂在不同的条件下提取河虾、罗氏虾、对虾和南极磷虾的脂肪,考察提取溶剂、提取时间、料液比和提取温度对脂肪得率的影响,优化提取工艺,并比较4 种虾的脂肪得率,最后采用气相色谱(gas chromatography,GC)法比较分析4 种虾脂肪的脂肪酸组成。
1 材料与方法
1.1 材料与试剂
南极磷虾肉由辽宁省大连海洋渔业集团提供,于-20 ℃冰箱保存;河虾、罗氏虾和对虾购于南京市苏果超市。
正己烷、无水乙醇、乙酸乙酯、石油醚 南京化学试剂有限公司;37 种脂肪酸甲酯混合标准品 美国Sigma公司。
1.2 仪器与设备
Heidolph Laborota 4000真空旋转蒸发仪 德国Heidolph公司;LyoQuest-55真空冷冻干燥机 西班牙Telstar公司;GC-2010 Plus 日本岛津公司。
1.3 方法
1.3.1 样品处理
河虾、罗氏虾和对虾去除虾壳和虾头后得到的虾肉和南极磷虾肉,分别剁碎后置于真空冷冻干燥仪中干燥,经冷冻干燥后的虾粉用打粉机磨成粉后置于-20 ℃冰箱保存[13-14]。
1.3.2 4 种虾脂肪的提取
称取一定量的虾粉,选用合适的提取溶剂,在一定的料液比、提取时间和提取温度条件下提取虾脂肪。8 500 r/min离心10 min后过滤得到萃取溶液,然后,将其置于真空旋转蒸发仪中旋转蒸发去除有机溶剂,接着置于氮气下吹干得到虾脂肪。分别考察提取溶剂、提取时间、料液比和提取温度对脂肪得率的影响。脂肪得率的计算见式(1)。每种样品重复分析3 次,结果用±s表示。

式中:m1为虾脂肪的质量/g;m2为虾粉的质量/g。
1.3.3 脂肪酸组成的气相色谱分析
1.3.3.1 样品处理
取少量的虾脂肪加入3 mL 0.5 mol/L氢氧化钾-甲醇溶液,在水浴锅55 ℃回流20 min,加入3 mL 13%三氟化硼-甲醇溶液在55 ℃水浴回流20 min,然后加入1 mL正庚烷萃取。最后加入饱和NaCl溶液,分层后取上清液脱水后用于GC分析[15]。
1.3.3.2 色谱条件
色谱柱:SP 2560(0.25 mm×100 m,0.20 μm);FID检测器,柱温:140 ℃以5 ℃/min升至220 ℃,进样口温度:280 ℃,检测器温度:285 ℃;柱前压力,空气:40 kPa、氢气:400 kPa;载气:高纯氮气。利用37 种脂肪酸甲酯混合标准品判断各峰对应的脂肪酸,结合峰面积归一化法计算其相对含量。脂肪酸含量的计算见式(2):

式中:A为单个脂肪酸对应的峰面积;ΣA为所有脂肪酸对应的峰面积之和。
2 结果与分析
2.1 虾脂肪提取工艺的优化
以南极磷虾为样品,摸索优化脂肪提取工艺条件,然后将该条件用于河虾、对虾和罗氏虾的脂肪提取,比较分析4 种虾的脂肪得率。
2.1.1 提取溶剂的选择
为了将虾脂肪中的极性脂和非极性脂充分地提取出来,在提取温度50 ℃、料液比1∶5(g/mL)、提取时间60 min提取条件下,选用极性较大的有机溶剂(无水乙醇、乙酸乙酯)以及极性较弱的有机溶剂(正己烷、石油醚)进行提取,各溶剂组合为正己烷-乙酸乙酯(2∶1,V/V)、正己烷-无水乙醇(2∶1,V/V)和石油醚-乙酸乙酯(2∶1,V/V),脂肪得率分别为(3.22±0.41)%、(3.79±0.61)%、(4.39±0.72)%。可以看出,石油醚-乙酸乙酯的提取效果最好,在所选试剂中,石油醚能较好地将南极磷虾中的非极性脂类提取出来,乙酸乙酯则把其中的极性脂提取出来,从而脂肪得率较高。
2.1.2 提取时间对提取效果的影响
控制提取温度50 ℃、料液比1∶5(g/mL)、提取剂石油醚-乙酸乙酯(2∶1,V/V),提取时间分别为30、60、90 min进行单因素试验,结果如图1所示。
图1 提取时间对虾脂肪得率的影响Fig.1 Effect of extraction time on the yield of shrimp lipid
由图1可知,随着提取时间的延长,南极磷虾的脂肪得率是逐渐提高的,但是60 min和90 min时的得率相差不明显,考虑到时间过长会造成虾脂肪氧化,所以选择60 min为最佳提取时间。
2.1.3 料液比对提取效果的影响
控制提取剂石油醚-乙酸乙酯(2∶1,V/V)、提取温度50 ℃、提取时间60 min,选择料液比为1∶4、1∶5、1∶6和1∶7(g/mL)提取虾脂肪,考察料液比对提取率的影响。结果如图2所示。料液比对虾脂肪得率的影响不是很大,变化较平缓,但是料液比为1∶5时,虾脂肪得率最大,所以选择料液比1∶5为最佳料液比。
图2 料液比对虾脂肪得率的影响Fig.2 Effect of ratio of solid to liquid on the yield of shrimp lipid
2.1.4 提取温度对提取效果的影响
控制提取剂石油醚-乙酸乙酯(2∶1,V/V)、提取时间60 min,选择料液比为1∶5(g/mL)时考察提取温度对虾脂肪得率的影响。结果如图3所示。
图3 提取温度对虾脂肪得率的影响Fig.3 Effect of extraction temperature on the yield of shrimp lipid
由图3可知,随着温度的上升,脂肪得率增大。这可能是由于油脂分子在热作用下,扩散速率提高,溶剂的溶解能力增大所致,然而温度过高会导致蛋白质变性从而使油脂被包裹无法溶出,当温度达到50 ℃后,脂肪得率下降,所以选择50 ℃作为最佳提取温度。
综上所述,得到南极磷虾脂肪的最佳提取条件为:提取溶剂为石油醚-乙酸乙酯(2∶1,V/V)、料液比1∶5(g/mL)、提取时间60 min、提取温度50 ℃。并将此法用于其他3 种虾脂肪的提取中,比较4 种虾的脂肪得率。结果发现,南极磷虾、对虾、河虾和罗氏虾的脂肪得率分别为(4.39±0.72)%、(2.80±0.18)%、(2.98±0.12)%和(3.30±0.10)%,说明4 种虾中南极磷虾的脂肪得率较高,这可能与虾的生活习性和摄食有关。
2.2 4 种虾脂肪的脂肪酸的组成
采用GC法分析4 种虾脂肪的脂肪酸组成,以对虾的脂肪酸气相色谱图为例(图4),共检测到33 种脂肪酸,且分离效果好,通过与37 种脂肪酸甲酯混合标准品的脂肪酸气相色谱保留时间相比较,鉴定出4 种虾脂肪的脂肪酸种类,并计算出相对含量,结果如表1所示。
图4 对虾脂肪的脂肪酸组成的气相色谱图Fig.4 Gas chromatogram of the fatty acid composition of Penaeuschinesis lipid
从表1可知,4 种虾脂肪所含的不饱和脂肪酸(单不饱和脂肪酸和多不饱和脂肪酸)的含量都在60%以上,多不饱和脂肪酸的含量在36.89%~48.28%,其中南极磷虾中EPA+DHA含量最高,达31.27%。河虾的单不饱和脂肪酸含量最高,达34.23%,主要以油酸(C18∶1n9c)为主,占24.66%。南极磷虾含有30 种脂肪酸,主要的脂肪酸是棕榈酸 (C16∶0,26.68%)、油酸(C18∶1n9c,18.45%)、EPA (16.39%)和DHA(14.88%)。对虾含有33 种脂肪酸,主要的脂肪酸有棕榈酸 (20.14%)、油酸(18.04 %)、EPA (12.66%)和亚油酸(C18∶2n6c,12.02%)。河虾含有32 种脂肪酸,主要的脂肪酸除了油酸,还有棕榈酸(17.49%)、EPA (13.17%),此外,花生四烯酸(C20∶4n6)在河虾中所占的比例(9.75%)明显高于其他虾。罗氏虾含有33 种脂肪酸,以棕榈酸(19.89%)、亚油酸(15.75%)、DHA (14.81%)、油酸 (13.37 %)和EPA(11.62%)为主,且EPA+DHA的总量仅次于南极磷虾油,为26.43%。4 种虾的脂肪酸组成的气相色谱分析结果与其他学者的报道[16-20]结果相似,而且结果表明4 种虾的主要脂肪酸种类相差不大,但是品种间的各种脂肪酸比例有一定差异,这可能与虾的产地、捕捞季节、饲养方式以及生长的区域有关[21-23]。此外,南极磷虾富含EPA和DHA,不含二十一烷酸、二十二烷酸和二十四烷酸,结果与le Grandois等[24]的报道一致。河虾不含芥酸。对虾和罗氏虾含有丰富的亚油酸,亚油酸是人体不能自身合成的必需脂肪酸,只能从食物中摄取,对维持人体健康具有非常重要的作用[25]。
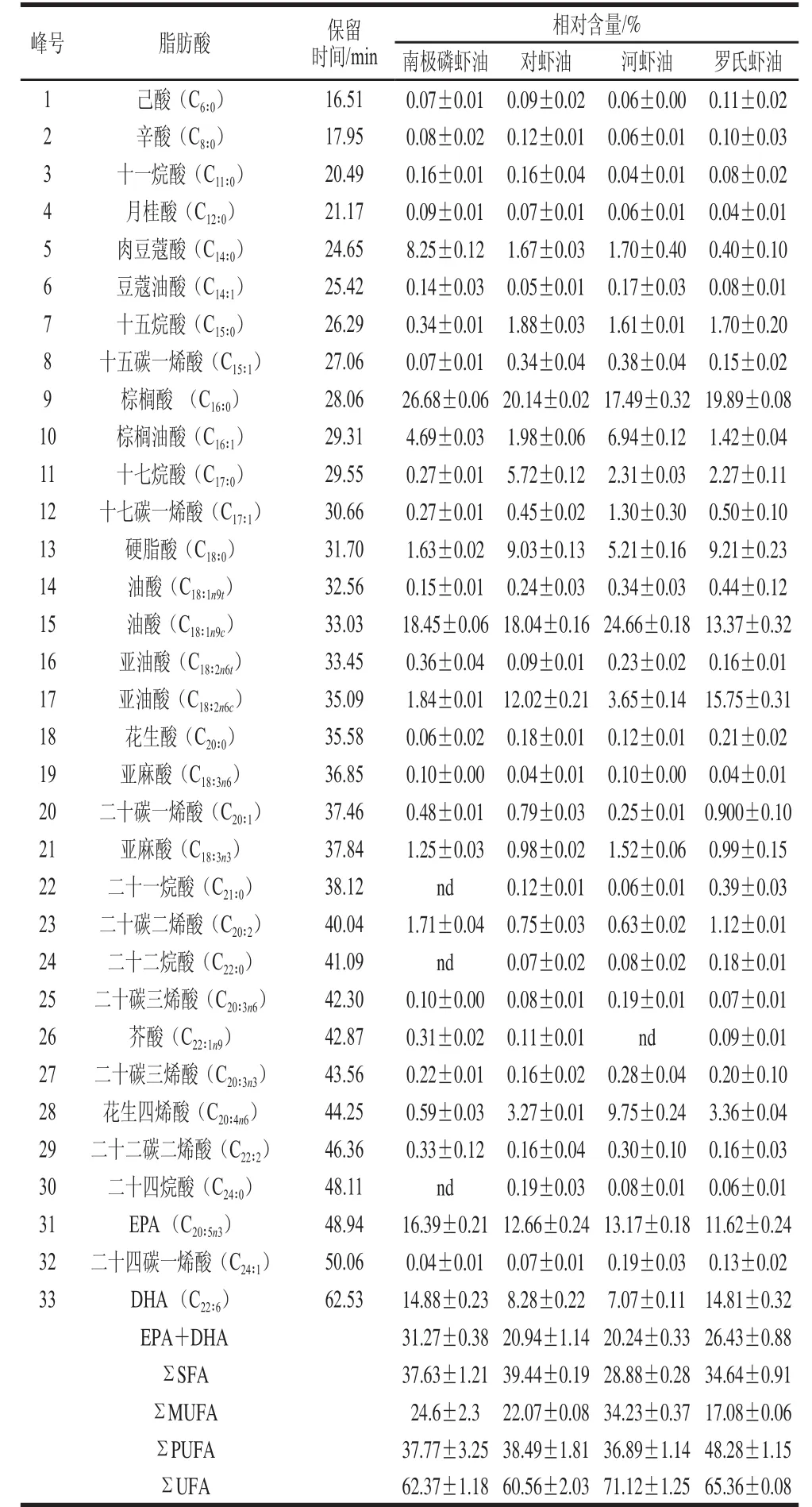
表1 4 种虾脂肪的脂肪酸相对含量Table1 Relative contents of fatty acids in lipids of four shrimp species
3 结 论
本研究采用混合溶剂法提取虾脂肪,最佳提取条件为提取温度50 ℃、料液比1∶5(g/mL)、提取溶剂石油醚-乙酸乙酯 (2∶1,V/V)、提取时间60 min。南极磷虾、对虾、河虾和罗氏虾的脂肪得率分别为4.39%、2.80 %、2.98%和3.30%。4 种虾脂肪的脂肪酸种类都在30 种以上,饱和脂肪酸以棕榈酸为主,单不饱和脂肪酸以油酸为主,且都富含多种多不饱和脂肪酸,其中南极磷虾所含的EPA和DHA总量最高。因此,南极磷虾是多不饱和脂肪酸的新型来源,可作为膳食营养补充剂添加到食品中,有利于功能性食品的开发,具有广阔的市场前景。
[1] ZYRIAX B C, WINDLER E. Dietary fat in the prevention of cardiovascular disease: a review[J]. European Journal of Lipid Science and Technology, 2000, 102(5): 355-365.
[2] KUSUNOKI M, TSUTSUMI K, HARA T, et al. Ethyl icosapentate (omega-3 fatty acid) causes accumulation of lipids in skeletal muscle but suppresses insulin resistance in OLETF rats[J]. Metabolism, 2003, 52(1): 30-34.
[3] AWADA M, MEYNIER A, SOULAGE C, et al. n-3 PUFA added to high-fat diets affect differently adiposity and inflammation when carried by phospholipids or triacylglycerols in mice[J]. Nutrition and Metabolism, 2013, 10(1): 23.
[4] YU P, GU H. Bioactive substances from marine fi shes, shrimps, and algae and their functions: present and future[J]. Critical Reviews in Food Science and Nutrition, 2015, 55: 1114-1136.
[5] le GRANDOIS J, MARCHINOI E, ZHAO M J, et al. Oxidative stability at high temperatures of oleyol and linoleoyl residues in the forms of phosphatidylcholines and triacylglycerols[J]. Journal of Agricultural and Food Chemistry, 2010, 58: 2973-2979.
[6] ZHOU L, ZHAO M J, BINDLER F, et al. Comparison of the volatiles formed by oxidation of phosphatidylcholine to triglyceride in model systems[J]. Journal of Agricultural and Food Chemistry, 2014, 62: 8295-8301.
[7] 倪娟, 赵晓勤, 陈立侨, 等. 日本沼虾四种群肌肉营养品质的比较[J].中国水产科学, 2003, 10(3): 212-214.
[8] WANG D H, CHEN Z J, JIANG Y Y, et al. Fatty acid composition and analysis of freshwater caridean shrimp Macrobrachium nipponense (De Haan) during spermiogenesis[J]. Aquaculture Research, 2010, 41: 1140-1149.
[9] 叶昌臣. 中国对虾产业的辉煌与衰退[J]. 天津水产, 2005(1): 9-10.
[10] 刘丽, 刘承初, 赵勇, 等. 南极磷虾的营养保健功效以及食品安全性评价[J]. 食品科学, 2010, 31(17): 443-447.
[11] 周长平, 孙军涛, 王洪新, 等. 酶解法提取南极磷虾虾油的研究[J].中国油脂,2013, 38(3): 1-3.
[12] 陈雪忠, 徐兆礼, 黄洪亮. 南极磷虾资源利用现状与中国的开发策略分析[J]. 中国水产科学, 2009, 16(3): 451-458.
[13] ZHOU L, le GRANDOIS J, MARCHIONI E, et al. Improvement of total lipid and glycerophospholipid recoveries from various food matrices using pressurized liquid extraction[J]. Journal of Agricultural and Food Chemistry, 2010, 58: 9912-9917.
[14] ZHOU L, ZHAO M J, ENNAHAR S, et al. Liquid chromatography-tandem mass spectrometry for the determination of sphingomyelin species from calf brain, ox liver, egg yolk, and krill oil[J]. Journal of Agricultural and Food Chemistry, 2012, 60: 293-298.
[15] ZHOU L, ZHAO M J, ENNAHAR S, et al. Determination of phosphatidylethanolamine molecular species in various food matrices by liquid chromatography-electrospray ionization-tandem mass spectrometry (LC-ESI-MS2)[J]. Analytical and Bioanalytical Chemistry, 2012, 403(1): 291-300.
[16] MENARD S, TODD A, DURHAM H M, et al. Benchmarking select nutrients in domestic, wild caught and imported farmed shrimp[J]. Journal of Aquatic Food Product Technology, 2015, 24: 112-119.
[17] GIGLIOTTI J C, DAVENPORT M P, BEAMER S K, et al. Extraction and characterization of lipids from Antarctic krill (Euphausia superba)[J]. Food Chemistry, 2011, 125(3): 1028-1036.
[18] LI G, SINCLAIR A J, LI D. Comparison of lipid content and fatty acid composition in the edible meat of wild and cultured freshwater and marine fish and shrimps from China[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 1871-1881.
[19] 楼乔明, 王玉明, 杨文鸽, 等. 南极磷虾粉脂质及脂肪酸组成分析[J].水产学报, 2012, 36(8): 1256-1262.
[20] PHLEGER C F, NELSON M M, MOONEY B D, et al. International and between species comparison of the lipids, fatty acids and sterols of Antarctic krill from the US AMLR Elephant Island survey area[J]. Comparative Biochemistry and Physiology, 2002, 131(4): 733-747.
[21] BRAGAGNOLO N, RODRIGUEZ-AMAYA D B. Total lipid, cholesterol, and fatty acids of farmed freshwater prawn (macrobrachium rosenbergii) and wild marine shrimp (penaeus brasiliensis, penaeus schimitti, xiphopenaeus kroyeri)[J]. Journal of Food Composition and Analysis, 2001, 14: 359-369.
[22] YERLIKAYA P, TOPUZ O K, BUYUKBENLI H A. Fatty acid profi les of different shrimp species: effects of depth of catching[J]. Journal of Aquatic Food Product Technology, 2013, 22: 290-297.
[23] AYAS D, OZOGUL Y, YAZGAN H. The effects of season on fat and fatty acids contents of shrimp and prawn species[J]. European Journal of Lipid Science and Technology, 2013, 115: 356-362.
[24] le GRANDOIS J, MARCHIONI E, ZHAO M J, et al. Investigation of natural phosphatidylcholine sources: separation and identifi cation by liquid chromatography-electrospray ionization-tandem mass spectrometry (LC-ESI-MS2) of molecular species[J]. Journal of Agricultural and Food Chemistry, 2009, 57: 6014-6020.
[25] 于彩云, 王述彬, 刘金兵, 等. 辣椒籽脂肪的快速提取与脂肪酸分析[J].食品科学, 2012, 33(12): 259-263.
Extraction of Lipids from Four Shrimp Species and Analysis of Fatty Acid Composition by Gas Chromatography
ZHOU Li, CONG Baolei, HOU Shuang, ZENG Xiaoxiong*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Shrimp lipids were extracted from Euphausia superba, Penaeuschinesis, Macrobranchium nipponense and Macrobrachium rosenbergii by mixed organic solvents. Effects of extraction solvent, extraction time, ratio of solid to liquid and extraction temperature on the yield of shrimp lipids were investigated. The optimal extraction conditions were obtained as follows: petroleum ether-ethyl acetate (2:1, V/V) as extraction solvent, ratio of solid to liquid 1:5, extraction time 60 min and extraction temperature 50 ℃. Under these conditions, the lipid yields from Euphausia superba, Penaeuschinesis, Macrobranchium nipponense and Macrobrachium rosenbergii were 4.39%, 2.80%, 2.98% and 3.30%, respectively. The fatty acid compos itions of the four shrimp lipids were determined by gas chromatography. The results showed that the contents of unsaturated fatty acids for the four shrimp lipids were all above 60%, consisting of 17.08%-34.23% monounsaturated fatty acids and 36.89%-48.28% polyunsaturated fatty acid. There were some differences in fatty acid composition and lipid contents among the four varieties of shrimps. The total content of DHA and EPA in Euphausia superba was highest (31.27%), while both C18:1,n9cand C20:4,n6were the most abundant fatty acids in Macrobranchium nipponense.
shrimp lipid; extraction; fatty acid; gas chromatography
TS272;TS201.3
A
1002-6630(2015)20-0152-05
10.7506/spkx1002-6630-201520029
2015-05-11
江苏省自然科学基金青年科学基金项目(BK20140701);教育部留学人员回国基金项目(G0201500089)
周莉(1985—),女,讲师,博士,研究方向为食品营养与化学。E-mail:zhoul@njau.edu.cn
*通信作者:曾晓雄(1964—),男,教授,博士,研究方向为食品生物技术。E-mail:zengxx@njau.edu.cn
