雌激素对小鼠胰岛素敏感性及脂肪因子的影响
2015-12-21赵维纲刘率男申竹芳
袁 涛,李 娟,赵维纲,付 勇,刘率男,刘 泉,申竹芳
1中国医学科学院 北京协和医学院 北京协和医院内分泌科国家卫生和计划生育委员会内分泌重点实验室,北京1007302中国医学科学院 北京协和医学院 药物研究所天然药物活性物质与功能国家重点实验室,北京100050
雌激素对小鼠胰岛素敏感性及脂肪因子的影响
袁 涛1,李 娟1,赵维纲1,付 勇1,刘率男2,刘 泉2,申竹芳2
1中国医学科学院 北京协和医学院 北京协和医院内分泌科国家卫生和计划生育委员会内分泌重点实验室,北京100730
2中国医学科学院 北京协和医学院 药物研究所天然药物活性物质与功能国家重点实验室,北京100050
目的 探讨雌激素影响小鼠胰岛素敏感性的可能机制。方法 采用随机数字表法,将36只6周龄C57BL/6J雌鼠随机分为正常饮食组(NOR)、正常饮食去卵巢组(NOR+OVX)、正常饮食去卵巢雌激素替代组(NOR+OVX+ E2)、高脂饮食组(HF)、高脂饮食去卵巢组(HF+OVX)和高脂饮食去卵巢雌激素替代组(HF+OVX+E2)6组,每组6只。根据分组行去卵巢手术后,分别给予高脂或正常饮食20周,替代组给予雌激素20 d(5 μg/d,皮下注射),比较各组小鼠体重、内脏脂肪量、糖耐量、胰岛素敏感性(高胰岛素正常葡萄糖钳夹试验)及血清瘦素、脂联素和抵抗素水平。结果 HF+OVX组小鼠的体重与内脏脂肪量明显高于HF组,糖耐量明显低于HF组,雌激素治疗后均得到显著改善(P均<0.05);正常饮食3组小鼠间的上述各指标差异均无统计学意义(P均>0.05)。高脂饮食和正常饮食去卵巢小鼠胰岛素敏感性均显著降低,雌激素治疗后均得到明显改善(P均<0.05)。去卵巢小鼠血清瘦素升高及脂联素降低具有显著性,雌激素治疗后瘦素降低及脂联素升高也均有显著性(P均<0.05)。各组小鼠的抵抗素水平差异均无统计学意义(P均>0.05)。结论 雌激素治疗可以通过减轻体重改善胰岛素抵抗,还能直接作用于脂肪组织,影响脂肪因子水平,减少内脏脂肪量,改善胰岛素敏感性。
雌激素;高脂饮食;脂肪细胞因子;高胰岛素正常葡萄糖钳夹试验
Acta Acad Med Sin,2015,37(3):269-273
2008年世界卫生组织调查报告,全世界已有超过5亿肥胖人群,且肥胖的增长速度显著增加。肥胖易引起代谢紊乱,是2型糖尿病、冠心病、癌症等多种疾病的独立危险因素[1]。与男性相比,绝经前女性代谢紊乱发生较少[2-4],但绝经后肥胖、2型糖尿病、冠心病等代谢疾病发生率显著升高[5]。研究显示,雌激素替代治疗可以明显改善绝经后女性胰岛素敏感性,降低2型糖尿病发生率[6-8]。然而,雌激素的保护作用是通过减轻体重、从而改善代谢状态,还是雌激素的直接保护效应,仍有待进一步阐明。本研究观察了雌激素替代治疗对小鼠胰岛素敏感性的影响及其机制。
材料和方法
实验动物及分组 6周龄C57BL/6J雌性小鼠36只,由北京华阜康生物科技股份有限公司提供,清洁级标准饲养,采用随机数字表法随机分为正常饮食组(NOR)、正常饮食去卵巢组(NOR+OVX)、正常饮食去卵巢雌激素替代组(NOR+OVX+E2)、高脂饮食组(HF)、高脂饮食去卵巢组(HF+OVX)和高脂饮食去卵巢雌激素替代组(HF+OVX+E2)6组,每组6只。
动物模型建立 随机选取24只6周龄小鼠腹腔注射1%戊巴比妥钠麻醉(40~85 mg/kg体重),行双侧卵巢切除术,另12只小鼠麻醉后行假手术。卵巢切除术后5 d起行阴道脱落细胞涂片,连续5 d均未出现角化细胞为手术成功。之后将卵巢切除小鼠随机分为两组,一组给予高脂饮食(45%脂肪),另一组仍为正常饮食;假手术小鼠分为两组,分别给予高脂饮食和正常饮食。喂养20周后,从卵巢切除小鼠中随机选取6只高脂饮食小鼠和6只正常饮食小鼠,给予苯甲酸雌二醇(天津金耀氨基酸有限公司)替代治疗(5 μg/d,皮下注射)20 d,其余小鼠给予等剂量橄榄油。每3 d监测并记录1次体重。
口服葡萄糖耐量试验 小鼠禁食4 h后,给予0.4 g/ml葡萄糖溶液(0.05 ml/10 g)灌胃,尾静脉取血10 μl,时间依次为服糖前,糖负荷后 30、60、120 min,葡萄糖氧化酶法检测血糖值,计算血糖曲线下面积。
高胰岛素正常葡萄糖钳夹试验 1%戊巴比妥钠麻醉(40~85 mg/kg体重),行右侧颈静脉插管,一次性注入50U/ml肝素钠溶液0.05 ml,使全身肝素化抗凝;将小鼠固定于恒温平板上,稳定20 min;人正规胰岛素以2 μl/min速度持续输注,使内源性胰岛素分泌受到抑制;每5~10 min尾静脉取血,快速测血糖,根据血糖值调节葡萄糖输注率,以保持小鼠血糖稳定在(5.5±0.5)mmol/L。当钳夹进入稳定状态,取钳夹后80 min葡萄糖输注率的均值。小鼠在钳夹结束后断头处死,留取腹腔内脏脂肪,称重。
瘦素、脂联素、抵抗素测定 取小鼠血清,采用酶联免疫吸附法试剂盒(ELISA,R&D,美国),按照试剂盒说明书操作步骤分别检测血清瘦素、脂联素、抵抗素。
统计学处理 采用SPSS 17.0统计软件,符合正态分布的计量资料以均数±标准误表示,各组数据比较前先进行正态分布检验和方差齐性检验,符合正态分布和方差齐性时,多组比较采用单因素方差分析,并进行两两比较;不满足时采用非参数检验;P<0.05为差异有统计学意义。
结果
小鼠体重及腹腔内脏脂肪重量变化 高脂饮食喂养20周的HF组小鼠体重明显高于NOR组 [(37.87± 0.87)g比(26.17±0.65)g,P=0.000];而HF+ OVX组小鼠又明显高于HF组 [(48.38±0.66)g比(37.87±0.87)g,P=0.000];雌激素治疗20 d后,HF+OVX+E2组小鼠体重较HF+OVX组明显降低[(39.82±1.34)g比(48.38±0.66)g,P=0.000]。
NOR组、NOR+OVX组和NOR+OVX+E2组小鼠的体重分别为(26.17±0.65)、(27.67±0.33)和(27.00±0.17)g,各组间差异无统计学意义(P= 0.079)。HF组小鼠腹腔内脏脂肪重量明显高于NOR 组 [(2.17±0.12)g比(0.50±0.06)g,P=0.000],HF+OVX组小鼠又明显高于HF组 [(3.71±0.08)g 比(2.17±0.12)g,P=0.000],HF+OVX+E2组小鼠则较HF+OVX组明显降低 [(2.01±0.27)g比(3.71±0.08)g,P=0.000]。NOR组、NOR+OVX组和NOR+OVX+E2组小鼠的内脏脂肪组织重量分别为(0.50±0.06)、(0.56±0.07)和(0.51± 0.06)g,各组间差异无统计学意义(P=0.905)。
口服葡萄糖耐量试验变化情况 口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)结果显示,HF+OVX组小鼠血糖曲线下面积明显大于HF组[(297.18±6.66)mg·kg-1·min-1比(254.84± 3.67)mg·kg-1·min-1,P=0.000],而雌激素替代治疗后的HF+OVX+E2组小鼠则明显小于HF+OVX 组 [(234.99±8.77)mg·kg-1·min-1比(297.18± 6.66)mg·kg-1·min-1,P=0.000]。NOR组、NOR+ OVX组和NOR+OVX+E2组小鼠的血糖曲线下面积分别为(228.73±2.08)、(240.46±8.50)和(224.05± 2.82)mg·kg-1·min-1,各组间差异无统计学意义(P=0.113)。
小鼠高胰岛素正常葡萄糖钳夹试验结果 NOR+ OVX组小鼠胰岛素敏感性较NOR组显著下降 [(23.18± 1.02)mg·kg-1·min-1比(49.52±6.75)mg·kg-1·min-1,P=0.017],雌激素替代治疗后的NOR+OVX+E2组胰岛素敏感性较NOR+OVX组显著改善 [(42.94± 7.07)mg·kg-1·min-1比(23.18±1.02)mg·kg-1·min-1,P=0.049]。HF+OVX组小鼠胰岛素敏感性较HF组有下降趋势 [(17.77±3.98)mg·kg-1·min-1比(22.95±4.69)mg·kg-1·min-1,P=0.449],雌激素替代治疗后HF+OVX+E2组较HF+OVX明显改善[(42.04±4.15)mg·kg-1·min-1比(17.77±3.98)mg· kg-1·min-1,P=0.010]。
小鼠血清瘦素、脂联素、抵抗素水平 HF+OVX组小鼠血清瘦素水平较HF组显著升高(P=0.000),雌激素替代后的HF+OVX+E2组则较HF+OVX组显著下降(P=0.000);NOR+OVX组小鼠血清瘦素水平较NOR组显著升高(P=0.003),雌激素替代治疗后的NOR+OVX+E2组较NOR+OVX组显著下降(P=0.007),与NOR组差异没有统计学意义(P= 0.695)。HF+OVX组小鼠血清脂联素水平较HF组显著降低(P=0.018),而HF+OVX+E2组则较HF+ OVX组显著升高(P=0.021);NOR+OVX组和NOR+OVX+E2组小鼠的血清脂联素水平均较NOR组显著降低(P均=0.000),而NOR+OV组与NOR+ OVX+E2组间差异没有统计学意义(P=0.091)。高脂饮食喂养3组小鼠间的血清抵抗素水平差异无统计学意义(P=0.079),正常饮食3组小鼠间的血清抵抗素水平差异也无统计学意义(P=0.068)(表1)。
讨论
绝经后妇女超重或肥胖及2型糖尿病等代谢综合征的发生率显著增加[9]。研究显示,可能由于绝经后雌激素缺乏、能量消耗与脂肪氧化能力下降,使体重及内脏脂肪增加[10]。超重或肥胖可引起机体慢性炎症反应,从而导致胰岛素抵抗[11-12]。雌激素替代治疗后可以改善体重及胰岛素敏感性[13]。然而,雌激素对胰岛素敏感性的影响是存在直接效应,还是通过体重间接发挥作用,目前尚不十分清楚,而阐明雌激素的作用机制可以更好地指导雌激素替代治疗。本研究通过双侧卵巢切除建立雌激素缺乏小鼠模型,观察了雌激素缺乏与替代治疗对小鼠胰岛素敏感性及脂肪因子的影响,同时利用高脂饮食喂养建立肥胖小鼠模型,探索了雌激素对胰岛素敏感性以及对炎症状态的改善是否受体重的影响。结果显示,在单纯切除卵巢导致雌激素缺乏的情况下,对正常饮食小鼠的体重影响较小,而对高脂饮食组小鼠体重影响较大。在给予雌激素替代治疗之后,高脂饮食组小鼠体重的减轻更显著,内脏脂肪重量的改变在高脂饮食组也较为明显。由此可见,在雌激素缺乏的情况下,高脂饮食更容易诱发体重的增加及内脏脂肪的堆积,补充雌激素后可以明显减小高脂饮食对体重的影响。
表1 各组小鼠血清瘦素、脂联素和抵抗素水平的比较(n=6,±s)Table 1 Serum leptin,adiponectin,and resistin level in six groups(n=6,±s)
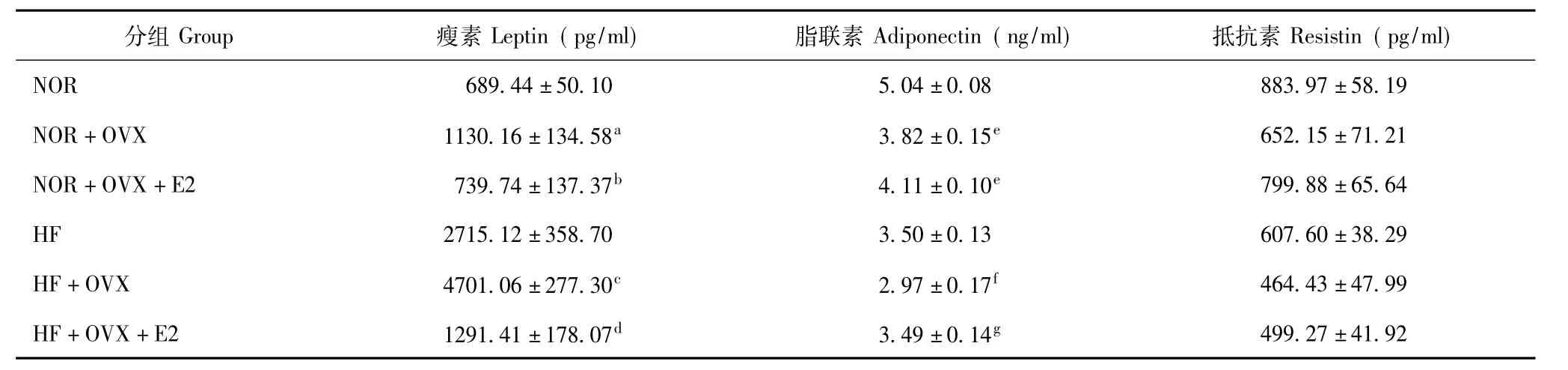
表1 各组小鼠血清瘦素、脂联素和抵抗素水平的比较(n=6,±s)Table 1 Serum leptin,adiponectin,and resistin level in six groups(n=6,±s)
NOR:正常饮食组;NOR+OVX:正常饮食去卵巢组;NOR+OVX+E2:正常饮食去卵巢雌激素替代组;HF:高脂饮食组;HF+OVX:高脂饮食去卵巢组;HF+OVX+E2:高脂饮食去卵巢雌激素替代组;与NOR组比较,aP=0.003;与NOR+OVX组比较,bP=0.007;与HF组比较,cP=0.000; 与HF+OVX组比较,dP=0.000;与NOR组比较,eP=0.000;与HF组比较,fP=0.018;与HF+OVX组比较,gP=0.021NOR:normal diet;NOR+OVX:normal diet with ovariectomy;NOR+OVX+E2:normal diet with ovariectomy and estrogen replacement;HF:high-fat diet; HF+OVX:high-fat diet with ovariectomy;HF+OVX+E2:high-fat diet with ovariectomy and estrogen replacement;aP=0.003 compared with NOR group;bP= 0.007 compared with NOR+OVX group;cP=0.000 compared with HF group;dP=0.000 compared with HF+OVX group;eP=0.000 compared with NOR group;fP=0.018 compared with HF group;gP=0.021 compared with HF+OVX group
分组Group 瘦素Leptin(pg/ml) 脂联素Adiponectin(ng/ml) 抵抗素Resistin(pg/ml) NOR 689.44±50.10 5.04±0.08 883.97±58.19 NOR+OVX 1130.16±134.58a 3.82±0.15e 652.15±71.21 NOR+OVX+E2 739.74±137.37b 4.11±0.10e 799.88±65.64 HF 2715.12±358.70 3.50±0.13 607.60±38.29 HF+OVX 4701.06±277.30c 2.97±0.17f 464.43±47.99 HF+OVX+E2 1291.41±178.07d 3.49±0.14g499.27±41.92
本研究OGTT结果表明,高脂饮食组小鼠在雌激素缺乏的情况下,糖耐量出现减低,雌激素替代治疗后糖耐量有明显改善,但雌激素对正常饮食组小鼠糖耐量的影响不具有显著性。本研究利用胰岛素敏感性评价的“金标准”——高胰岛素正常葡萄糖钳夹试验发现,高脂饮食肥胖组小鼠胰岛素敏感性减低,雌激素替代后也得到显著改善。对于正常饮食非肥胖小鼠组,雌激素缺乏可以使胰岛素敏感性降低,给予雌激素替代治疗后有明显好转。然而,与高脂饮食的3组小鼠相比,去卵巢手术和雌激素替代治疗对正常饮食组小鼠体重并没有显著性影响。由此可见,体重并不一定与胰岛素敏感性成比例改变,在出现超重或肥胖前,雌激素的缺乏可能已引起胰岛素敏感性下降。雌激素对胰岛素敏感性的影响可能独立于体重,还存在直接作用靶点及机制。
脂肪细胞因子也是评价机体慢性炎症状态的较直接因素[14],过多的脂肪堆积和脂肪细胞功能异常可导致脂肪细胞因子表达的调节异常,与多种疾病的发病机制有关。本研究结果显示,高脂饮食组去卵巢小鼠发生瘦素升高与脂联素降低的显著变化,而正常饮食组小鼠在雌激素缺乏的情况下,也已出现瘦素升高及脂联素降低,因此,雌激素缺乏可能直接引发脂肪组织的代谢障碍,从而引起慢性炎症反应,使胰岛素敏感性发生变化,雌激素替代治疗可以使炎症反应得到缓解,改善胰岛素敏感性。本研究中去卵巢与雌激素干预对血清抵抗素的水平没有显著性影响。之前报道有认为抵抗素是促炎症因子,在胰岛素抵抗中发挥一定的作用[15],但也有研究发现在肥胖状态下,抵抗素的分泌可受到抑制[16],且在体重减低的过程可以增加血清抵抗素的水平[17]。本研究可能由于雌激素干预时间有限,没有发现抵抗素显著性的变化。
综上,本研究结果显示,雌激素替代治疗不仅可以通过减轻体重,改善胰岛素抵抗,从而减少糖尿病等代谢综合征的发病率,雌激素还可以直接作用于脂肪组织,影响脂肪代谢,调节脂肪因子水平,增强机体胰岛素敏感性。然而,雌激素作用于脂肪组织的直接作用靶点及其机制,尚需进一步研究。
[1]Global Health Observatory(GHO)data[Z].http:// www.who.int/gho/ncd/risk_factors/overweight/en/.
[2]Krotkiewski M,Bjorntorp P,Sjostrom L,et al.Impact of obesity on metabolism in men and women.Importance of regional adipose tissue distribution[J].J Clin Invest,1983,72(3):1150-1162.
[3]Laws A,Hoen HM,Selby JV,et al.Differences in insulin suppression of free fatty acid levels by gender and glucose tolerance status.Relation to plasma triglyceride and apolipoprotein B concentrations.Insulin Resistance Atherosclerosis Study(IRAS)Investigators[J].Arterioscler Thromb Vasc Biol,1997,17(1):64-71.
[4]Frias JP,Macaraeg GB,Ofrecio J,et al.Decreased susceptibility to fatty acid-induced peripheral tissue insulin resistance in women[J].Diabetes,2001,50(6):1344-1350.
[5]Ford ES.Prevalence of the metabolic syndrome defined by the International Diabetes Federation among adults in the U.S[J].Diabetes Care,2005,28(11):2745-2749.
[6]Crespo CJ,Smit E,Snelling A,et al.Hormone replacement therapy and its relationship to lipid and glucose metabolism in diabetic and nondiabetic postmenopausal women:results from the Third National Health and Nutrition Examination Survey(NHANESⅢ)[J].Diabetes Care,2002,25(10):1675-1680.
[7]Saglam K,Polat Z,Yilmaz MI,et al.Effects of postmenopausal hormone replacement therapy on insulin resistance [J].Endocrine,2002,18(3):211-214.
[8]Salpeter SR,Walsh JM,Ormiston TM,et al.Meta-analysis:effect of hormone-replacement therapy on components of the metabolic syndrome in postmenopausal women[J].Diabetes Obes Metab,2006,8(5):538-554.
[9]Grundy SM,Brewer HJ,Cleeman JI,et al.Definition of metabolic syndrome:report of the National Heart,Lung,and Blood Institute/American Heart Association conference on scientific issues related to definition[J].Arterioscler Thromb Vasc Biol,2004,24(2):e13-e18.
[10]Lovejoy JC,Champagne CM,de Jonge L,et al.Increased visceral fat and decreased energy expenditure during the menopausal transition[J].Int J Obes(Lond),2008,32(6): 949-958.
[11]Howard BV,Adams-Campbell L,Allen C,et al.Insulin resistance and weight gain in postmenopausal women of diverse ethnic groups[J].Int J Obes Relat Metab Disord,2004,28(8):1039-1047.
[12]Lee YS,Li P,Huh JY,et al.Inflammation is necessary for long-term but not short-term high-fat diet-induced insulin resistance[J].Diabetes,2011,60(10):2474-2483.
[13]Bryzgalova G,Lundholm L,Portwood N,et al.Mechanisms of antidiabetogenic and body weight-lowering effects of estrogen in high-fat diet-fed mice[J].Am J Physiol Endocrinol Metab,2008,295(4):E904-E912.
[14]Ouchi N,Parker JL,Lugus JJ,et al.Adipokines in inflammation and metabolic disease[J].Nat Rev Immunol,2011,11(2):85-97.
[15]Steppan CM,Bailey ST,Bhat S,et al.The hormone resistin links obesity to diabetes[J].Nature,2001,409(6818): 307-312.
[16]Way JM,Gorgun CZ,Tong Q,et al.Adipose tissue resistin expression is severely suppressed in obesity and stimulated by peroxisome proliferator-activated receptor gamma agonists[J].J Biol Chem,2001,276(28):25651-25653.
[17]Koebnick C,Wagner K,Garcia AL,et al.Increase in serum resistin during weight loss in overweight subjects is related to lipid metabolism[J].Int J Obes(Lond),2006,30(7): 1097-1103.
Effects of Estrogen on Insulin Sensitivity and Adipokines in Mice
YUAN Tao1,LI Juan1,ZHAO Wei-gang1,FU Yong1,LIU Shuai-nan2,LIU Quan2,SHEN Zhu-fang2
1Key Laboratory of Endocrinology,Ministry of Health,Department of Endocrinology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
2State Key Laboratory of Bioactive Substances and Functions of Natural Medicines,Institute of Materia Medica,CAMS and PUMC,Beijing 100050,China
Objective To study the potential mechanisms via which estrogen exerts its effects on the in-sulin sensitivity in mice.Methods Totally 36 female C57BL/6J mice aged 6 weeks were randomly divided into six groups:normal diet(NOR)group,normal diet with ovariectomy(NOR+OVX)group,normal diet with ovariectomy and estrogen replacement(NOR+OVX+E2)group,high-fat diet(HF)group,high-fat diet with ovariectomy(HF+OVX)group,and high-fat diet with ovariectomy and estrogen replacement(HF+OVX+E2) group.There were six mice in each group.After the ovariectomy based on the grouping,the mice were given normal diet or high-fat diet for 20 weeks.The intervention groups were given estrogen(5 μg/d,subcutaneous injection)for 20 days.Then,the body weight,visceral fat weight,oral glucose tolerance and insulin sensitivity(by euglycemic hyperinsulinemic clamp test),and serum leptin,adiponectin,and resistin levels were compared among these six groups.Results Compared with HF group,the HF+OVX group had significantly higher body weight and visceral fat weight and lower glucose tolerance,which were significantly improved after estrogen replacement therapy(all P<0.05).However,these indicators showed no significant differences among groups with normal diets(all P>0.05).The insulin sensitivity of ovariectomized mice was significantly decreased in both high-fat and normal diet groups and was also improved significantly after estrogen replacement(P<0.05).The serum leptin was increased and adiponectin was decreased significantly in ovariectomized mice,and the improvements of these two adipokines were also statistically significant after estrogen therapy(P<0.05):however,the serum resistin level was not significantly different among these 6 groups(P>0.05).Conclusions Estrogen replacement therapy can improve insulin resistance by lowering body weight.In addition,it can exert its effect directly on adipose tissue,improve the levels of adipokines,reduce the amount of visceral fat,and improve insulin sensitivity in mice.
estrogen;high-fat diet;adipokines;euglycemic hyperinsulinemic clamp test
ZHAO Wei-gang Tel/Fax:010-69155073,E-mal:zhaoweigang@263.net
R3
A
1000-503X(2015)03-0269-05
10.3881/j.issn.1000-503X.2015.03.004
2015-03-12)
赵维纲 电话/传真:010-69155073,电子邮件:zhaoweigang@263.net
国家临床重点专科建设项目(WBYZ2011-873)Supported by the National Key Program of Clinical Science(WBYZ2011-873);第一、二位作者对本文贡献一致The first two authors contributed equally to this article
