不同代乳条件下1~35日龄羔羊瘤胃及其微生物群落的发育
2015-12-20李凤鸣雒秋江牛越峰李维东
李凤鸣 雒秋江 牛越峰 潘 榕 李维东
(新疆农业大学动物科学学院,动物营养实验室,乌鲁木齐 830052)
新生反刍幼畜消化机能的发育是其食性变化的基础,无论饲喂母乳还是代乳,或配制合适的代乳,或早期断奶,都需根据反刍幼畜胃肠消化机能的发育程度来确定。了解羔羊出生后消化机能的发育,特别是瘤胃消化代谢的发育过程,对于羔羊的饲养管理、代乳和开食料的开发都是必要的。羔羊对牛奶粉代乳(milk powder substitute,MS)有很高的消化利用性[1-2];而羔羊对以鱼粉为蛋白质来源的鱼粉代乳(fish meal substitute,FS)存在着消化障碍[1-3]。本文是以牛奶粉代乳饲喂羔羊作为消化发育正常的羔羊,以鱼粉代乳饲喂羔羊作为消化发育障碍的羔羊,研究羔羊日龄、饲喂鱼粉代乳和开食料对羔羊瘤胃及其微生物群落发育的影响,以了解1~35日龄羔羊消化机能发育的特点,为羔羊早期断奶和代乳的配制提供试验基础。
1 材料与方法
1.1 试验设计与试验动物
选取初生重(3 380±328)g的小尾寒羊公羔共56只,分别饲喂牛奶粉代乳(28只)和鱼粉代乳(28只)。羔羊在1~3日龄(出生当天计为0日龄)均由母乳哺育,并喂牛奶粉代乳或鱼粉代乳。从4日龄起全部喂牛奶粉代乳或鱼粉代乳直到20日龄,期间羔羊自由采食开食料。在21日龄随机选取饲喂2种代乳的羔羊各8只停止饲喂代乳,改为仅喂开食料。试验设计及屠宰羔羊的日龄和数量见表1。
1.2 试验饲粮与饲养管理
牛奶粉代乳和鱼粉代乳的制备参照钟涛等[2]的方法进行。液状牛奶粉代乳的干物质含量为14.12%。鱼粉代乳的干物质含量为14.46%。牛奶粉代乳和鱼粉代乳的营养水平见表2。
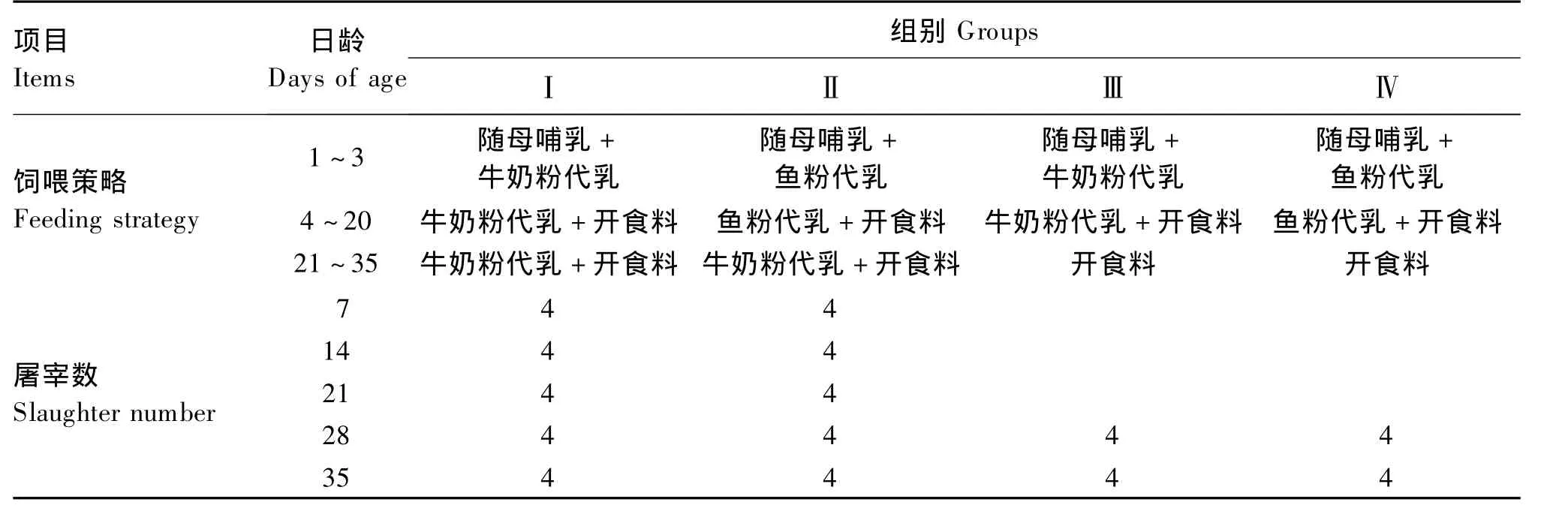
表1 试验设计及屠宰羔羊的日龄和数量Table 1 Experimental designand and the arragement of the days of age and number of slaughter lamb
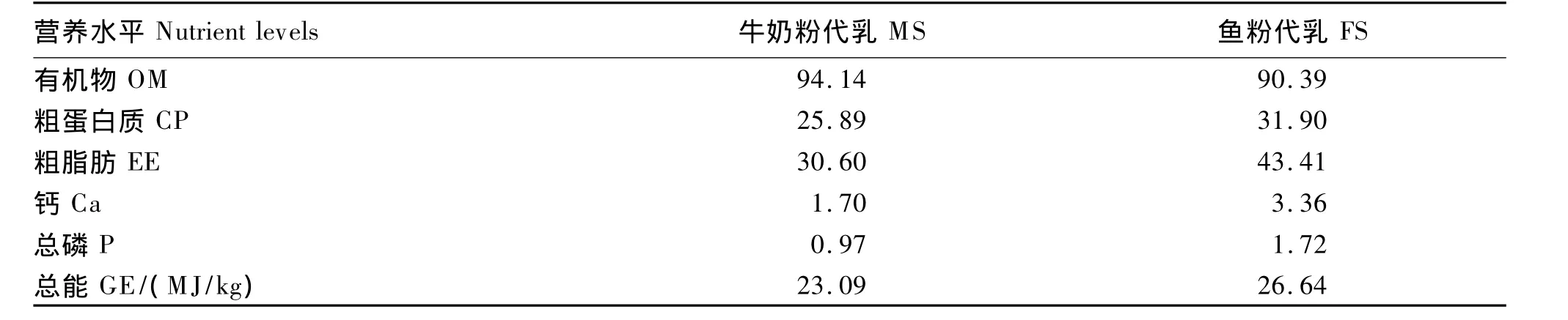
表2 牛奶粉代乳和鱼粉代乳的营养水平(干物质基础)Table 2 Nutrient levels of MS and FS(DM basis) %
羔羊1~3日龄跟随母羊哺乳并补喂牛奶粉代乳或者鱼粉代乳,1、2、3 日龄分别补喂 1、2、3次。4日龄时羔羊全部改为饲喂代乳,代乳每天喂4 次,分别在09:00、14:00、19:00、24:00 饲喂。每次饲喂根据羔羊意愿自由采食,直至羔羊喝饱无吮吸行为止。在进行试验时,若羔羊发生腹泻,则适当减少代乳饲喂量。从1日龄起,即提供开食料,保证羔羊自由舔食。开食料组成及营养水平见表3。
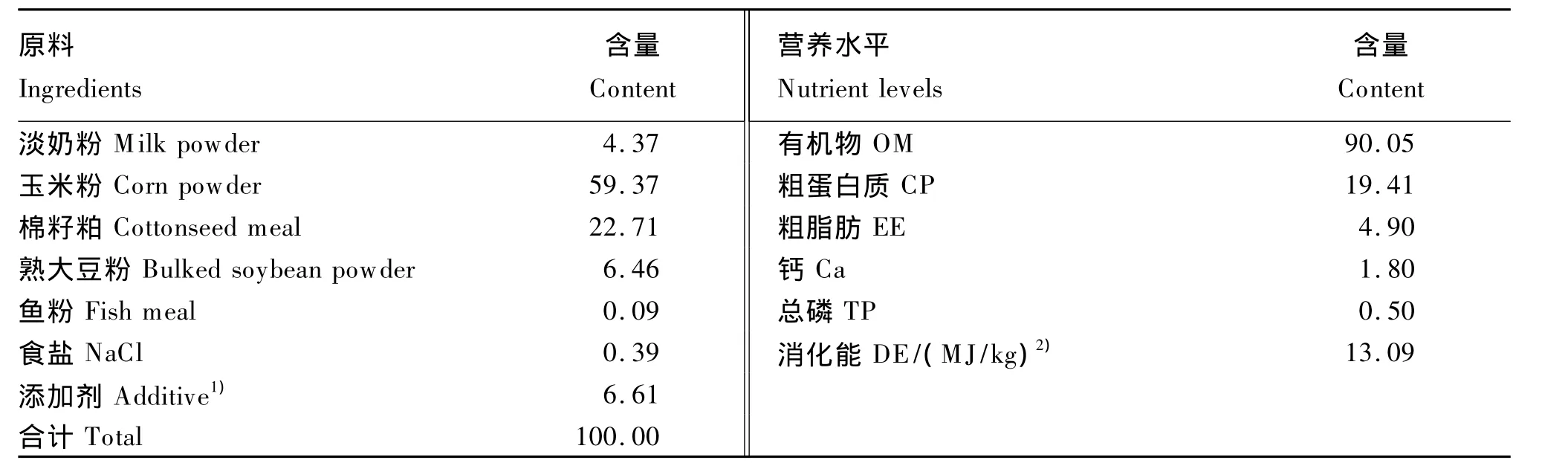
表3 开食料组成及营养水平(干物质基础)Table 3 Composition and nutrient levels of the starter(DM basis) %
1.3 样品的收集与处理保存
在7、14、21、28和35日龄,分别取各组羔羊4只进行屠宰。在早上饲喂后3 h,将羔羊放血致死,立即打开腹腔,分别在食管与瘤胃、网胃与瓣胃处双道结扎,将瘤网胃取出,切开,将胃液取出混匀后取5 mL到冻存管,放入液氮中保存,用于瘤胃液真菌数量的测定,其余瘤胃液用Cyberscan 510型pH计测定并记录,再用4层纱布过滤瘤胃液,取50 mL加1~2滴饱和氯化汞,摇匀后分装于6支10 mL离心管中,加盖密封保存于-20℃冰箱,用于测定瘤胃液挥发性脂肪酸(VFA)和氨态氮(NH3-N)浓度,并进行瘤胃液细菌和原虫的分类计数。
瘤胃液取出后,迅速在瘤胃背盲囊和腹盲囊处各取2处样,取样面积约为1 cm×2 cm,用硬的小纸片铺平、铺展,在液氮中速冻30 s,装入5 mL冻存管后再放入液氮中保存,运回实验室后于-70℃保存,以备测定瘤胃乳头长度和宽度。
1.4 样品测定方法
瘤胃液细菌和原虫显微镜分类计数参照朱文涛等[4]和周封文等[5]的方法。采用实时定量 PCR法检测定瘤胃液真菌数量[6],由生工生物工程(上海)股份有限公司测定完成。
瘤胃液N-NH3浓度测定采用氧化镁蒸馏法。瘤胃液VFA浓度测定采用气相色谱(GC)法[7],取1.0 mL瘤胃液进行样品前处理,使用岛津GC2010型气相色谱仪测定。以巴豆酸为内标,采用程序升温,升温程序为从55℃,以13℃/min升温到200℃,保持0.5 min结束。
用显微镜法测定瘤胃上皮乳头长度和宽度[8]。瘤胃组织样品切片经苏木精-伊红(HE)染色后,在40倍光镜(Motic BA200)下观测其形态结构,并利用Motic Images Advanced 3.2软件测量瘤胃乳头长度、乳头宽度。每个样本观察4个非连续切片,每张切片选取2个视野,每个视野分别测定3组数据,其平均值作为1个测定结果。
1.5 统计分析
试验数据运用Excel 2007进行整理,采用SPSS 19.0统计软件中的独立样本t检验以及单因素方差分析进行数据处理;试验结果均以平均值±标准差表示,差异显著和极显著标准分别设定为P <0.05和 P<0.01水平。
2 结果与分析
2.1 瘤胃液细菌数量
如表4所示,饲喂牛奶粉代乳时羔羊在7日龄瘤胃内即有较多细菌,且主要为瘤胃球菌,占97.4%,而反刍月形单胞菌和大纤维杆菌几乎没有;瘤胃液细菌总数随日龄不断增加,其中大纤维杆菌数也不断增加,但始终没有出现反刍月形单胞菌。饲喂鱼粉代乳时羔羊瘤胃液细菌数量变化情况与饲喂牛奶粉代乳时相似,但在7日龄时细菌总数较少。从21日龄起改喂开食料,28日龄时细菌数量较原先饲喂牛奶粉代乳和鱼粉代乳的羔羊分别增加49.7%(P <0.01)和21.1%(P >0.05),之后均开始减少,与饲喂代乳羔羊的瘤胃液细菌总数无显著差异(P>0.05)。

表4 不同代乳条件下1~35日龄羔羊瘤胃液细菌数量的变化Table 4 The changes of bacteria number in rumen fluid of 1 to 35 days’lambs under the condition of different milk replacers 109个/mL
2.2 瘤胃液原虫数量
如表5所示,羔羊在7日龄瘤胃内即有原虫存在,之后随日龄增加不断增加。在7日龄饲喂鱼粉代乳羔羊的瘤胃液原虫总数比饲喂牛奶粉代乳的低27.3%(P>0.05)。瘤胃内原虫主要为等毛虫、内毛虫和双毛虫,在饲喂牛奶粉代乳的羔羊瘤胃中,分别占原虫总数的44.5%、40.9%和14.5%,在饲喂牛鱼粉代乳的羔羊瘤胃中,分别约占原虫总数的31.3%、58.8%和 10.0%。羔羊在 21日龄改喂开食料,28日龄时原虫总数较原先饲喂牛奶粉代乳和鱼粉代乳的羔羊均极显著减少(P<0.01),之后回升。
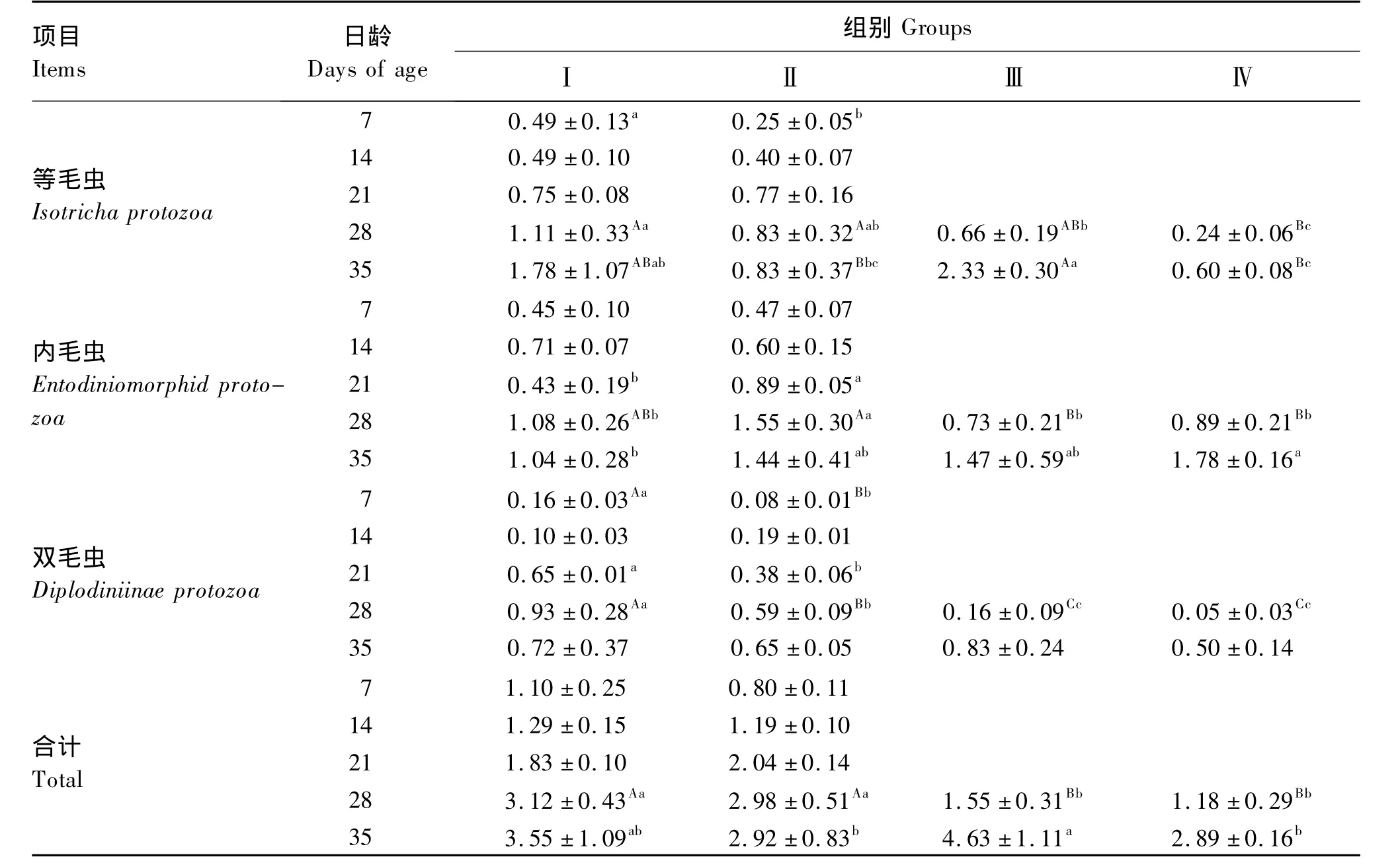
表5 不同代乳条件下1~35日龄羔羊瘤胃液原虫数量的变化Table 5 The changes of protozoa number in rumen fluid of lambs at 1 to 35 days of 1 to 35 days’lambs under the condition of different milk replacers 105个/mL
2.3 瘤胃液真菌数量
如表6所示,饲喂牛奶粉代乳羔羊7日龄瘤胃液真菌数量较少,直到35日龄时才较多。饲喂鱼粉代乳羔羊7日龄时瘤胃内有一定量的真菌,但之后减少,直到35日龄仍无大量真菌出现。羔羊在21日龄改喂开食料,原来饲喂牛奶粉代乳的羔羊瘤胃液真菌数量在35日龄时显著增加(P<0.05),而原先饲喂鱼粉代乳的羔羊瘤胃仍几乎没有真菌存在。
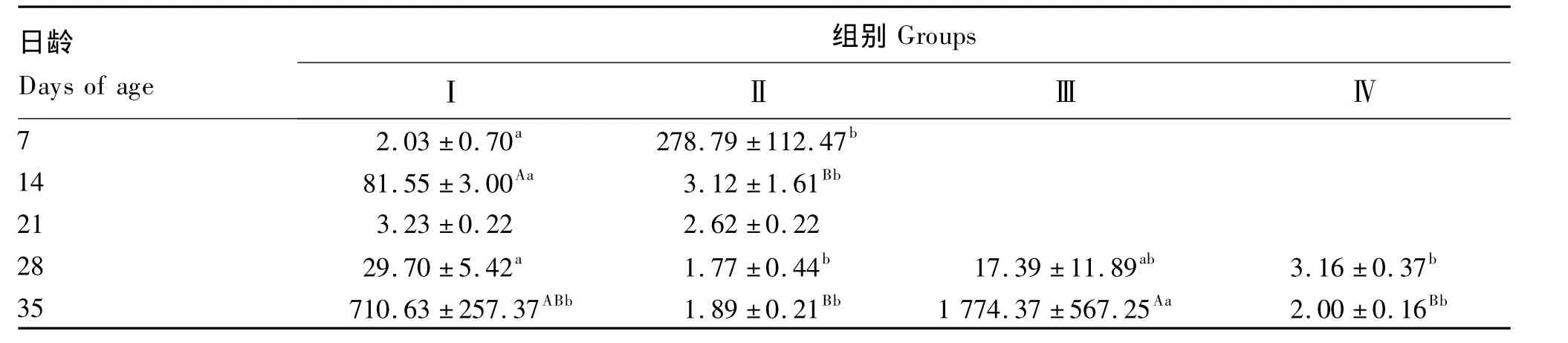
表6 不同代乳条件下1~35日龄羔羊瘤胃液真菌数量的变化Table 6 The changes of fungi number in rumen fluid of 1 to 35 days’lambs under the condition of different milk replacers 103个/mL
2.4 瘤胃特性参数
如表7所示,饲喂牛奶粉代乳羔羊7日龄时瘤胃内即有VFA,且主要为乙酸,之后随日龄增加TVFA浓度不断升高,在35日龄时为72.7 mmol/L。饲喂鱼粉代乳时羔羊瘤胃液TVFA浓度也随日龄增加而总体呈升高趋势,但存在波动,在14日龄有1个发酵高峰。饲喂牛奶粉代乳羔羊转喂开食料28日龄羔羊瘤胃液TVFA浓度升高158.8%(P<0.01),而饲喂鱼粉代乳羔羊转喂开食料28日龄瘤胃液TVFA浓度变化不显著(P >0.05)。
饲喂牛奶粉代乳羔羊7日龄时就有较高得瘤胃液氨态氮浓度,之后随日龄逐渐升高,饲喂鱼粉代乳羔羊瘤胃液氨态氮浓度在14日龄很高,为67.9 mg/dL,之后逐渐降低。饲喂牛奶粉代乳羔羊转喂开食料瘤胃液氨态氮浓度变化不显著(P>0.05),但饲喂鱼粉代乳羔羊转喂开食料瘤胃液氨态氮浓度降低 49.1%(28日龄,P<0.05)和 9.5%(35日龄,P >0.05)。
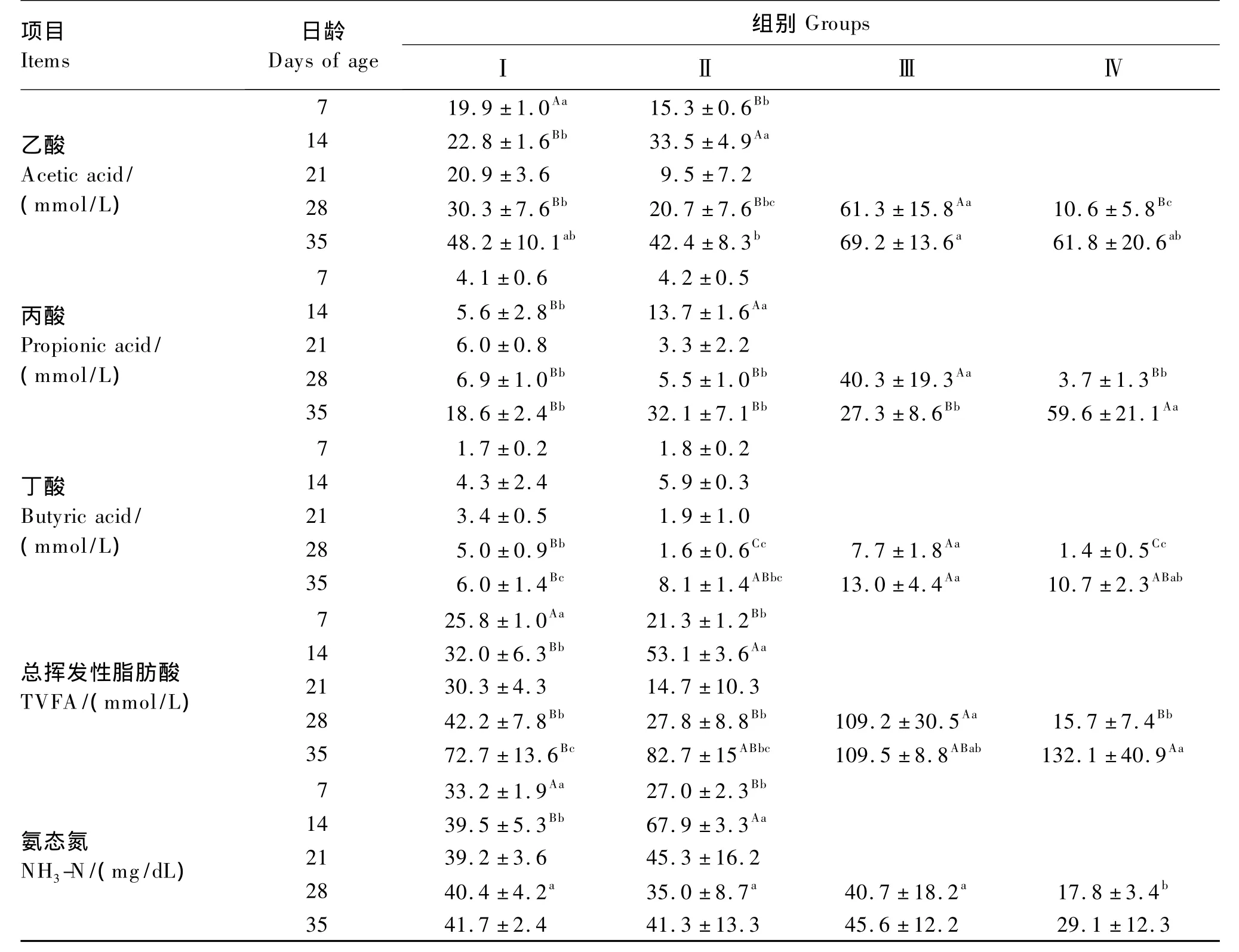
表7 不同代乳条件下1~35日龄羔羊瘤胃特性参数的变化Table 7 The changes of ruminal characteristic parameters of 1 to 35 days’lambs under the condition of different milk replacers
2.5 瘤网胃重量和结构形态
如表8所示,饲喂牛奶粉代乳和鱼粉代乳羔羊瘤网胃重量均随日龄不断增加,且2组之间差异不显著(P>0.05)。饲喂牛奶粉代乳和鱼粉代乳羔羊转喂开食料,对瘤网胃重量变化无显著影响(P >0.05)。
饲喂牛奶粉代乳和鱼粉代乳羔羊瘤胃乳头长度均随日龄增加而增加,但饲喂鱼粉代乳羔羊增加程度低于饲喂牛奶粉代乳羔羊,7和35日龄时饲喂鱼粉代乳羔羊瘤胃乳头长度分别极显著和显著低于饲喂牛奶粉代乳羔羊(P<0.01和P<0.05)。饲喂牛奶粉代乳羔羊转喂开食料,28和35日龄瘤胃乳头长度显著或极显著变短(P<0.05或P<0.01),饲喂鱼粉代乳羔羊转喂开食料乳头长度虽也显著变短(28日龄,P<0.05),但很快恢复。
饲喂牛奶粉代乳羔羊瘤胃乳头宽度随日龄增加而增加,饲喂鱼粉代乳羔羊的也随日龄增加,并且显著或极显著宽于饲喂牛奶粉代乳羔的羊瘤胃乳头宽度(P<0.05或 P <0.01,35日龄除外)。饲喂牛奶粉代乳羔羊转喂开食料28日龄乳头宽度极显著增加(P<0.01),但饲喂鱼粉代乳羔羊转喂开食料乳头宽度有所变窄(P>0.05)。
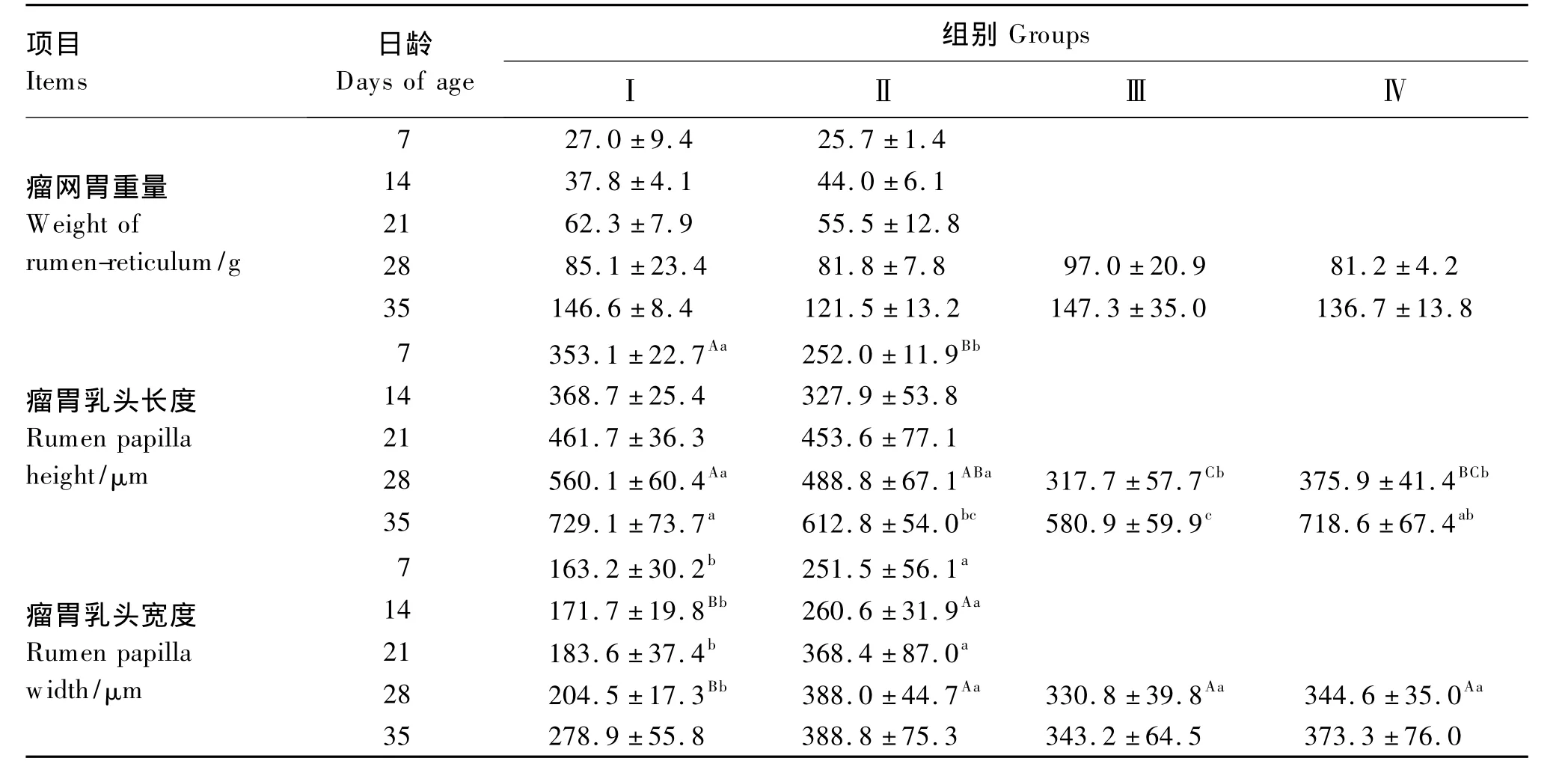
表8 不同代乳条件下1~35日龄羔羊瘤网胃重量和结构形态的变化Table 8 The changes of the weight and morphological structure of rumen-reticulum of 1 to 35 days’lambs under the condition of different milk replacers
3 讨论
3.1 羔羊瘤胃微生物群落的发育
羔羊出生时瘤胃体积较小,约 9.10 g[9],没有微生物驻足[10]。细菌是最早出现在瘤胃内的微生物,动物出生24 h后其瘤胃壁即有兼性厌氧细菌存在[10]。本试验表明,羔羊在7日龄时,瘤胃液中即有较多细菌存在,总数约为成年羊的36.5%[4],其中主要为瘤胃球菌。朱文涛等[11]曾报道45日龄羔羊单位瘤胃液中细菌总数即与成年羊的相近,羔羊与成年羊瘤胃细菌的差别主要是在瘤胃液体积上。研究表明羔羊出生时瘤胃中没有原虫[12],反刍幼畜主要是通过与成年动物直接接触获得原虫,此后羔羊瘤胃液原虫总数将持续增长至2 月龄(瘤胃液中 5.7 ×105个/mL)[13]。本试验结果表明,7、14、21、28和35日龄瘤胃液原虫总数分别为 1.10 ×105、1.29 ×105、1.83 ×105、3.12×105和3.55×105个/mL,分别约为成年绵羊的11.3% 、13.3% 、18.8% 、3.1% 和 36.5%[4],表明羔羊瘤胃液原虫总数是一逐渐增长的过程。Fonty等[13]研究表明2周龄羔羊瘤胃存在较多厌氧真菌,并且数量随日龄缓慢增加。瘤胃液真菌在羔羊10日龄就可以检测到,但在6~8周龄时才达到成年羊水平[14]。在本试验,羔羊瘤胃液真菌数量较少,直到35日龄时才较多,约为成年羊的75%[5],结论与已有文献的相似。从本试验和有关文献看,可以认为羔羊瘤胃液细菌总数增加最快,35日龄可以达到成年羊的97%,其中以瘤胃球菌为主,而反刍月形单胞菌出现较晚;真菌数量增加慢于细菌;而瘤胃液原虫总数要达到成年动物水平约需2个月。
3.2 羔羊瘤胃特性参数发育
3日龄羔羊瘤胃内容物中即有乙酸、丙酸、丁酸存在,分别为 11.0、3.6、0.43 mmol/L[15],而在本试验7日龄时,羔羊瘤胃液的乙酸、丙酸、丁酸浓度分别为19.9、4.1 和1.7 mmol/L,约为成年绵羊的40.09%[16],表明瘤胃发酵在羔羊出生早期即已出现。新生反刍幼畜瘤胃液VFA浓度随日龄不断升高[17],在本试验饲喂牛奶粉代乳的条件下,羔羊瘤胃液TVFA浓度在7、14、21、28和35日龄分别为25.8、32.0、30.3、42.2 和 72.7 mmol/L,因此在 35日龄以后瘤胃液中TVFA浓度才能达到成年绵羊的水平[16]。
羔羊瘤胃液氨态氮的浓度在出生后就会很高,在35日龄以后与成年羊相比并没有很大的不同[16]。本试验结果表明羔羊在7日龄瘤胃液氨态氮浓度就已较高,为33.2 mg/dL,提示代乳蛋白在瘤胃内已有降解,羔羊瘤胃液氨态氮浓度随日龄变化的趋势并不明显。
在本试验,羔羊瘤胃液TVFA浓度随日龄增加不断升高,而pH也不断升高,主要与瘤胃液氨态氮浓度也不断升高有关。
3.3 羔羊瘤网胃重量和结构形态的发育
在本试验,羔羊瘤网胃重量随日龄不断增加,饲喂牛奶粉代乳时瘤网胃重量(y1)与日龄(x1)呈线性相关:y1=0.409 3x1- 14.190(R2=0.909,P <0.05)。瘤胃乳头长度和宽度是影响吸收的重要因素,瘤胃乳头在羔羊出生后不断增长[18]。本试验与已有结果相似,羔羊瘤胃乳头的长度和宽度均随日龄而不断增加,饲喂牛奶粉代乳时分别增长225和125 μm/d。
瘤胃液VFA浓度可能与瘤胃上皮乳头发育有关。在本试验,瘤胃液TVFA浓度(x2)与瘤胃乳头长度(y2)和宽度(y3)呈现显著相关:y2=7.784 6x2+178.48(R2=0.901 8,P < 0.05);与瘤胃乳头宽度呈现极显著相关:y3=2.441 8x2+101.24(R2=0.985,P <0.01),提示 TVFA 浓度决定瘤胃上皮乳头的发育。
3.4 鱼粉代乳和开食料对羔羊瘤胃及其微生物群落发育的影响
关于饲粮(代乳)对早期反刍幼畜瘤胃微生物发育影响的报道较少。在本试验饲喂鱼粉代乳时羔羊瘤胃液细菌总数并无显著变化,转喂开食后有增加趋势,而原虫总数在饲喂鱼粉代乳时有减少趋势,特别是在转喂开食料初期,瘤胃液原虫总数极显著减少,表明羔羊饲粮(代乳)类型主要影响瘤胃液原虫总数。瘤胃液真菌数量在本试验中由于测定变异较大,尚无确切结论,但似乎饲喂牛奶粉代乳时数量较多。
在本试验,饲喂鱼粉代乳对羔羊瘤胃液TVFA浓度没有显著影响,但其随日龄变化的模式与饲喂牛奶粉代乳的不同,在14日龄有一个明显升高再降低的过程。饲喂鱼粉代乳羔羊14日龄时瘤胃液氨态氮浓度过高,提示羔羊已处在氨中毒状态[19]。转喂开食料时原来喂牛奶粉代乳的羔羊瘤胃液TVFA浓度升高,而原来饲喂鱼粉代乳的却急剧降低,氨态氮浓度也降低,之后才恢复,可能与氮采食量减少有关。以上说明饲喂鱼粉代乳羔羊瘤胃液TVFA和氨态氮的浓度变化随日龄和饲粮都有其特殊性。
Jud[20]认为新生反刍动物仅喂乳汁或代乳品,会延滞瘤胃的发育,这些动物的瘤胃比同龄的正常动物小,胃壁较薄,乳头缺乏正常的发育和色泽。Krehbiel[21]认为饲粮不同会引起瘤胃乳头和胃肠黏膜适应性改变。在本试验,饲喂鱼粉代乳和转喂开食料对羔羊的瘤网胃重量均无显著影响,但是,瘤胃乳头长度有减少的趋势,而乳头宽度在饲喂鱼粉代乳时变宽,在饲喂牛奶粉代乳转开食料时也变宽,提示瘤胃乳头宽度与长度对于瘤胃代谢或吸收可能有不同的意义,较劣质的代乳或开食料使瘤胃乳头变宽。
4 结论
①饲喂牛奶粉代乳羔羊瘤胃在7日龄即有原虫和细菌驻足。瘤胃液原虫和细菌总数随日龄增加。7日龄羔羊瘤胃液真菌数量较少,直到35日龄时才较多。
②羔羊瘤胃在7日龄即有VFA和氨态氮,并随日龄增加而增加;羔羊瘤网胃重量、瘤胃乳头长度和宽度随日龄增加而增加。
③饲喂鱼粉代乳时羔羊瘤胃液原虫和细菌总数趋于减少,7日龄时有一定量的真菌,但之后减少,直到35日龄仍无较多真菌出现。瘤胃液VFA和氨态氮浓度变化较为剧烈,瘤网胃重量减少,瘤胃上皮乳头长度变短,但宽度增加。
④21日龄断奶羔羊转喂开食料时瘤胃液细菌总数增加、原虫总数减少,而瘤胃液真菌数量、VFA和氨态氮浓度变化与原先饲喂的代乳类型有关。
[1] ROY JH B,STOBO I JF,SUSAN M,et al.The nutritive value of non-milk proteins for the preruminant calf:the effect of replacement of milk protein by soya-bean flour or fish-protein concentrate[J].The British Journal of Nutrition,1977,38:167 -187.
[2] 钟涛,雒秋江,袁泽湖,等.饲喂鱼粉代乳对9~15日龄小尾寒羊羔羊消化代谢的影响[J].新疆农业大学学报,2012,35(4):259 -264.
[3] HUBER J T,SLADE L M.Fish flour as a protein source in calf milk replacers[J].Journal of Dairy Science,1967,50:1296 -1300.
[4] 朱文涛,雒秋江,古丽尼沙,等.4种日粮条件下30~150日龄羔羊瘤胃消化代谢功能的变化[J].畜牧兽医学报,2005,36(11):1145 -1149.
[5] 周封文,雒秋江,陈勇,等.饲喂秸秆颗粒日粮对绵羊瘤胃和整体消化代谢的影响[J].新疆农业大学学报,2013,(5):345 -351.
[6] 淡瑞芳.用Real Time PCR和DGGE技术研究放牧藏系绵羊瘤胃微生物季节动态[D].博士学位论文.兰州:甘肃农业大学,2006:41-57.
[7] 曹庆云,周武艺,朱贵钊,等.气相色谱测定羊瘤胃液中挥发性脂肪酸方法研究[J].中国饲料,2006,(24):26-28.
[8] 寇慧娟,陈玉林,刘敬敏,等.酵母培养物对羔羊生产性能、营养物质表现消化率及瘤胃发育的影响[J].西北农林科技大学学报:自然科学版,2011,39(8):45-50.
[9] 郎侠.欧拉型藏羊消化系统发育和肌肉H-FABP基因表达规律的研究[D].博士学位论文.兰州:甘肃农业大学,2011:27.
[10] 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004:349-354.
[11] 朱文涛,雒秋江,陈勇,等.3种日粮条件下15~60日龄羔羊的采食、消化和瘤胃消化代谢[J].新疆农业大学学报,2007,30(4):1 -9.
[12] 斯文森.家畜生理学[M].华北农业大学,译.北京:科学出版社,1978:465.
[13] FONTY G,JOUANY JP,SENAUD J.The evolution of microflora,microfauna and digestion in the rumen of lamb from birth to 4 months[J].Canadian Journal of Animal Science,1984,64(5),165 -166.
[14] HOBSON P N,STEWART C S.The rumen microbial ecosystem[M].London:Blackie Academic and Professional,1997:216 -217.
[15] 王彩莲,郝正里,李发弟,等.0~56日龄放牧羔羊消化道的解剖特点和瘤胃功能变化[J].畜牧兽医学报,2010,41(4):417 -424.
[16] 沈美英.日粮内不同粗饲料品质对绵羊瘤胃发酵功能和微生物区系的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2006:33.
[17] GODFREY N W.The functional development of the calf Ⅱ:development of rumen function in the calf[J].The Journal of Agricultural Science,1961,57:177 -183.
[18] ZITNAN R,BOMBA A,SOMMR A.Development of rumen metabolism and ruminal epithelium in lambs[J].Arch Tierernahr,1993,44(3):227 -233.
[19] 刘宗平.动物中毒病学[M].北京:中国农业出版社,2006:329.
[20] JUD H.Rumen development in the dairy calf[J].Advances in Dairy Technology,2005,17:179 -187.
[21] KREHBIEL C R.Applied nutrition of ruminants:fermentation and digestive physiology[J].Professional Animal Scientist,2014,30:129 -139.
