益肾通淋方对尿路感染大鼠TLRs mRNA表达的影响
2015-12-20王树声林晓聪欧阳孔权李思逸陈志强
甘 澍,王树声,林晓聪,欧阳孔权,李思逸,胡 萍,陈志强
实验研究
益肾通淋方对尿路感染大鼠TLRs mRNA表达的影响
甘澍,王树声,林晓聪,欧阳孔权,李思逸,胡萍,陈志强
目的:研究益肾通淋方对尿路感染大鼠肾盂和膀胱组织TLR2和TLR4 mRNA表达的影响。方法:30只雌性SD大鼠随机分为正常对照组、造模组及益肾通淋方组,后2组给予膀胱注入大肠埃希菌菌液建立尿路感染模型,于造模第1、7、14 d检测血常规、尿白细胞、尿细菌各1次,每日测量体温1次;14 d后取肾盂、膀胱黏膜组织检测TLR2和TLR4表达。结果:与正常对照组对比,造模组第1、7 d血白细胞降低(P<0.05),第1、7、14 d尿白细胞合尿细菌均升高(P<0.05)。造模组与益肾通淋方组比较,第1、7 d血白细胞升高(P<0.05),第1、7、14 d尿白细胞和尿细菌显著增多(P<0.01)。正常对照组大鼠肾脏组织TLR2 mRNA为1.03±0.41、TLR4 mRNA为1.66±1.01;膀胱组织TLR2 mRNA为0.23±0.30L、TLR4 mRNA为0.20±0.30。造模组大鼠肾脏组织TLR2 mRNA为2.83±3.00、TLR4 mRNA为2.97±1.85;膀胱组织TLR2 mRNA为0.43±0.06、TLR4 mRNA为2.97±1.85。益肾通淋方组大鼠肾脏组织TLR2 mRNA为1.20±0.47、TLR4 mRNA 1.66±0.95;膀胱组织TLR2 mRNA为0.29± 0.03、TLR4 mRNA为0.22±0.71。与空白组比较,造模组大鼠肾脏和膀胱TLR2/TLR4 mRNA均显著升高(P<0.05);益肾通淋方组大鼠肾脏和膀胱TLR2/TLR4 mRNA则显著降低(P<0.05)。结论:益肾通淋方能下调尿路感染大鼠肾盂和膀胱组织的TLR2、TLR4 mRNA表达。
益肾通淋方;尿路感染;大鼠;TOLL受体
尿路感染是常见的感染性疾病,也是最常见的院内感染之一[1],细菌耐药现状严峻,治疗颇为棘手。TOLL样受体(toll-like receptors,TLRs)是近年来研究热点,它与致病菌识别及天然免疫的激活都有密切关系。我院以扶正与祛邪并重理念创立益肾通淋方,临床运用疗效良好。本研究拟通过对TLRs mRNA信号的检测,探索益肾通淋方可能干预的信号途径及作用靶点。
1 材料与方法
1.1动物30只雌性SPF级SD大鼠,体质量120~150 g,广东省医学实验动物中心提供。许可证号SYXK(粤)2008-0002。饲养于广东省医学动物实验中心动物实验室,室温20~23℃,自然光照,自由进食。
1.2药物益肾通淋方:杜仲、牛膝、黄芪、土茯苓、木香、泽兰,购自康美药业股份有限公司。加入1000 mL纯净水,煎煮成300 mL药液,冷冻保存。E.coil O111B4标准菌株(调节至1010/mL),广东省中医院细菌室提供。
1.3试剂Invitrogen逆转录试剂盒,英潍捷基(上海)贸易有限公司;TakaraPCR试剂盒,宝生物工程(大连)有限公司。TLR2、TLR4和内参GAPDH引物由英潍捷基(上海)贸易有限公司合成。
1.4仪器ABI 7500型荧光定量PCR仪,Applied Biosystems公司。7020型全自动生化分析仪,日本HITACHI公司;MEK-7222K全自动血球计数仪,日本光电公司;Mercury 1200尿液分析仪,台湾Mercury公司;HRQ-A2兽用电子体温计,郑州豪润奇电子科技有限公司。
1.5动物分组、造模30只雌性SD大鼠按数字随机表法随机分为3组,每组10只,分别为空白组、单纯造模组、益肾通淋方组。造模:模型组大鼠术前禁水24 h,接种前用手指轻压大鼠腹部以充分排出残余尿。乙醚轻度麻醉,仰卧位,后腿分开固定。以组织钳夹住尿道乳头一侧,使其略抬离腹部。管道从乳头开口处插入尿道1 cm,将细菌溶于10 μL PBS液中,注入尿道内,每只0.5 mL。接种后1 h内禁水。益肾通淋方组按27 mL/kg体质量给予益肾通淋方灌胃,其余2组均给予等量纯净水灌胃,1次/d,连续14 d。
1.6观察指标与检测方法体温:造模期间每日定时用电子体温计测量肛温1次。
血、尿及肾脏、膀胱标本采集:于造模第1、7、14 d分别取血、尿液检测血常规、尿白细胞计数、尿细菌计数各1次。使用7020型全自动生化分析仪、MEK-7222K全自动血球计数仪、Mercury 1200尿液分析仪检测。
肾脏、膀胱组织TLR2、TLR4 mRNA表达量的测定:造模结束取3组大鼠左侧肾盂黏膜组织、膀胱三角区黏膜组织各100 mg,按Trizol法提取总RNA,超微量分光光度计检测总RNA的A260 nm/A280 nm,计算浓度和纯度。纯度在16~2.0视为合格。将获得的RNA按逆转录试剂盒说明书进行逆转录,逆转录产物存放于-20℃,用于实时荧光定量PCR。按PCR试剂盒说明书操作,在ABI7500型荧光定量PCR仪进行扩增,取管家基因GAPDH作为对照。TLR2的上游引物序列:5'-CCTTGCAGGGACCTTTGCTA-3',下游引物序列:5'-TGATCCATTTGCCCGGAACA-3',扩增产物长度为154bp;TLR4的上游引物序列:5'-ACAGGGCACAAGGAAGTAGC-3',下游引物序列:5'-GTTCTCACTGGGCCTTAGCC-3',扩增长度为149 bp;内参GAPDH上游引物:5'-GCCCAGCAAGGATACTGAGA-3',下游引物:5'-TGGTATTCGAGAGAAGGGAGG-3',扩增长度为159bp。RT-PCR循环条件:95℃预变性30 s;95℃变性5 s,60℃退火34 s,60℃延伸1 min,共40个循环。最后72℃延伸10 min,4℃保存。
1.7统计学方法采用SPSS 17.0软件进行统计分析,所有数据以(±s)表示,组间比较采用单因素方差分析,组内两两比较结果均采用LSD检验,P<0.05差异有统计学意义。
2 结果
2.1观测指标与空白组比较,造模组、益肾通淋方组第7 d体温升高,益肾通淋方组第14 d体温下降(P<0.05)。与造模组比较,益肾通淋方组第14 d体温下降(P<0.05)。见表1。
表1 3组大鼠各时间点体温比较(±s,n=10,℃)
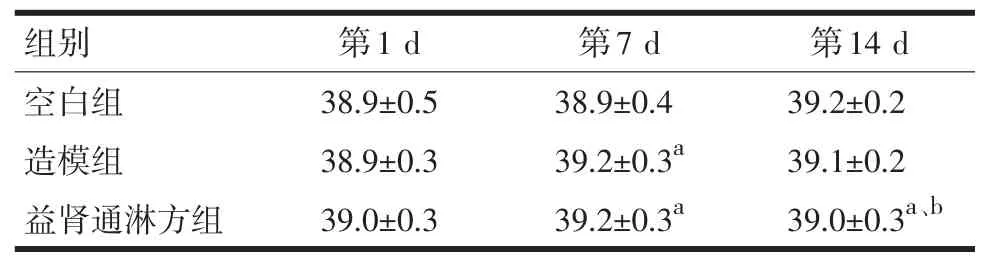
表1 3组大鼠各时间点体温比较(±s,n=10,℃)
注:与空白组比较,aP<0.05;与造模组比较,bP<0.05
组别空白组造模组益肾通淋方组第1 d 38.9±0.5 38.9±0.3 39.0±0.3第7 d 38.9±0.4 39.2±0.3a 39.2±0.3a第14 d 39.2±0.2 39.1±0.2 39.0±0.3a、b
与空白组比较,造模组、益肾通淋方组第1 d和第7 d血白细胞显著下降(P<0.05);与造模组比较,益肾通淋方组第1 d和第7 d血白细胞显著偏高(P<0.05)。见表2。
表2 3组大鼠各时间点血常规白细胞计数比较(±s,n=10,×109/L)
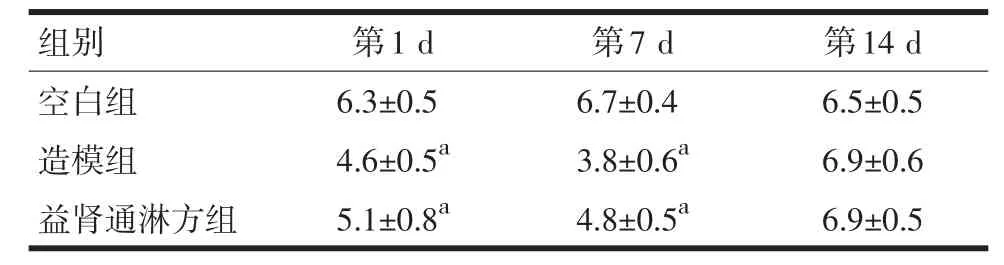
表2 3组大鼠各时间点血常规白细胞计数比较(±s,n=10,×109/L)
注:与空白组、造模组比较,aP<0.05
组别空白组造模组益肾通淋方组第1 d 6.3±0.5 4.6±0.5a5.1±0.8a第7 d 6.7±0.4 3.8±0.6a4.8±0.5a第14 d 6.5±0.5 6.9±0.6 6.9±0.5
与空白组比较,造模组第1、7、14 d的尿白细胞计数均显著增多(P<0.05);与空白组比较,益肾通淋方组第1 d的尿白细胞计数显著增多(P<0.05),第7、14 d无差异(P>0.05);与造模组比较,益肾通淋方组第1、7、14 d尿白细胞显著减少(P<0.05)。见表3。
表3 3组大鼠各时间点尿白细胞计数比较(±s,n=10,×103个/mL)

表3 3组大鼠各时间点尿白细胞计数比较(±s,n=10,×103个/mL)
注:与空白组比较,aP<0.05;与造模组比较,bP<0.05
组别空白组造模组益肾通淋方组第1 d 2.2±0.3 10±1.2a4.3±0.8a、b第7 d 2.3±0.2 15±2.3a1.9±0.3b第14 d 2±0.2 8.3±1.5a2.1±0.4b
与空白组比较,造模组和益肾通淋方组第1、7、14 d的尿菌落总数均显著增多(P<0.05);与造模组比较,益肾通淋方组第1、7、14 d尿菌落总数显著减少(P<0.05)。见表4。
表4 3组大鼠各时间点尿菌落总数比较(±s,n=10,×10E5 CFU/mL,g)

表4 3组大鼠各时间点尿菌落总数比较(±s,n=10,×10E5 CFU/mL,g)
注:与空白组比较,aP<0.05;与造模组比较,bP<0.05
组别空白组造模组益肾通淋方组第1 d 5±1.1 528±21a208±8a、b第7 d 5±1.2 949±31a50± 5.6a、b第14 d 5±1.5 426±17a12± 3.2a、b
2.2肾脏TLR2 mRNA、TLR4 mRNA表达采用实时荧光定量PCR检测肾脏组织中TLR2/TLR4 mRNA表达情况,见表5。与空白组比较,造模组TLR2 mRNA、TLR4 mRNA均显著升高(P<0.05);与空白组比较,益肾通淋方组TLR2 mRNA、TLR4 mRNA无显著差异(P>0.05);与造模组比较,益肾通淋方组TLR2 mRNA、TLR4 mRNA均显著下降(P<0.05)。
2.3膀胱TLR2、TLR4 mRNA表达采用实时荧光定量PCR检测膀胱组织中TLR2/TLR4 mRNA表达情况,见表6。与空白组比较,造模组TLR2 mRNA、TLR4 mRNA均显著升高(P<0.05);与空白组比较,益肾通淋方组TLR2 mRNA、TLR4 mRNA无显著差异(P>0.05);与造模组比较,益肾通淋方组TLR2 mRNA、TLR4 mRNA均显著下降(P<0.05)。
表5 3组大鼠肾脏TLR2 mRNA、TLR4 mRNA比较(±s,n=10)

表5 3组大鼠肾脏TLR2 mRNA、TLR4 mRNA比较(±s,n=10)
注:与空白组比较,aP<0.05;与造模组比较,bP<0.05
组别空白组造模组益肾通淋方组TLR2 1.03±0.41 2.83±3.00a1.20±0.47bTLR4 1.66±1.01 2.97±1.85a1.66±0.95b
表6 3组大鼠膀胱TLR2 mRNA、TLR4 mRNA表达比较(±s)
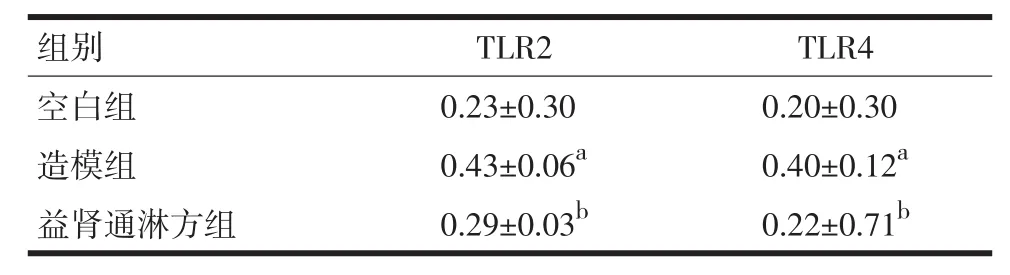
表6 3组大鼠膀胱TLR2 mRNA、TLR4 mRNA表达比较(±s)
注:与空白组比较,aP<0.05;与造模组比较,bP<0.05
组别空白组造模组益肾通淋方组TLR2 0.23±0.30 0.43±0.06a0.29±0.03bTLR4 0.20±0.30 0.40±0.12a0.22±0.71b
3 讨论
研究显示,大约50%的女性会发生尿路感染,医疗费用超过10亿美元[2]。尿路感染也是最常见的医院内感染之一。Mohnarin报告[3-4],我国最常见的尿路感染致病菌是大肠埃希菌。TLRs受体是近年来的研究热点。Pudney等[5]研究发现,男性尿道海绵部的白细胞内有TLR2、TLR3、TLR5、TLR7和TLR9表达,并且是生殖系统中表达TLRs最多的部位,前列腺上皮细胞内也有各种TLRs的表达。Ayari等[6]通过反转录方法发现,正常人膀胱上皮细胞可表达TLR2、TLR3、TLR4、TLR5、TLR7和TLR9。TLRs被证实不仅与致病菌识别,还与天然免疫的激活都有密切关系。在感染期,上皮细胞在病原-宿主相互作用中为宿主提供一个结构屏障,TLRs分布于细胞表面,最先完成其对病原体的识别作用。这也使得无论是上尿路还是下尿路的上皮细胞,在尿路感染时都能通过TLRs及时发现大肠埃希菌。TLRs对炎症细胞的募集有着重要作用。Suhs等[7]发现,TLR4缺陷位点的C3H/HeJ小鼠不能清除实验性的尿路感染。此外,最近研究[8]表明,TLRs还可识别某些内源性配体,如TLRl、TLR2、TLR3、TLR4、TLR6可识别热休克蛋白、坏死的小管细胞及细胞外基质成分等。
祖国医学早在《内经》即有对尿路感染的记录,称之为“淋”或“淋閟”。认为淋证的主要病机为湿热蕴结下焦,肾与膀胱气化不利,病位在膀胱和肾,与肺、肝、脾有关。现代中医在尿路细菌感染方面亦做了大量研究工作。在临床中,中医药联合抗生素在临床获得良好疗效。如张邦升等[9]运用口服三金片联合左氧氟沙星治疗尿路感染获得良好疗效,明显优于单纯抗生素治疗组。周燕萍等[10]采用热淋清片联合诺氟沙星片口服治疗单纯性尿路感染,临床治愈率达82.8%,总有效率达91.4%,均明显高于单纯抗生素组(P<0.05),同时治疗组的主要症状消除时间明显短于单纯抗生素组(P<0.05),细菌清除率明显高于单纯抗生素组(P<0.05),治疗期间未发现明显不良反应。单纯中药的治疗与抗生素对比疗效依然显著,如孙红等[11]在临床使用劳淋汤治疗女性糖尿病患者反复尿路感染疗效显著,并且能降低久治不愈的严重后果,明显改善患者的生活质量及预后,且临床未见不良反应。高碧峰等[12]将72例复发性尿路感染患者随机分为中药治疗组及西药对照组,治疗组给于温肾健脾方和隔姜灸,对照组给于呋喃妥因,疗程4周,观察临床症状、尿常规、尿培养改善情况。结果治疗组临床总有效率88.9%,对照组69.4%,差异有统计学意义(P<0.05)。除了对尿路感染治疗临床疗效的研究,现代中医亦探讨了中医药与感染免疫学之间的联系,并得到大量理论与临床研究的反复证实。如有学者研究了滋阴通淋方对尿路感染大鼠血清白介素-10(IL-10)及单核细胞趋化蛋白-1(MCP-1)影响,以及肾脏病理变化,结果提示中药对慢性尿路感染有免疫调节和抗炎的双重作用[13]。徐震宇等[14]通过对二丁二仙汤的大鼠实验研究证实,二丁二仙汤能降低实验大鼠尿中胱抑素悦和白细胞介素远的排泄,减轻慢性尿路感染导致的肾小管损伤。刘又贤等[15]利尿通淋合并调血中药治疗慢性尿路感染研究中,发现此类中药不仅能有效控制尿路感染,还可通过改善肾血流而提高机体免疫力,提高抗病能力。
益肾通淋方是我院陈志强教授通过前期对尿路感染症候群的回顾性研究创立的。此方扶正与祛邪并重为理念,强调治疗时重视扶正,尤其是慢性尿路感染者以扶正为主,驱邪为辅的理念,在临床运用中对反复尿路感染患者获得较好疗效。本实验采用目前尿路感染最常见的大肠埃希菌液造模,造模第1、 7、14 d分别检测血常规、尿白细胞、尿细菌检测各1次,造模期间每日测量体温1次,14 d后取肾、膀胱组织检测TLR2 mRNA和TLR4 mRNA。结果表明,益肾通淋方在早期即可快速显著的降低尿白细胞和尿细菌计数,首先说明其对控制尿路感染有积极作用。其次,造模组大鼠在实验过程中体温较高,并且血常规白细胞计数下降明显,考虑出现了一过性的尿源性脓毒血症的可能较大。相对于造模组,益肾通淋方组体温相对平稳,并且血常规白细胞计数下降较少,考虑益肾通淋方对抑制和减少脓毒血症的发生有积极作用。再次,在实验过程中造模组大鼠的肾盂和膀胱黏膜的TLR2 mRNA、TLR4 mRNA的表达均出现明显增高,结合造模组大鼠出现一过性脓毒血症的情况,考虑TLRs mRNA出现的高表达,可能是炎症风暴或脓毒症休克的启动因素。反观益肾通淋方组,大鼠TLRs mRNA的表达虽然相对空白组增高,但相对造模组有明显的下调。分析原因可能是⑴益肾通淋方本身的抑菌作用使得体内细菌量明显减少,诱发的炎症反应相对较小,因此TLRs mRNA表达相对较小;⑵益肾通淋方本身可能对调节TLRs mRNA的表达有一定作用,能抑制机体过度的炎症递质释放,减少了因炎症风暴所致的脓毒血症甚至脓毒症休克表现。
综上所述我们认为,益肾通淋方本身有一定的抑菌作用,并且其很可能是通过调控TLRs信号的表达,调节了机体的免疫机能,从而达到控制和治疗尿路感染的作用。
[1]Shigemura K,Tanaka K,Okada H,et a1.Pathogenoccurrence and antimicrobial susceptibility of urinary tract infection cases during a 20-year period(1983-2002)at a single institution in Japan[J].Jpn J Infect Dis,2005,58(5):303-308.
[2]Mehnert-Kay SA.Diagnosis and management of uncomplicated urinary tract infections[J].Am Fam Physician,2005,72(3): 451-456.
[3]高磊,肖永红.Mohnarin 2008年度报告:男性尿标本细菌耐药监测研究[J].中国抗生素杂志,2010,35(8):633-637.
[4]朱燕,肖永红.Mohnarin2008年度报告:女性尿标本细菌耐药监测研究[J].中国抗生素杂志,2010,35(8):639-640.
[5]Pudney J,Anderson DJ.Expression of Toll—like receptors in geni⁃tal tract tissues form normal and HIV-infected men[J].Am J Re⁃prod lmmunol,2011,65(1):2843.
[6]Ayari C,Bergeron A,LaRue H,et al.Toll-like receptors in normal andmalignanthumanbladders[J].JUrol,2011,185(5):1915-1921.
[7]Suhs KA,Marthaler BR,Welch RA,et al.Lack of association be⁃tween the Tlr4(Lpsd/Lpsd)genotype and increased susceptibility toeseheriehia coli bladder infections infemale C3H/HeJ mice[J]. MBio,2011,2(3):e00094-00111.
[8]Matijevic T,MaJjanovic M,Pavelic J.Functionally active toll-like receptor 3 on human primary and metastatic cancer cells[J]. Scand J Immunol,2009,70(1):18-24.
[9]张邦升,何芙蓉.口服三金片联合左氧氟沙星治疗尿路感染临床疗效观察[J].中国医药,2014,8(4):501-502.
[10]周燕萍,白海燕.热淋清片联合诺氟沙星片治疗单纯性尿路感染的疗效观察[J].药学与临床,2013,16(4):580-581.
[11]孙红,曹茂森.劳淋汤治疗女性糖尿病患者反复尿路感染临床观察[J].中国保健营养,2014,24(3):1196.
[12]高碧峰,雷根平,李小会等.温肾健脾方配合隔姜灸治疗复发性尿路感染疗效观察[J].陕西中医,2013,34(8):956-957.
[13]庞晓英,冯继伟,高继宁.滋阴通淋方对慢性尿路感染大鼠免疫功能的影响[J].上海中医药杂志,2009,43(6):72-74.
[14]徐震宇,顾向晨,王怡.二丁二仙汤对慢性尿路感染老年雌性大鼠肾小管损伤的作用[J].中国中西医结合肾病杂志,2013,14(4):299-301.
[15]刘又贤,焦安钦.利尿通淋调血法治疗慢性尿路感染的临床研究[J].云南中医中药杂志,2014,35(2):16-17.
(收稿:2014-12-16修回:2015-03-10)
(责任编辑张亚强)
The Effect of Yishen Tonglin Decoction on Urinary Tract Infection Rats on Toll-Like Receptors(TLRs)mRNA Expression
GAN Shu,WANG Shu-sheng,LIN Xiao-cong,et al.Department of Urinary Surgery, Guangdong Provincial TCM Hospital,Guangzhou(510120),China
ObjectiveTo evaluate the effect of Yishen Tonglin Decoction on TLR2 and TLR4 mRNA ex⁃pression of urinary tract infection rats’kidney and bladder tissue.MethodsThirty female SD rats were ran⁃domly divided into 3 groups:normal group,model group and Yishen Tonglin Decoction group.The last two groups were established urinary infection models with bladder injected E.coli concerntration.Blood routine test, urinal leukocyte count and urinal bacterial test were examind on in the first,7th and 14th days.Body tempera⁃ture was tested every day.Pelvic and bladder tissue were taken 14 days after the tests of the TLR2 and TLR4 mRNA.ResultsCompared to the normal group,the blood white cell of the model group decreased on the first and 7th days(P<0.05),the urinal white cell count and urinal bacterial count of the model group were all in⁃creased on the first,7th and 14th days(P<0.05);Compared to the Yishen Tonglin Decoction group,the blood white cell counts of the model group increased on the 1st and 7th days(P<0.05).The urinal white cell and uri⁃nal bacterial counts increased on the first,7th and 14th days(P<0.01);The normal groups’kidney tissue TLR2 mRNA was 1.03±0.41,TLR4 mRNA was 1.66±1.01,blader tissue TLR2 mRNA was 0.23±0.30,TLR4 mRNA was 0.20±0.30;the model groups’kidney tissue TLR2 mRNA was 2.83±3.00,TLR4 mRNA was 2.97±1.85;the blader tissue TLR2 mRNA 0.43±0.06,TLR4 mRNA 2.97±1.85.The Yishen Tonglin Decoction groups’kidney tis⁃sue TLR2 mRNA was 1.20±0.47,TLR4 mRNA was 1.66±0.95;the blader tissue TLR2 mRNA was 0.29±0.03, TLR4 mRNA was 0.22±0.71.Compared to the model group,the TLR2/TLR4 mRNA of the model group was significantly increased(P<0.05).The TLR2/TLR4 mRNA of the Yishen Tonglin decoction was signifi⁃cantly decreased(P<0.05).ConclusionsYishen Tonglin Decoction can down-regulate the pelvic and blad⁃der TLR2、TLR4 mRNA expression of the urinary infection rats.
Yishen Tonglin decoction;urinary tract infection;rats;toll-like receptors
Q95-33;R285.6
A
1007-6948(2015)03-0270-05
10.3969/j.issn.1007-6948.2015.03.018
广东省中医药局课题(20121173);广东省中医院朝阳人才专项
广东省中医院泌尿外科(广州 510120)
陈志强,E-mail:zhi57@163.com
