伯乐树幼苗对不同土壤含水量的生理生态响应
2015-12-20刘菊莲夏丽芝郑伟成季国华叶飞英胡有金陶月良
刘菊莲,夏丽芝,郑伟成,季国华,叶飞英,胡有金,陶月良
(1. 浙江九龙山国家级自然保护区管理局,浙江 遂昌323300;2. 温州科技职业学院, 浙江 温州 325006;3. 温州大学生命与环境科学学院, 浙江 温州 325035)
伯乐树幼苗对不同土壤含水量的生理生态响应
刘菊莲1,夏丽芝2,郑伟成1,季国华1,叶飞英1,胡有金1,陶月良3
(1. 浙江九龙山国家级自然保护区管理局,浙江 遂昌323300;2. 温州科技职业学院, 浙江 温州 325006;3. 温州大学生命与环境科学学院, 浙江 温州 325035)
为了明确伯乐树幼苗对土壤含水量的响应,比较研究了不同土壤含水量下伯乐树幼苗的形态学指标及相关光合参数。结果表明,在土壤相对含水量大于40%时,不同处理之间的蒸腾速率无显著差异 (P>0.05);40%土壤含水量的条件下,水分利用效率和气孔限制值较高(P<0.05),而此时的表观光合速率、CO2利用效率和蒸腾速率均最低(P<0.05)。随着土壤含水量的降低,伯乐树幼苗叶片的最大光合速率(Pmax)、光补偿点(VLCP)、光饱和点(VLSP)、最大羧化速率(Amax)和羧化效率(RCU)整体上均呈下降趋势,而CO2补偿点(VCCP)和CO2饱和点(VCSP)均呈上升的趋势。100%与40%处理相比,两者除暗呼吸速率(Rn)未达到显著差异 (P>0.05) 外,其余参数差异的均达到显著水平(P<0.05)。形态学指标的结果也显示,在土壤含水量相对较高的环境下(100%和80%),伯乐树幼苗的株高、冠幅、分枝数和生物量等均较大(P<0.05),表现出良好的生长态势。综合本次实验结果表明,较高的土壤相对含水量(>60%)有利于伯乐树的生长发育。建议在进行伯乐树幼苗繁育时,应适当的增加土壤含水量。
伯乐树;幼苗;土壤含水量;形态;光合
伯乐树Bretschneidera sinensis又名钟萼木,落叶乔木。它是我国特有的单种科植物,是第三纪热带植物区系的孑遗种,对研究被子植物的系统发育及古地理、古气候等具有重大的科学价值。由于伯乐树星散分布,个体数量极少,被列为国家一级保护植物[1]。目前国内外对伯乐树的研究较少,主要集中在人工育苗[2-3]、系统分类[4-6]、化学成分[7]、种子休眠特性[8-9]及分子水平[10-11]上。
土壤水分状况是影响林木生长的关键因素之一。目前,全球性的水资源缺乏问题已经越来越突出。由于降水的季节和地域分布极不均匀,水资源短缺日趋明显,土壤有效含水量逐年减少[2,12]。据预测,我国的干旱和半干旱区在未来将变得更加干旱[13-14]。这必将影响植物个体的生长、发育和繁殖,以及陆地生态系统的分布和生产力[15]。因此,对植物与土壤水分关系的探讨已成为植物生理生态学研究领域的热点[16-17]。根据对湖北木林子国家级自然保护区、湖南壶瓶山国家级自然保护区、浙江九龙山国家级自然保护区、浙江乌岩岭国家级自然保护区以及浙江的江山、福建的蒲州等地进行野外调查发现,伯乐树主要分布在水沟两侧,在阴湿环境下伯乐树生长较好。然而,目前尚未见伯乐树幼苗对水分的响应的报道。明确伯乐树幼苗对不同土壤含水量的光合生理响应,有利于进一步研究伯乐树的适宜生境特征,进而为伯乐树的繁育和合理保护,以及开发利用等提供参考。
1 材料与方法
1.1 植物材料与处理
种子于2011年10月采自浙江九龙山国家级自然保护区,同时收集原生土壤带回实验室。清水洗去种子的肉质外种皮,置于室内稍做晾干。将洗净的种子置于湿沙中贮藏,种沙比为1∶1,沙子含水量介于5.1%~6.0%,定期翻动种子并检查温度与水分状况。
2012年3月将萌动的种子播种在装有土壤(pH值7.2、有机质15.7 g/kg、全氮1.2 g/kg、速效磷23.0 mg/kg、速效钾126.0 mg/kg)的塑料箱(46 cm×34 cm×22 cm)中,室内测定土壤的最大持水量(26.9%±1.4),视为100%含水量,其他土壤相对含水量(80%、60%和40%)按比例减少加水量即可获得。利用电子秤称量箱子和土壤的重量,计算水分的流失,然后补加水分,使其含水量在相应处理的±5%以内波动。玻璃温室中培养,8:00至18:00进行补光。每个处理 3个重复,每箱留苗20株。
1.2 测量及计算方法
光合速率的测定:9:00~11:30时,采用美国LI-cor公司生产的Licor-6400型便携式光合作用测定系统测定伯乐树幼苗的净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、大气CO2浓度(Ca)、气孔导度(Gs)等。另外计算气孔限制值(Ls) =1-Ci/Ca[18],水分利用效率(WUE)=Pn/Tr[19]和 CO2利用效率(CUE)=Pn/Ci[20]。
光响应曲线的测定:设定温度为25℃,CO2浓度为 400 μmol·mol-1,空气相对湿度为 50% ~ 70%,光源诱导30 min后,应用Li-6400-02B红蓝光光源提供不同的光合有效辐射强度(PARμmol·m-2s-1),分别在PAR为1 500、1 200、1 000、800、600、400、200、150、100、50、20、0 μmol·m-2s-1下测定不同含水量下伯乐树叶片的Pn(μmolCO2·m-2s-1),然后拟合光响应曲线[21],得出最大光合速率 (Pmax)、初始量子效率 (α)、暗呼吸速率 (Rn)、光补偿点 (LCP)和光饱和点 (LSP)。
CO2响应曲线的测定:设定PAR为800 μmol·m-2s-1作为测定光强,光源诱导30 min后,采用Li-6400液化CO2钢瓶提供不同的CO2体积分数,分别在CO2浓 度 为 1 000、800、600、400、200、150、100、80 和 50 μmol·mol-1的条件下测定叶片Pn,然后根据公式:A=[(CU*Ci*Amax)/(CU*Ci+Amax)]-Rd拟合CO2响应曲线,得出最大羧化速率(Amax)、表观羧化速率(CU)、光下呼吸速率(R)、CO2补偿点(CCP)和CO2饱和点(CSP)[22-23]。
所有数据测定于2012年7月25~30日进行,此时伯乐树处于旺盛生长期。每处理随机选5株长势较为一致的幼苗,取自下而上第二片复叶完全展开的顶叶,结果取平均值。测量结束,全株挖出,分别测量其株高、冠幅、分枝数、根长,以及烘干前后的根、茎和叶的重量,分别计算出根、茎和叶的相对含水量。
1.3 数据分析
运用SPSS12.0拟合光响应曲线和CO2响应曲线;SPSS12.0进行显著性检验。
2 结果与分析
2.1 不同土壤含水量对伯乐树叶片光合参数的影响
在土壤相对含水量较高(100%和80%)情况下,伯乐树幼苗叶片的CO2利用效率均最高(P<0.05);在土壤相对含水量大于40%时,不同处理之间的伯乐树幼苗的蒸腾速率无显著差异 (P>0.05);40%土壤含水量的条件下,水分利用效率和气孔限制值较高(P<0.05),而此时的光合速率、CO2利用效率和蒸腾速率均最低(P<0.05) (见表1)。
2.2 不同土壤含水量对伯乐树幼苗叶片光响应的影响
通过模型拟合光响应曲线参数见表2。由表2可知,随着土壤含水量的降低,伯乐树幼苗叶片的最大光合速率(Pmax)、光补偿点(LCP)和光饱和点(LSP)整体上均呈下降趋势。100%和40%处理两者相比,除暗呼吸速率未达到显著差异 (P>0.05) 外,其余参数差异的均达到显著水平(P<0.05)。

表1 不同土壤含水量下伯乐树幼苗光合速率参数的比较(平均数±标准误差)†Table 1 Effects of water gradients on photosynthetic parameters of B. sinensis seedlings (mean ± SD)

表2 不同土壤含水量下伯乐树幼苗光响应参数的比较(平均数±标准误差)Table 2 Effects of water gradients on photoresponse parameters of B. sinensis seedlings (mean±SD)
2.3 不同土壤含水量对伯乐树幼苗叶片CO2响应曲线的影响
不同土壤含水量处理下的伯乐树幼苗叶片CO2响应曲线拟合参数见表3。由表3可知,随着土壤含水量的下降,伯乐树幼苗叶片的最大羧化速率(Amax)和羧化效率(CU)呈下降趋势;而CO2补偿点(CCP)和CO2饱和点(CSP)均呈上升的趋势。
2.4 伯乐树幼苗形态对不同土壤含水量的响应
由表4可知,与其他处理相比,在40%相对土壤含水量下,伯乐树的幼苗根冠比最大,但其处理下幼苗的株高、冠幅、生物量、根长、根和茎的含水量均较小(P<0.05),其分枝数也较少(P<0.05)。而100%土壤相对含水量下的伯乐树幼苗株高、冠幅、生物量、分枝数等均最高(P<0.05)。
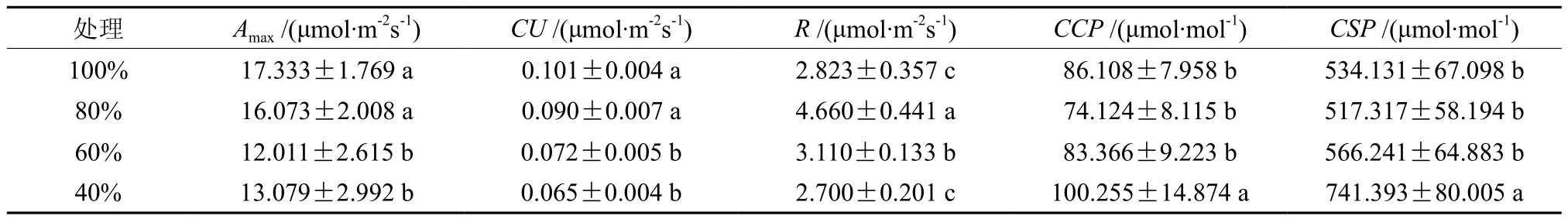
表3 不同土壤含水量下伯乐树幼苗CO2响应参数的比较(平均数±标准误差)Table 3 Effects of water gradients on CO2 response parameters of B. sinensis seedlings (mean ± SD)
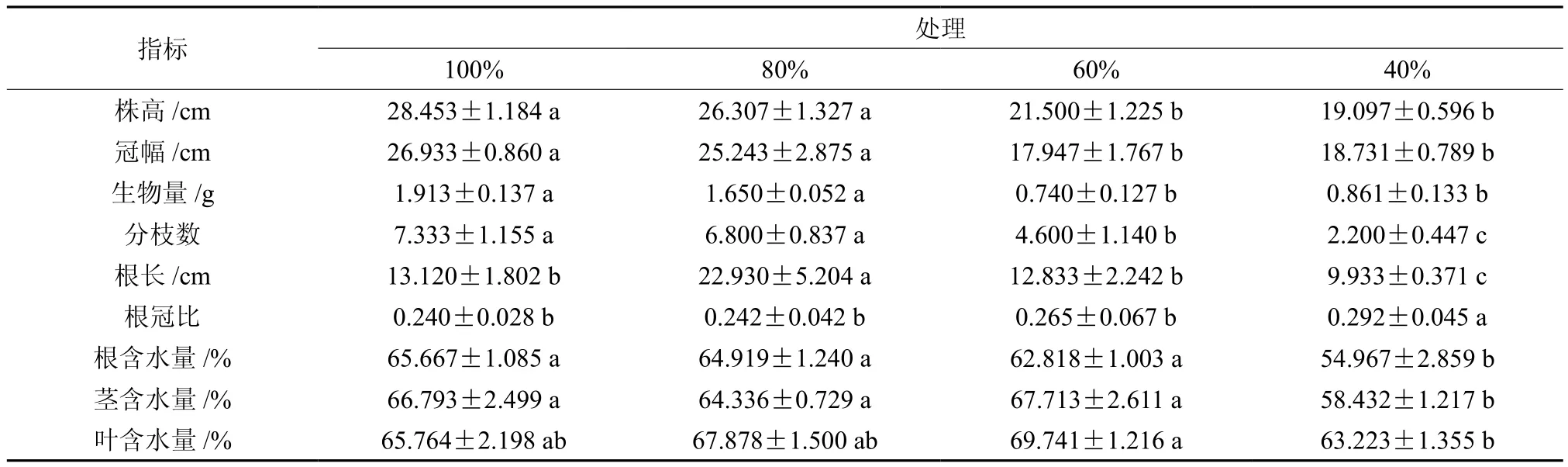
表4 不同土壤含水量下伯乐树幼苗形态学的影响(平均数±标准误差)Table 4 Effects of water gradients on characteristics of B. sinensis seedlings (mean ± SD)
3 讨论与结论
水作为光合作用的原料之一,当其供应不足时,直接导致光合速率的降低。因此,蒸腾速率作为一个重要的水分参数,反映了植物的耗水能力。气孔通过调节蒸腾,降低或抵抗水分胁迫对植物生理活动的影响[24]。植物通过气孔的关闭来控制水分的损失,但必然限制了碳的获取,因此,陆生植物必须取得一个在碳固定与水分消耗之间的折中点[25-26]。水分利用效率(WUE)则可以看作这一折中点的测度[27]。植物通过提高水分利用效率来减轻干旱对其的伤害[28]。40%相对土壤含水量下,伯乐树幼苗的水分利用效率最高(P<0.05),说明伯乐树对干旱环境具一定的适应能力。
Farquhar等[29]认为,引起光合速率降低的气孔和非气孔限制因素可以根据叶片胞间CO2浓度和气孔限制值的变化来判断。伯乐树幼苗在干旱胁迫下,气孔导度降低,导致Tr、Pn和Ci降低,Ls值增大,说明其光合速率的下降主要受气孔限制所致。在土壤含水量较低的情况下,伯乐树的根系吸水不能满足蒸腾作用的要求,叶片气孔部分关闭,气孔导度降低,以此减少叶片的蒸腾失水,从而减轻胁迫对光合器官的伤害。这也是伯乐树对干旱胁迫的一种适应性反应。
研究表明,初始量子效率值高说明其叶片光能转化效率高[30]。随着土壤含水量的降低,伯乐树叶片的初始量子效率整体呈下降趋势,说明较高的土壤含水量有利于伯乐树进行光合作用。光饱和点的高低反映了光合机构暗反应过程对同化力最大需求量的多少。暗反应能力越强所需要的同化力越多,光饱和点也相应越高[31]。在不同环境条件下,光补偿点和光饱和点将会发生变化[32]。随着土壤含水量的降低,伯乐树幼苗叶片的光饱和点以100%和80%含水量下较高(P<0.05)。然而,伯乐树幼苗叶片的光补偿点和饱和点均较低,推测这与幼苗培养的光照条件较低有关。
伯乐树幼苗叶片的最大羧化速率(Amax)和羧化效率(CU)随土壤含水量的下降而下降,从而导致其CO2补偿点(CCP)和CO2饱和点(CSP)相对较高(P<0.05),进而影响植物生长率及干物质量。在40%相对土壤含水量下,伯乐树的幼苗根冠比最大,但其处理下幼苗的株高、冠幅、生物量、根长、根和茎的含水量均较小(P<0.05),其分枝数也较少(P<0.05)。这也是植物在形态和生理方面应对抗旱的策略[33-34]。根据对湖北木林子国家级自然保护区、湖南壶瓶山国家级自然保护区、浙江九龙山国家级自然保护区、浙江乌岩岭国家级自然保护区以及浙江的江山、福建的蒲州等地进行野外调查发现,伯乐树主要分布在水沟两侧,在阴湿环境下伯乐树生长较好。张荣京[35]调查也表明,伯乐树在温暖潮湿的热带山地林中生长状况良好。由此,可看出水分是伯乐树分布的主要限制因子之一。
综合本实验研究表明,在土壤含水量相对较高的环境下(100%和80%),伯乐树幼苗叶片的表观光合速率、最大光合速率、最大羧化速率、初始量子效率和羧化效率等光合参数值均较高,从而使幼苗在株高、冠幅、分枝数、生物量等方面表现出良好的生长态势。建议在进行伯乐树幼苗繁育时,应适当增加土壤含水量。
[1] 于永福. 中国野生植物保护工作的里程碑——国家重点保护野生植物名录(第一批)出台[J]. 植物杂志, 1999, (5): 3-11.
[2] 卢清华, 欧 斌, 赖福胜, 等. 伯乐树播种育苗试验[J]. 林业科技开发, 2007, 21(2): 94-95.
[3] 伍铭凯, 杨汉远, 龙 舞, 等. 伯乐树种子育苗试验[J]. 贵州林业科技, 2006, 34(4): 39-42.
[4] 刘成运. 伯乐树科及其近缘科的花粉形态研究[J]. 云南植物研究, 1986, 8(4): 441-450.
[5] 曾懋修, 童宗伦. 伯乐树树干的解剖学研究[J]. 西南农业大学学报, 1984, (1): 42-46.
[6] 吕 静, 胡玉熹. 伯乐树茎次生木质部结构的研究[J]. 植物学报, 1994, 36(6): 459-65.
[7] 马忠武, 何关福. 中国特有植物钟萼木化学成分的研究[J].植物学报, 1992, 34(6): 483-484.
[8] 李铁华, 周佑勋, 段小平. 钟萼木种子生理休眠特性的初步研究[J]. 中南林学院学报, 1997, 17(2): 41-45.
[9] 康华靖, 陶月良, 陈子林, 等. 伯乐树种子不同条件贮藏下前后生理比较[J]. 中国野生植物资源, 2011, 30(1): 35-39.
[10] 胡尚力, 徐刚标, 梁 艳, 等. 伯乐树cpDNA-PCR反应体系的优化与引物筛选[J]. 中南林业科技大学学报, 2013, 33(7):67-71.
[11] 谢正成, 楼雄珍, 姚理武, 等. 伯乐树ISSR分子标记体系的建立[J]. 浙江林业科技, 2011, 31(1): 11-15.
[12] 李进军, 高承兵. 石羊河下游干旱荒漠区退化植被修复重建方式的研究[J]. 中南林业科技大学学报, 2012, 32(6): 8-12.
[13] 山 仑, 徐 萌. 节水农业及其生理生态基础[J]. 应用生态学报, 1991, 2(1): 70-76.
[14] 周广胜. 中国东北样带(NECT)与全球变化[M]. 北京: 气象出版社. 2002.
[15] 丁一汇. 中国西部未来环境保护[M]. 北京: 科学出版社. 2002.
[16] 姬兰柱, 肖冬梅, 王 淼. 模拟水分胁迫对水曲柳光合速率及水分利用效率的影响[J]. 应用生态学报,2005,26(3):408-412.
[17] 许振柱, 周广胜. 陆生植物对全球变化的适应性研究进展[J].自然科学进展, 2003, 13(2): 113-119.
[18] Berry J A, Downton W J S. Environmental regulation of photosynthesis. In: Govindjee ed. Photosynthesis[M]. New York:Academic Press. 1982.
[19] Nijs I, Ferris R, Blum H. Stomatal regulation in a changing climate: A field study using free air temperature increase(FATL) and free air CO2enrichment (FACE)[J]. Plant, Cell and Environment, 1997, 20: 1041-1050.
[20] 何维明, 马风云. 水分梯度对沙地柏幼苗荧光特征和气体交换的影响[J]. 植物生态学报, 2000, 24(5): 630-634.
[21] 叶子飘. 光响应模型在超级杂交稻组合-2Ⅱ优明86中的应用[J]. 生态学杂志, 2007, 26(8): 1323-1326.
[22] 董志新, 韩清芳, 贾志宽, 等. 不同苜蓿(Medicago sativaL)品种光合速率对光和CO2浓度的响应特征[J]. 生态学报,2007, 27(6): 2272-2278.
[23] Hodgson R A J, Raison J K. Inhibition of photosynthesis by chilling in moderate light: a comparison of plants sensitive and insensitive to chilling[J]. Planta, 1989, 178: 545-552.
[24] Monteith J L, Unsworth M H. Principles of Environmental Physics[M]. London: Edward Arnold. 1990.
[25] Dawson T E, Ehleringer J R. Gender-specif i c physiology, carbon isotope discrimination, and habitat distribution in boxelder,Acernegundo[J]. Ecololgy, 1993, 74: 798-815.
[26] Donovan L A, Ehleringer J R. Potential for selection on plants for water-use efficiency as estimated by carbon isotope discrimination[J]. American Journal of Botany, 1994,81:927-935.
[27] Zheng H L, Huang Z Z, Dong X J. Study on physioecological characteristics of Artemisia ordosica and C. komarovii al Iljinski in Maowusu land[J]. Plant Ecology and Geobotanic Sinica, 1992,16: 197-207.
[28] Chen X M, Begonia G B, Alm DM,et al.Responses of soybean leaf photosynthesis to CO2and drought[J]. Photosynthetica,1993, 29: 447-454.
[29] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1982, 33: 317-345.
[30] 蹇洪英, 邹寿青. 地毯草的光合特性研究[J]. 广西植物, 2003,23(2): 181-184.
[31] 杨兴洪, 邹 琦, 赵世杰. 遮荫和全光生长的棉花光合作用和叶绿素荧光特征[J]. 植物生态学报, 2005, 29(1): 8-15.
[32] 萧浪涛, 王三根. 植物生理学[M]. 北京: 中国农业出版社.2004.
[33] Liu F, Stützel H. Biomass partitioning, specific leaf area, and water use eff i ciency of vegetable amaranth (Amaranthus spp.) in response to drought stress[J]. Scientia Horticulturae, 2004, 102:15-27.
[34] 李树华, 许 兴, 米海莉, 等. 水分胁迫对牛心朴子植株生长及渗透调节物质积累的影响[J]. 西北植物学报, 2003, 23(4):592-596.
[35] 张荣京, 吴世捷, 邢福武. 海南一新记录科——伯乐树科[J].植物研究, 2007, 27(2): 133-134.
Response of photosynthetic physiology ofBretschneidera sinensisseedlings to different soil water contents
LIU Ju-lian1, XIA Li-zhi2, ZHENG Wei-cheng1, JI Guo-hua1, YE Fei-ying1, HU You-jin1, TAO Yue-liang3
(1. Administration Bureau of Jiulong Mountain Nature Reserve, Suichang 323300, Zhejiang, China; 2. Wenzhou Vocational College of Science and Technology, Wenzhou, 325006, Zhejiang, China; 3. College of Life and Environmental Sciences, Wenzhou University,Wenzhou 325035, Zhejiang, China)
In order to investigateBretschneidera sinensisseedlings’ response of photosynthetic physiology to different soil water contents, the morphological indicators and related photosynthetic parameters of the seedlings under conditions of different soil water contents were compared and studied. The results show that when the soil water relative content was greater than 40%, the transpiration rate(Tr) of the different treatments was no signif i cant difference (P>0.05); With soil water relative content 40%, the water use eff i ciency(RWUE) and stomatal limitation value (VLS) were higher(P<0.05); As the soil water contents decreasing, the maximum photosynthetic rate (Pmax), light compensation point (VLCP), light saturation point (VLSP), maximum carboxylation rate (Amax) and carboxylation rate(RCU) were all decreased on the whole, while the CO2compensation point (VCCP) and CO2saturation point (VCSP) increased with soil water decreasing; Compared the treatments with soil water relative content 100% and 40%, the differences of these photosynthetic parameters were all signif i cant (P<0.05) except the mitochondrial respiration (Rn) (P>0.05). The morphological indicators also indicate that the plant height, crown width, branch number and biomass maintained at the highest levels under relative high soil water contents (26.90%±1.41 and 21.52 %± 1.10), showing good growth momentum. The fi ndings reply that higher soil relative water content (> 60%) will be in favor of the growth ofB.sinensisseedlings.
Bretschneidera sinensis; young seedling; soil water content; morphology; photosynthetic physiology
S714.5;Q949.748.6
A
1673-923X(2015)06-0015-05
10.14067/j.cnki.1673-923x.2015.06.004
2014-03-14
浙江省教育厅项目(Y2013117);遂昌县科技重点项目“珍稀濒危植物——伯乐树资源保护技术及示范推广”资金资助
刘菊莲,硕士,工程师
刘菊莲,夏丽芝,郑伟成,等. 伯乐树幼苗对不同土壤含水量的生理生态响应[J].中南林业科技大学学报,2015,35(6):15-19.
[本文编校:吴 彬]
