体育运动中结缔组织生长因子对肌腱干细胞分化的影响
2015-12-18窦海波文秀丽
窦海波,文秀丽
体育运动中结缔组织生长因子对肌腱干细胞分化的影响
窦海波,文秀丽
肌腱是连接骨骼和肌肉的结缔组织,在神经的支配下可完成有效的动作。肌腱主要由成纤维细胞和胞外基质组成,本身为致密结缔组织,其胞外基质主要由I型和II型胶原组成,是致密而平行排列的胶原纤维束,纤维之间由少量的蛋白多糖与糖胺聚糖相连接。以往的研究认为肌腱是一种惰性组织,代谢并不活跃。然而,近来的多项研究表明,肌腱内同样存在着活跃的代谢过程,运动可对肌腱的组织形态、力学性能和代谢过程产生重要的影响[1]。其中,肌腱成纤维细胞起着重要作用,其可将肌腱组织所承受的力学负荷转化为电信号,并将力学刺激在细胞间传递,从而调控对肌腱的动态更新和平衡1。
随着干细胞研究的深入,肌腱干细胞可以从人、大鼠、小鼠等一系列哺乳动物的肌腱中分离获得。肌腱干细胞相比成纤维细胞体型较小,呈静电的鹅卵石状,表达包括OCT4、SSEA-4、CD29、CD44等多种干细胞表面标记物2。且有研究发现CD44是多种组织损伤后修复期的标志[2]。同时,肌腱干细胞通过不对称分裂,有效的补充肌腱内成纤维细胞,保持整个肌腱的动态活性平衡,因而对整个肌腱起着至关重要的作用。研究表明,肌腱干细胞具有多向分化潜能,可以向骨、软骨、脂肪和肌腱成纤维细胞分化3。对于调控肌腱干细胞定向分化的信号机制及诱导因素并不十分明确,但是细胞生长的微环境及各种外界刺激对干细胞的分化方向有重要的影响。目前有研究表明肌腱干细胞可以受力学刺激、生物活性因子等影响,从而进行分化、胞外基质分泌和促进肌腱组织形成[3]。
在体育运动中,急性和慢性的肌腱损伤比较常见,由于肌腱自身再生能力较差,肌腱损伤后恢复后比较缓慢,而传统治疗再生的肌腱主要是瘢痕组织构成,很难恢复结构的完整性及满足生理活动所需的强度2。因而寻求有效的治疗方法,促进肌腱干细胞向肌腱成纤维细胞分化是一种迫切的办法。因此,寻求有效的治疗方法尤为重要。促进肌腱干细胞向肌腱成纤维细胞分化是一种迫切的办法。结缔组织生长因子(Connective tissue growth factor,CTGF)是1991年首先在人脐静脉内皮细胞中发现的,由349个氨基酸组成。最初发现CTGF对成纤维细胞具有趋化及促进有丝分裂的作用,后来的研究发现,CTGF可对不同的细胞具有促进细胞增殖、迁移和分化等作用[4]。由于它们在创伤修复中的特殊意义,尤其是人CTGF可以启动一系列介导组织创伤修复和再生的生物学过程4,故具有潜在的应用前景5。近年来,也有研究者发现CTGF对骨髓间充质干细胞向成纤维细胞分化的作用,发现其有促进干细胞向成纤维细胞分化的作用[5]。因此将从大鼠肌腱中分离肌腱干细胞,并研究CTGF对其向肌腱成纤维细胞分化的影响。
1 研究对象与方法
1.1 研究对象
研究对象是结缔组织生长因子在体育运动中对肌腱干细胞分化的影响。
1.2 研究方法
1.2.1 实验法
1)实验材料。DMEM培养基和胎牛血清购自GIBCO公司;Trizol试剂盒以及所有的反转录试剂均购自北京Invitrogen生物技术服务有限公司;PCR引物由北京赛百盛生物有限公司合成;鼠抗人CD44、CD29抗体购自Bethyl Laboratories公司;兔抗人GAPDH和羊抗大鼠多克隆tenascin C抗体(1:100),小鼠抗大鼠多克隆Ⅰ型胶原抗体(1∶100)抗体、辣根过氧化物酶偶联的IgG抗体购自SantaCruz公司。
2)细胞分离及培养。实验取1只150g雄性大鼠,腹腔麻醉后,取大鼠双侧跟腱组织,提取周围结缔组织并将其剪碎至大小为1mm×1mm×1mm,然后将组织平铺至培养皿,加入含100u/mL青霉素、100U/mL链霉素的10%胎牛血清的DMEM培养基,在37℃、5%CO2的条件下培养。3天后,细胞从组织块周围迁移出来,继续培养5-7天,待细胞密度达80%时,胰酶消化、传代。取P2-P3代进行相关实验。
3)CD44、CD29细胞免疫荧光染色。取P2代细胞爬片,以2×104个/mL密度接种于24孔板,加300μL10%胎牛血清的DMEM培养基,37℃、5%CO2条件下培养,待细胞密度达60% -70%时,取两孔细胞,行免疫细胞化学检测细胞表型抗原标记CD44、CD29,方法如下:PBS洗3次,4%多聚甲醛固定30min,PBS洗3次,加入含0.5%Triton100和1%羊血清的PBS,冰上渗透10m in;再用含1%羊血清的PBS封闭,然后两孔分别加鼠抗人CD44、CD29,一抗4℃过夜。去除一抗,PBS冲洗,加FITC标记山羊抗小鼠二抗反应液,室温1 h,避光。去除二抗,PBS冲洗。甘油封片,荧光显微镜下观察细胞膜。
4)肌腱干细胞多向分化能力鉴定。取P3代细胞接种于6孔板,每孔分别加入2m l的成脂和成骨诱导培养液,分别培养至14天和21天,然后分别进行油红和茜素红染色,观察其成脂和成骨情况。同时收集一部分分离提取的肌腱干细胞,3 000rpm,离心10min,去上清,并用成软骨诱导培养液重悬,制成细胞团。诱导28天,进行阿利斯蓝染色观察软骨形成情况。备注:成骨诱导培养液含DMEM、10%FBS、1%PSN、0.1μmol/L地塞米松、0.2mmol/L维生素C及10mmol/Lβ甘油磷酸。成软骨分化:含无血清DMEM、0.1μmol/L地塞米松、0.2mmol/L维生素C、1mmol/L丙酮酸钠、1∶100胰岛素-铁传递蛋白-硒稀释液、10ng/mLTGF-β1。成脂分化:含DMEM、10%FBS、1%PSN、1×10-6 mol/L地塞米松、0.5mmol/L甲基异丁基黄嘌呤及50μmol/L吲哚美辛。
5)总RNA的提取。收集未处理的肌腱干细胞和分化后的肌腱细胞,用PBS洗1遍后吸去,加1mLTrizol后,用枪吹打后吸入EP管中。室温放置5min,使其充分裂解。按200μL氯仿/ mLTrizol加入氯仿,振荡混匀后室温放置15min。4℃12 000g离心15min。吸取上层水相至另一离心管中。按0.5mL异丙醇/ mLTrizol加入异丙醇混匀,室温放置5-10min。4℃12 000g离心10min,弃上清,RNA沉于管底。按1mL 75%乙醇/mLTrizol加入75%乙醇,温和振荡离心管,悬浮沉淀。4℃8 000g离心5min,尽量弃上清。室温晾干干燥5-10min。用50μLDEPC水溶解RNA样品,55-60℃,5-10min。测O.D值定量RNA浓度。
6)实时定量PCR。取500ngRNA根据First Strand cDNA kit的方法进行反转录,将获得的cDNA稀释10倍。然后,用qPCR试剂盒SYBR premix Ex Taq进行PCR扩增反应。βactin上游引物:5′-ATCGTGGGCCGCCCTAGGCA-3′;下游引物:5′-TGGCCTTAGGGTTCAGAGGGG-3′。
Tenascin C 上 游 引 物 :5′-CAGAAGCTGAACCGGAAGTTG-3′;下游引物:5′-GGCTGTTGTTGCTATGGCQCT-3′。Ⅰ型胶原 (Collagen type I)上游引物:5′-CTGGATCATATTGCACA-3';下游引物:5′-CATCGGTGGTACTAAC-3′。上述引物均由北京赛百盛基因技术有限公司合成。取之前合成的cDNA作为模板,上游引物下游引物各取0.4μl,SYBRμ-Green Master Mix 10.2μl。将上述样品加入到专用的PCR管中,PCR反应条件为:95℃15min,94℃15s,55℃30s,70℃30s,40 ycles。利用荧光实时定量PCR仪(CFX96,BiO Rad公司)进行反应,后对其熔解曲线进行分析,并计算出基因表达的相对量。
7)Western印迹。收集未处理的肌腱干细胞和分化后的肌腱细胞,加入SDS加样缓冲液,煮沸10m in,离心后取上清液进行SDS-PAGE,电转移至硝酸纤维素膜,用5%脱脂奶粉于4℃封闭1h,加入用5%脱脂奶粉1∶1 000稀释的I型胶原抗体和 1∶1 000稀释的 Tenascin-C抗体或 1∶10 000稀释的GAPDH抗体,室温轻摇1h,TBST洗膜3次,每次7min,加入用5%脱脂奶粉稀释的辣根过氧化物酶偶联的羊抗兔IgG,室温轻摇1h,TBST洗膜3次,每次7min,用化学发光法显色5min,压片显影。
1.2.2 数理统计法
采用SPSS统计软件包16.0进行统计学分析。所有实验数据均以平均值±标准差表示,两组之间比较采用t检验,以P<0.05认为有统计学意义。
2 结果与分析
2.1 肌腱干细胞的分离和鉴定
分离得到的组织细胞呈梭状,如图1A所示。同时免疫荧光染色检测显示,细胞表面抗原CD29和CD44呈阳性反应,如图1B所示。表明提取的组织细胞为肌腱干细胞。
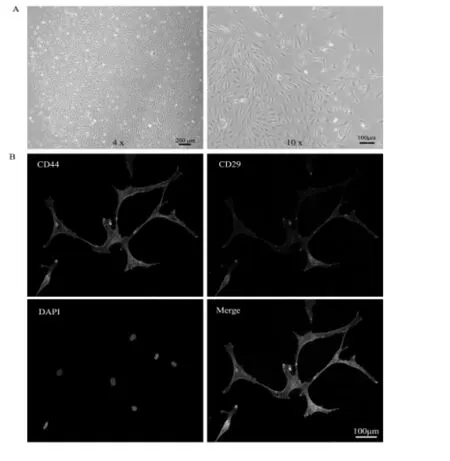
图1 分离出的肌腱干细胞图
2.2 肌腱干细胞可向脂肪细胞、骨细胞、软骨细胞分化
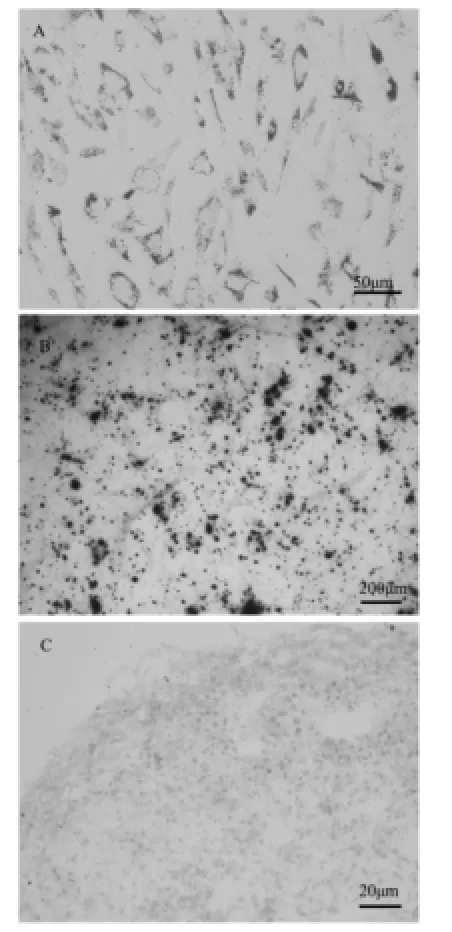
图2肌腱干细胞分化图
肌腱干细胞在分化14天后,大量的细胞开始分泌油滴,油红染色可见明显脂质空泡形成,如图2A所示,表明分离的肌腱干细胞具有向脂肪细胞分化的能力;同时肌腱干细胞在分化21天后,茜素红染色显示可见明显钙结节形成,如图2B所示,表明大量的细胞可以分化为成熟的成骨细胞;同时细胞球内的细胞开始分泌大量的软骨胞外基质,阿尔新蓝染色可见细胞外有明显的软骨样基质生成并呈蓝染,如图2C所示,表明大量的细胞可以分化为成熟的软骨细胞。
2.3 结缔组织生长因子可促进肌腱干细胞向成纤维细胞分化
I型胶原和Tenascin-C是成纤维细胞的蛋白标志物。我们将结缔组织生长因子刺激肌腱干细胞14天,用荧光定量PCR仪检测上述两种标志物的mRNA的含量。实验发现,与对照组相比,I型胶原的 mRNA水平含量升高了 5.3倍,Tenascin-C升高了2.1倍(P<0.01),如图3A;同时,用Western Blot检测,结果发现,与对照组相比,I型胶原的表达升高了3.3倍,Tenascin-C的表达升高了1.8倍(P<0.05),如图3。以上结果表明,结缔组织生长因子可以有效的促进肌腱干细胞向肌腱成纤维细胞分化。

图3 分化后的肌腱干细胞
3 讨论
随着越来越多的人参与到体育锻炼和竞技活动中,运动损伤也越来越多,其中韧带肌腱损伤占50%以上。虽然目前临床上有自体移植、同种异体移植和假体材料修复等技术,但这些手术仍存在着并发症、疾病传播、免疫排斥等缺陷。因此,采用人体自身干细胞进行修复无疑是更好的办法。目前多种细胞因子已被证明可用于肌腱修复,如TGF-b1,IGF等,被证明可以有效提高损伤肌腱的修复。在机体中,CTGF可以刺激结缔组织细胞,使其胞外基质的再生作用加强创伤处纤维填充、毛细血管生长加快等[6]。肌腱中分离出来的干细胞不仅能像骨髓间充质干细胞一样具有干细胞特性,并在特定诱导条件下分化为脂肪、骨、软骨、心肌等多种组织细胞。
本研究分离获取的肌腱干细胞镜下观察细胞形态呈梭状,经过成骨、成软骨及成脂诱导后可分化为成骨细胞、软骨细胞和脂肪细胞,且在结缔组织生长因子的刺激下可以向肌腱细胞分化。肌腱细胞分化的特异标记物为tenomodulin、scleraxis、tenascin C,而Ⅰ型胶原是肌腱组织的主要成分。本研究发现分化后的肌腱细胞中tenascin C和Ⅰ型胶原mRNA水平和蛋白表达水平是均有升高,且差异均有统计学意义,因此确定了提取的肌腱干细胞可以向肌腱细胞分化。
综上所述,本实验针对肌腱干细胞,成功证明了结缔组织生长因子对肌腱干细胞的刺激分化作用,此种生长因子可以直接应用之损伤局部,包括注射及局部包裹生长因子的封闭剂或指甲等从而可以为细胞因子疗法提供一个新的选择。然而,直接注射存在生长因子半衰期较短等缺陷,因而未来可以采用生物材料缓释载体来解决这一问题。同时还有研究表明,这种干细胞参与了多种肌腱修复的活动如血小板富集疗法。因此,针对肌腱干细胞进行修复疗法的研究将成为未来的一个方向。
[1]安小团.运动训练对肌腱细胞外间质及IGFIMRNA和蛋白表达的影响[D].苏州:苏州大学,2009.
[2]宋海新,陈 晓,李建华.激活肌腱干细胞:启动肌腱再生的条件[J].中国康复医学杂志,2012,27(5):485-488.
[3]Bi Y,Ehirchiou D,Kilts TM,et al.Identification of tendon stem/ progenitor cellsand the role of the extracellularmatrix in theirniche [J].NatMed,2007,13(10):1 219-1 227.
[4]Igarashi A,OkochiH,Bradham H,et al.Regulation of connective tissue growth factor gene expression in human skin fibroblasts and duringwound repair[J].Mol BiolCell,1993,4:637-645.
[5]李琦涵,赵红玲,王 炯.结缔组织生长因子的基因克隆[J].中国医学科学院学报,2000,22(1):48-51.
Effectsof Connective Tissue Growth Factor on Cells Differentiation of Tendon in Sports
DOU Haibo,WEN Xiuli
运用实验法和数理统计法探究体育运动中结缔组织生长因子对肌腱干细胞分化产生的影响。将周围结缔组织从活体中进行细胞分离及培养;取P2代细胞爬片进行免疫细胞化学检测细胞表型抗原标记CD44、CD29。取P3代细胞进行肌腱干细胞多向分化能力鉴定,收集未处理的肌腱干细胞和分化后的肌腱细胞,分别用实时荧光定量PCR和Western印迹检测I型胶原和Tenascin-CmRNA和蛋白水平的表达。实验结果表明:细胞免疫荧光染色CD44、CD29阳性,表明我们分离提取的组织细胞为肌腱干细胞;肌腱干细胞可以向脂肪细胞、骨细胞、软骨细胞分化;分化后的肌腱细胞,I型胶原的mRNA水平含量升高了5.3倍,Tenascin-C升高了2.1倍(P<0.01),I型胶原的蛋白表达升高了3.3倍,Tenascin-C的表达升高了1.8倍(P<0.05)。结论:结缔组织生长因子可以促进肌腱干细胞分化。
体育运动;肌腱;干细胞;分化;结缔组织;生长因子
To investigate the effect of Connective tissue growth factor(CTGF)on the differentiation of tendon stem/progenitor cells(TSPCs)in sports,this paper uses the experimentalmethod and mathematical statistics method.Cells were isolated from the surrounding connective tissue of the living;the protein expressions of CD44、CD29 were detected by immunocy to chemistry staining from the cells at passage 2.Cells at passage 3 were used to demonstrate themulti-differentiation potential of the TSPCs,themRNA expression of tenascin C and collagen type Iwere determined by real-time PCR,and the protein expressions of tenascin C and collagen type Iwere determined byWestern blot.Results indicates that immunocy to chemistry staining showed that the protein expressions of CD44、CD29 were detected in cells we isolated;chondrogenic,osteogenic,and adi pogenic differentiation assays were used to demonstrate themulti-differentiation potential of the TSPCs;the mRNA expressions of collagen type Iand Tenascin-Cwere 5.3 and 2.1 times higher than that in cellswith no differentiation(P<0.01),the protein expressions of tenascin C and collagen type Iwere 3.3 and 1.8 times higher than that in cellswith no differentiation(P<0.05).Conclusion:Connective tissue growth factor(CTGF)can be used to promote tenogenic differentiation of the TSPCs?in vitro.
sports;muscle tendon;stem cells;differentiation;connective tissue;growth factor
G804.5
A
1003-983X(2015)03-0217-04
2015-01-05
北京市青年英才计划(YETP0407);教育部中央高校基本科研业务费(FRFBR13038)
窦海波(1981-),男,河南邓州人,博士,讲师,研究方向:高校竞技体育.
北京科技大学体育部,北京100083 Physical Education Department,University of Science and Technology Beijing,Beijing,100083
