米糠多糖及硫酸酯化米糠多糖的体外免疫应答和抗肿瘤活性研究
2015-12-18朱丽丹徐逸木李亚男陈正行
朱丽丹 王 莉 徐逸木 王 韧 李亚男 陈正行
(江南大学粮食发酵工艺与技术国家工程实验室1,无锡 214122)(江南大学食品学院2,无锡 214122)
米糠多糖及硫酸酯化米糠多糖的体外免疫应答和抗肿瘤活性研究
朱丽丹1,2王 莉1,2徐逸木1,2王 韧1,2李亚男1陈正行1,2
(江南大学粮食发酵工艺与技术国家工程实验室1,无锡 214122)(江南大学食品学院2,无锡 214122)
以小鼠黑色素瘤细胞(B16)为抗肿瘤模型,通过MTT比色法评价米糠多糖及硫酸酯化米糠多糖对B16增殖抑制能力。以小鼠巨噬细胞Raw264.7细胞系为免疫模型,通过MTT比色法评价Raw264.7增殖能力,中性红吞噬试验评价巨噬细胞活性,Griess方法检测一氧化氮(NO)释放量,以及酶联免疫(ELISA)检测肿瘤坏死因子(TNF-α)分泌量,考察米糠多糖及硫酸酯化米糠多糖的免疫活性。研究发现:米糠粗多糖(RBP)和米糠多糖纯化组分(RBP2a)主要通过增强机体的免疫功能而间接抑制肿瘤细胞。质量浓度为250 μg/mL时,RBP和RBP2a样品组的NO释放量分别为对照组的4.67、6.36倍,TNF-α分泌量为对照组的441.1、465.5倍;RBP直接组和间接组的B16抑制率分别为8.16%、45.55%,间接组的B16抑制率比直接组增长458%。硫酸酯化米糠多糖(SRBP-B,SRBP-D,SRBP2a-B)一方面可以直接抑制B16增殖,质量浓度为1 000μg/mL时,对B16抑制率达73.65%、65.53%、78.43%,另一方面也可通过免疫途径提高NO和TNF-α等细胞因子释放,进一步提高抗肿瘤活性。但高浓度SRBP-B,SRBP-D,SRBP2a-B能抑制Raw264.7增殖,在500μg/mL时,Raw264.7存活率仅为83.26%、81.8%、79.78%。
米糠多糖 硫酸酯化米糠多糖 免疫调节 抗肿瘤活性
米糠是稻米加工的副产物,含有优质的蛋白质、多糖、脂肪、生育酚等生物活性物质[1]。研究表明,米糠中活性多糖具有提高免疫能力[1],抗肿瘤[2-5],降血脂[6]等功能。生物活性多糖的抗肿瘤途径主要有2种:一方面通过宿主介导提高抗肿瘤活性,即多糖作为生物免疫反应的调节剂,通过增强机体的免疫功能而间接抑制或杀死肿瘤细胞;另一方面多糖对细胞有毒性,直接抑制肿瘤细胞增殖[7]。目前米糠多糖的活性研究主要集中在对肿瘤的直接抑制作用或提高免疫活性等单一方面,将肿瘤直接抑制作用和免疫活性联系起来对米糠多糖抗肿瘤途径的研究很少。有研究表明[2]:对米糠多糖进行硫酸酯化修饰,可以提高多糖的抗肿瘤活性,对体外人肝癌细胞Hep G2和小鼠乳腺癌细胞EMT-6抑制能力有显著增强。但是米糠多糖经硫酸酯化后免疫活性是否有所变化,抗肿瘤途径是否有所转变,尚鲜见报道。鉴于此,本试验旨在研究米糠多糖及硫酸酯化米糠多糖对体外小鼠黑色素瘤细胞(B16)抑制能力及小鼠巨噬细胞(Raw264.7)免疫应答作用。
1 材料与方法
1.1 材料及试验细胞
脱脂米糠:万福生科(湖南)农业开发股份有限公司;小鼠黑色素瘤细胞(B16)、Raw264.7(小鼠单核巨噬细胞白血病细胞):中国科学院上海生命科学研究院细胞资源中心;胎牛血清:美国Gibico公司;RPMI1640培养基、青霉素/链霉素、胰蛋白酶:美国Cellgro公司;DMEM(HighGlucose):美国Thermo公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、脂多糖(LPS):美国Sigma公司;TNF-α检测试剂盒:美国eBoscience公司;Sepharose Big Beads、Sepharose CL-6B:美国通用电气(GE)公司;淀粉酶、糖化酶、中性蛋白酶:无锡杰能科生物工程有限公司;注射用香菇多糖:山西振东泰盛制药有限公司;注射用顺铂:齐鲁制药有限公司。
1.2 主要仪器
SH-1000酶标仪:日本Corona公司;TH-1000型梯度混合器、HL-2S型恒流、HD-5电脑紫外检测仪:上海青浦沪西分析仪器厂。
1.3 试验方法
1.3.1 米糠多糖的制备及分离纯化
米糠多糖的提取及分离纯化方法参考文献[1-2]。采用热水浸提,氢氧化钙、α-高温淀粉酶、糖化酶、中性蛋白酶除去植酸、淀粉、蛋白等杂质,工业酒精醇沉多糖(酒精体积浓度为70%)。将离心得到沉淀利用透析除去残留的盐,浓缩后冷冻干燥即为米糠粗多糖(RBP)。将RBP复溶液上样于Sepharose Big Beads离子交换柱,以含0、0.5 mol/L氯化钠的磷酸盐缓冲液(0.1 mol/L,pH=8.5)作为洗脱剂洗脱柱子,根据多糖含量绘制洗脱曲线,得到组分RBP1、RBP2、RBP3。根据抗肿瘤和免疫活性综合指标评价RBP1、RBP2、RBP3,选取RBP2作为进一步纯化组分。将RBP2复溶液上样于Sepharose CL-6B凝胶柱,以磷酸盐缓冲液(0.1 mol/L,pH=7.6)作为洗脱剂洗脱柱子,根据多糖含量绘制洗脱曲线,得到RBP2a、RBP2b。由于RBP2b组分含量少,故选取RBP2a作为纯化米糠多糖。
1.3.2 硫酸酯化米糠多糖的制备
以RPB为反应底物,1-丁基-3-甲基咪唑四氟硼酸盐([BMIM]BF4)或N,N-二甲基甲酰胺(DMF)为反应介质,根据吡啶-氯磺酸法制备得到硫酸酯化米糠多糖,分别命名为SRPB-B、SRPBD。以RPB2a为反应底物,[BMIM]BF4反应介质,根据吡啶-氯磺酸法制备得到硫酸酯化米糠多糖,命名为SRBP2a-B。
1.3.3 细胞培养
小鼠黑色素瘤细胞B16置于1640完全培养液(含10%胎牛血清、100 U/mL的青霉素和100 U/mL的链霉素),在37℃、5%CO2、饱和湿度条件下培养。
小鼠巨噬细胞Raw267.4置于高糖DMEM完全培养液(含10%胎牛血清、100 U/mL的青霉素和100 U/mL的链霉素),在37℃、5%CO2、饱和湿度条件下培养。
1.3.4 试验分组
取对数期的B16或Raw264.7经胰蛋白酶消化,调整细胞浓度,接种于96孔板中,每孔100μL,每组设置5个复孔,培养12 h,吸取上清液,加入不同溶液200μL。其中无细胞孔作为空白组,仅加完全培养液孔为对照组,含1μg/mL脂多糖(LPS)的完全培养液孔为LPS模型组,含50μg/mL香菇多糖的完全培养液孔为香菇多糖模型组,含5μg/mL顺铂的完全培养液孔为顺铂模型组(cisplatin),加不同浓度的米糠多糖(RBP、RBP2a)及硫酸酯化米糠多糖(SRBP-B、SRBP-D、SRBP2a-B)孔为样品组。
1.3.5 对B16增殖直接抑制的影响
调整B16细胞密度为5×104~10×104个/mL,按照1.3.3培养48 h,加入5mg/mL MTT 20μL,培养4 h,小心的吸出上清液,加入150μL二甲亚砜,在平板震荡仪上震荡10 min,在570 nm测定96孔板各孔的吸光值。

1.3.6 对Raw264.7增殖的影响
调整Raw264.7细胞密度为1×105个/mL,按照1.3.3培养24 h,加入5mg/mL MTT 20μL,培养4 h,小心的吸出上清液,加入150μL二甲亚砜,震荡10 min,在570 nm测定96孔板各孔的吸光值。

1.3.7 对Raw264.7吞噬能力的影响[8]
调整Raw264.7细胞密度为1×105个/mL,按照1.3.3培养24 h,弃培养基,PBS洗涤2次,然后每孔加入100μL 0.05%中性红溶液继续培养1 h。细胞用37℃温浴的PBS洗涤3次,以除去未被吞噬的中性红,最后每孔加入100μL细胞裂解液(50%乙酸和50%乙醇)裂解过夜,于550 nm波长条件下测定各孔中性红吸光度值。按下式计算Raw264.7吞噬指数和平均吞噬指数:

1.3.8 对Raw264.7 NO产生量的影响[9]
调整Raw264.7细胞密度为5×105个/mL,按照1.3.3培养48 h,取上清液50μL于新的96孔中,加入50μL Griess试剂,震荡10 min,在550 nm测定各孔的吸光值。根据NaNO2制得的标准曲线计算培养液中的NO生成量(μmol/L)。
NO标准曲线的制作:配置100μmol/L的NaNO2标准溶液,分别取0、10、20、30、40、50μL NaNO2标准溶液,超纯水补足至50μL,加入50μL Griess试剂,震荡10 min,在550 nm测定其吸光值。
1.3.9 对Raw 264.7TNF-α产生量的影响
调整Raw264.7细胞密度为5×105个/mL,按照1.3.3培养24 h。上清液的TNF-α含量按照eB-osience试剂盒说明书进行ELISA试验。
1.3.10 对B16增殖间接抑制能力的影响[10]
调整Raw264.7细胞密度为5×105个/mL,按照1.3.3培养24 h,收集200μL上清液于离心管中备用。按照1.3.5测定不同溶液处理Raw264.7上清液对B16细胞体外抑制率。
1.4 数据处理
采用SPSS18.0软件对数据进行ANOVE方差分析,并以检验比较组间差异性,显著性水平为P=0.05,极显著性水平为P=0.01。数据±SD表示。
2 结果与讨论
2.1 对B16直接增殖抑制能力的影响
采用MTT比色法测定细胞的活性,MTT能和活细胞线粒体脱氢酶生成蓝紫色的甲臜,甲臜在最大吸收波长550 nm的吸光值与活性细胞数成正比。从图1可以看出:和对照组相比,LPS模型组对B16抑制率较低,仅为3.66%;香菇多糖和顺铂模型组对B16有良好的体外抑制作用,抑制率分别为60.42%,73.12%。RBP、RBP2a、SRBP-B、SRBP-D、SRBP2a-B样品组对B16抑制率都随样品浓度的增加而增加,在质量浓度为1 000μg/mL,抑制率分别为15.32%、44.92%、73.65%、65.53%、78.43%。与RBP样品组相比,RBP2a样品组显著提高了对B16细胞体外抑制能力(P<0.05),说明利用离子交换层析和凝胶过滤层析可以有效富集抗肿瘤活性组分。SRBP-B、SRBP-D、SRBP2a-B对B16抑制作用优于RBP、RBP2a,这和文献报道的多糖经硫酸化修饰后能有效提高其抗肿瘤活性一致[9]。在不同添加浓度下,SRBP-B,SRBP-D样品组对B16抑制率有所差别,这可能是因为反应介质不同,影响了硫酸酯化米糠多糖的取代度、取代位置、空间结构,进而影响其对癌细胞的直接抑制能力。

图1 米糠多糖及硫酸酯化米糠多糖对B16直接抑制能力
2.2 对Raw264.7增殖的影响
从图2可看出:和对照组相比,LPS模型组和香菇多糖模型组显著增强了Raw264.7体外细胞增殖能力(P<0.05),增殖刺激指数分别为115.15%,105.87%;顺铂模型组严重抑制了Raw264.7体外生长,在质量浓度为5μg/mL,Raw264.7增殖刺激指数只有36.75%,说明顺铂对Raw264.7有较大毒性。

图2 米糠多糖及硫酸酯化米糠多糖对Raw264.7增殖能力的影响
在低质量浓度(31.75~125μg/mL),RBP、RBP2a对Raw264.7增殖无显著性影响(P>0.05);在高质量浓度(500μg/mL),RBP、RBP2a样品组的Raw264.7增殖刺激指数分别为91.47%、92.84%,说明高浓度的RBP、RBP2a对细胞有一定抑制作用。SRBP-B、SRBP-D、SRBP2a-B样品组,在高质量浓度(500μg/mL),对Raw264.7有较大抑制作用,Raw264.7增殖刺激指数分别为83.26%、81.8%、79.78%。这说明了多糖经硫酸酯化后对Raw264.7增殖抑制作用增强,可能是硫酸酯化修饰改变了多糖空间结构,影响多糖和巨噬细胞结合的靶点。
2.3 对Raw264.7吞噬能力的影响
正常生长的巨噬细胞具有吞噬中性红的功能,中性红可滞留在溶酶体内而不被洗涤液洗脱。正常情况下,巨噬细胞处于静息状态,受到药物刺激后,吞噬能力增强,吞噬能力可以衡量药物的免疫活性[11]。图3和图4可以看出:相比对照组,1)LPS模型组的吞噬指数有显著提高(P<0.05),为1.21,但平均吞噬指数则无显著性差异(P>0.05);2)香菇多糖模型组的吞噬指数和平均吞噬指数均无显著性差异(P>0.05);3)顺铂模型组的吞噬能力受到严重抑制(P<0.01)。这说明:LPS模型组主要通过促进Raw264.7细胞增殖从而增强其吞噬能力;香菇多糖对Raw264.7吞噬能力的影响不大;顺铂可能对Raw264.7产生了毒性,影响了细胞的活性,从而使Raw264.7吞噬能力显著下降。

图3 米糠多糖及硫酸酯化米糠多糖对Raw264.7吞噬能力的影响
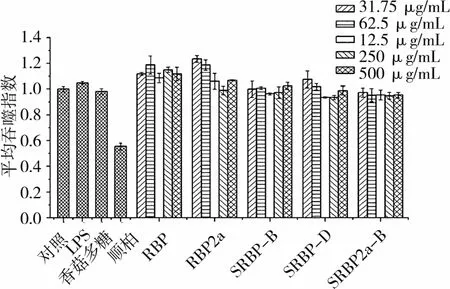
图4 米糠多糖及硫酸酯化米糠多糖对平均吞噬能力的影响
和对照组相比,RBP、RBP2a低质量浓度(31.75~62.5μg/mL)能提高Raw264.7吞噬指数(P<0.05),高质量浓度(125~500μg/mL)对Raw264.7吞噬指数影响不明显(P>0.05)。RBP增强Raw 264.7平均吞噬能力,且平均吞噬指数显著高于对照组和香菇多糖模型组(P<0.05)。通过观察细胞形态发现,RBP和RBP2a样品组的Raw264.7体积变大,伪足增加,可能是因为RBP和RBP2a通过激活静息状态的Raw264.7,增强Raw264.7平均吞噬指数。
米糠多糖的硫酸酯化修饰对提高Raw264.7吞噬能力基本没有作用,随着浓度的增加,Raw264.7的平均吞噬指数差异不显著,吞噬指数反而有下降的趋势,这可能和硫酸酯化米糠多糖样品组相对低的细胞增殖刺激指数有关。在不同添加浓度下,SRBP-B,SRBP-D样品组的Raw264.7的吞噬能力和平均吞噬能力均有差别,这可能是因为反应介质不同,影响了米糠多糖硫酸酯的取代度、取代位置、空间结构,从而影响免疫活性。
2.4 对Raw264.7 NO释放量的影响
NO是巨噬细胞分泌的一种信号分子,是激活静息的巨噬细胞,吞噬病原微生物的主要效应分子。从图5可以看出:和对照组相比,LPS和香菇多糖模型组显著提高了Raw264.7 NO释放量(P<0.01),且香菇多糖模型组NO释放量要明显高于LPS模型组;而顺铂模型组显著降低了Raw264.7 NO释放量(P<0.05),这可能是顺铂对Raw264.7细胞产生毒性,影响Raw264.7细胞活性。
RBP、RBP2a、SRBP-B、SRBP-D、SRBP2a-B样品组的NO释放量显著高于对照组,这可能是因为米糠多糖及硫酸酯化米糠多糖激活静息状态的Raw264.7,诱导iNOS表达。随着RBP添加浓度的增加,Raw264.7的NO释放量有所增加,当质量浓度达到125μg/mL,NO释放量达到最大,为15.15 μmol/L;当质量浓度超过125μg/m L,随着添加浓度的增加,NO释放量反而有所下降,可能与在高浓度下,Raw264.7相对低的增殖刺激指数有关。RBP2a样品组的NO释放量明显高于RBP样品组,且当RBP2a质量浓度在62.5~250μg/m L的浓度范围内,Raw264.7的NO释放量显著高于LPS模型组和香菇模型组(P<0.05)。与RBP、RBP2a样品组相比,SRBP-B,SRBP-D,SRBP2a-B样品组的NO释放量显著降低(P<0.05),但组间无显著差异(P>0.05)。这表明米糠多糖及硫酸酯化米糠多糖可以刺激Raw264.7 NO释放,而NO释放量可能和多糖的结构、氢键数量有关。

图5 米糠多糖及硫酸酯化米糠多糖对NO释放量的影响
2.5 对Raw264.7 TNF-α释放量的影响
TNF-α为巨噬细胞分泌主要细胞因子,是巨噬细胞发挥免疫功能的重要活性蛋白分子。TNF可以诱导IL-1及IL-6合成,调节免疫应答、抗感染、上调节组织修复、引起肿瘤细胞凋亡等[7]。从图6可以看出:与对照组相比,LPS和香菇多糖模型组可以显著提高Raw264.7 TNF-α释放量(P<0.01),且LPS模型组的TNF-α释放量明显高于香菇多糖模型组(P<0.05);而顺铂模型组TNF-α释放量有所增加,相比对照组无显著差异(P>0.05)。
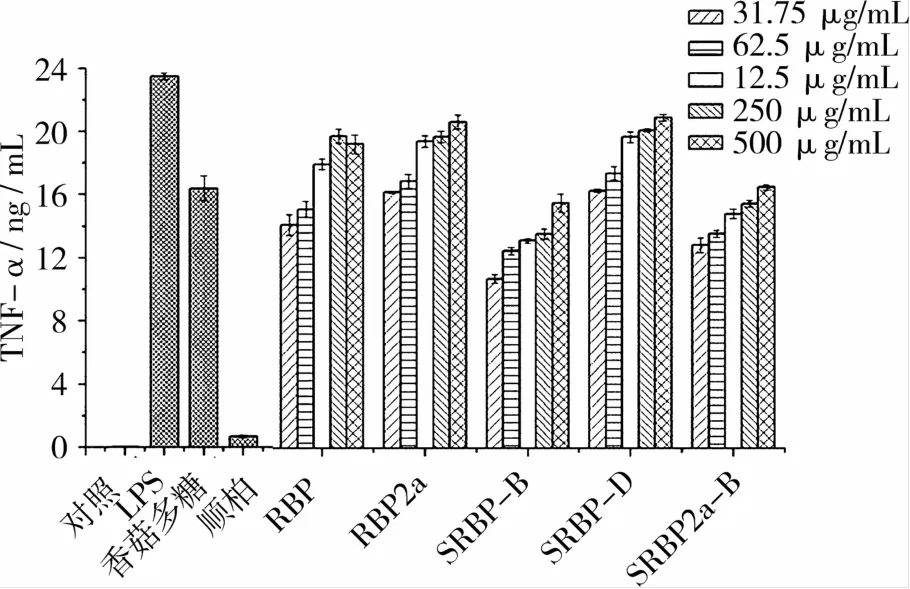
图6 米糠多糖及硫酸酯化米糠多糖对TNF-α释放量的影响
RBP、RBP2a、SRBP-B、SRBP-D、SRBP2a-B样品组TNF-α释放量明显高于对照组(P<0.01),且与添加浓度呈正相关,当质量浓度250μg/mL时,TNF-α释放量分别为19.85、24.52、15.03、13.75、14.58 ng/mL,是对照组的441.1、465.5、333、305.6、324倍。RBP2a和RBP样品组的TNF-α释放量,当质量浓度在31.75~125μg/mL范围内,组间差异显著(P<0.05),当质量浓度高于125μg/mL,组间无显著差异(P>0.05)。与RBP、RBP2a样品组相比,SRBP-B,SRBP-D,SRBP2a-B样品组的TNF-α释放量显著降低(P<0.05),但组间无显著差异(P>0.05)。这表明米糠多糖及硫酸酯化米糠多糖可以刺激Raw264.7分泌TNF-α,而TNF-α释放量可能和多糖的结构、氢键数量有关。
2.6 对B16增殖间接抑制能力的影响
从图7可以看出:随着浓度的增加,RBP直接组和间接组对B16增殖抑制作用也随之增强。与RBP直接组相比,RBP间接组的B16增殖受到明显抑制(P<0.01)。当质量浓度为250μg/mL,RBP直接组和间接组的B16抑制率分别为8.16%、45.55%,间接组对B16抑制能力是直接组的5.58倍。文献报道[3]米糠多糖可以抑制小鼠体内S-180肉瘤细胞的增殖,这可能主要通过增加机体的免疫调节活性,如激活巨噬细胞,促进巨噬细胞产生细胞因子,从而增加其抗肿瘤活性。

图7 RBP直接和间接处理对B16增殖的影响
从图8可以看出:随着浓度的增加,SRBP2a-B直接组和间接组对B16增殖抑制作用也随之增强,且间接组的B16抑制率显著高于直接组(P<0.05)。当质量浓度为31.75μg/mL,SRBP2a-B直接组和间接组的B16抑制率分别为9.90%、42.30%,这说明低浓度的硫酸酯化米糠多糖还是主要通过增强免疫调节从而提高抗肿瘤活性。当质量浓度为500μg/mL时,SRBP2a-B直接组和间接组的B16抑制率分别为69.29%、80.10%,这说明高浓度的硫酸酯化米糠多糖一方面可以直接抑制肿瘤细胞增殖,另一方面可以通过释放细胞因子和NO间接提高抗肿瘤活性。

图8 SRBP2a-B直接和间接处理对B16增殖的影响
3 结论
本试验以小鼠巨噬细胞Raw264.7和小鼠黑色瘤细胞B16为研究模型,发现米糠多糖和米糠多糖硫酸酯具有免疫调节和抗肿瘤活性。研究发现:米糠多糖主要通过宿主介导提高抗肿瘤活性,在多糖诱导下,Raw264.7由静息状态转变为激活状态,细胞吞噬能力、NO和TNF-α释放能力都有所提高,通过巨噬细胞发挥细胞毒性,对肿瘤细胞起到抑制作用;米糠多糖经过硫酸酯化后多糖对肿瘤细胞的毒性有所增加,可以在体外直接抑制肿瘤细胞的增殖,同时也可以刺激巨噬细胞NO和TNF-α释放间接提高其抗肿瘤活性,但是硫酸酯化多糖在高浓度可能会对巨噬细胞也产生一定毒性,抑制巨噬细胞的增殖。
[1]姜元荣.米糠免疫活性多糖的研究[D].无锡:江南大学,2004
[2]王莉.米糠多糖及其硫酸酯的结构、抗肿瘤活性的研究[D].无锡:江南大学,2009
[3]伊藤悦男,桑树荣.关于米糖中抗肿瘤多糖RBS的研究—制法、理化性质及生物活性[J].中医药信息,1986(3):39-41
[4]汪艳,吴曙光,徐伟,等.米糠多糖抗肿瘤作用及其作用的部分机制[J].中国药理学通报,1999(01):74-76
[5]王莉,朱丽丹,盛慧明,等.硫酸酯化米糠多糖结构分析及其抗肿瘤活性研究[J].食品与发酵工业,2011(3):18-22
[6]Kahlon T,Saunders R,Chow F,et al.Influence of rice bran,oat bran and wheat bran on cholesterol and triglycerides in hamsters[J].Cereal Chemistry,1990,67(5):439-443
[7]张晨晓.泥鳅多糖的免疫调节和抗肿瘤作用机理[D].武汉:华中科技大学,2005
[8]王晓京,丁桂凤,范少光.几种阿片肽及ACTH对小鼠腹腔巨噬细胞吞噬功能的作用 [J].中国免疫学杂志,1987(4):211-213
[9]Kim H S,Kim Y J,Lee H K,etal.Activation ofmacrophages by polysaccharide isolated from Paecilomyces cicadae through toll-like receptor 4[J].Food and Chemical Toxicology,2012,50(9):3190-3197
[10]Takede K,Tomimori K,Kimura R,et al.Anti-tumor activity of fucoidan ismediated by nitric oxide released from macrophages[J].International Journal of Oncology,2012,40(1):251-260
[11]马伟超.云芝菌丝体胞内外多糖提取物对Raw264.7细胞的双向免疫调节作用[D].上海:上海师范大学,2009.
Immunomodulatory and Anti-Tumor Activity of
Polysaccharides and Sulfated Polysaccharides from Rice Bran
Zhu Lidan1,2Wang Li1,2Xu Yimu1,2Wang Ren1,2Li Yanan1Chen Zhengxing1,2
(National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University1,Wuxi 214122)(School of Food Science and Technology,Jiangnan University2,Wuxi 214122)
Anti-tumor activity of rice bran polysaccharides(RBP and RBP2a)and sulfated polysaccharides(SRBP-B,SRBP-D and SRBP2a-B)on themousemelanoma cells(B16)has been evaluated by MTTmethod in the paper.In addition,the proliferation activity,stimulation activity on phagocytosis,NO and tumor necrosis factor-α(TNF-α)production of Raw264.7 cells have been also studied by MTT Method,Neutral Red Method,Griess Reaction and Enzyme-Linked Immunosorbent Method(ELISA).The results indicated that RBP and RBP2a could increase anti-tumor effect through the hostmediated pathway.Compared with the control group,RBP and RBP2a significantly enhanced the release of NO(4.67 times and 6.36 times)and TNF-α(441.1 times and 465.5 times)at 250μg/mL.Therefore,immune-mediated inhibition rate(45.55%)on B16 was 4.58 times higher than the direct inhibition rate(8.16%)at250μg/mL of RBP.Further,sulfated polysaccharide(SRBP-B,SRBP-D and SRBP2a-B)enhanced the anti-tumor activity by directly inhibiting B16.Sulfated polysaccharide(SRBP-B,SRBP-D and SRBP2a-B)could inhibit B16 proliferation while exhibit remarkably tumor-inhibitory rates(73.65%,65.53%and 82.43%)at1 000μg/mL.Meanwhile,SRBP-B,SRBP-D and SRBP2a-B significantly enhanced the release of NO and TNF-α.However,nonetheless,Raw 264.7 cellswere inhibited and revealed relatively lower survival rates(83.26%,81.80%and 79.78%)at500μg/mL.
rice bran polysaccharide,sulfated polysaccharide rice bran polysaccharide,immunomodulatory,anti-tumor activity
Q2
A
1003-0174(2015)03-0035-06
国家自然科学基金(31101383)
2013-11-20
朱丽丹,女,1988年出生,硕士,谷物活性物质
陈正行,男,1960年出生,教授,粮食精深加工
