高级别脑胶质瘤术后调强放疗联合替莫唑胺化疗31例效果观察
2015-12-17
高级别脑胶质瘤术后调强放疗联合替莫唑胺化疗31例效果观察
薛峰1,杨燕光2*
(1启东市第二人民医院内科,江苏226241;2南通市肿瘤医院放疗科)
[摘要]目的:探讨调强放射治疗(IMRT)联合替莫唑胺(TMZ)治疗高级别脑胶质瘤术后疗效和不良反应。方法:高级别脑胶质瘤术后59例,根据治疗方案不同分两组:A组31例(Ⅲ级18例,Ⅳ级13例),调强放疗联合替莫唑胺化疗;B组28例(Ⅲ级16例,Ⅳ级12例),单纯行调强放疗,分析比较两组的近期疗效、生存率和不良反应。结果:(1)A组PR8例,CR17例,有效率为80.6%。B组PR3例,CR10例,有效率为46.4%,两组比较差异有统计学意义(P<0.05)。(2)两组1、2、3年生存率比较:近期疗效同步放化疗组分别为71.0%、32.3%、16.1%,中位生存时间为18个月。单纯放疗组分别为46.4%、17.8%、7.1%,中位生存时间为11个月。(3)手术切除1、2、3年生存率比较:全切分别为76.0%、44.0%、20.0%,中位生存时间29个月。部分切除分别为47.1%、11.8%、5.9%,中位生存时间为11个月,两者比较差异有统计学意义(χ2=11.359,P=0.001)。(4)死亡原因:高级别脑胶质瘤59例中,死亡42例,其中38例(90.5%)死于肿瘤复发或未控,心、脑血管意外死亡2例(4.8%),多脏器功能衰竭1例(2.4%),肺部疾病1例(2.4%)。结论:高级别脑胶质瘤术后同步TMZ放化疗优于单纯放疗,可提高治疗的有效率和生存率,不良反应较轻。
[关键词]神经胶质瘤;调强放射治疗;替莫唑胺;化学疗法
* [通信作者]杨燕光,E-mail:yyg193@sina.com
脑胶质瘤是最常见的原发性颅内肿瘤,其中高级别脑胶质瘤(WHO分级Ⅲ~Ⅳ级)占35.3%~61.0%。手术切除肿瘤是首选治疗手段,但因肿瘤呈浸润性生长,手术难以完整切除。术后复发率高,预后差,其5年生存率不足5%[1],术后综合治疗对提高高级别脑胶质瘤生存时间尤为重要。本文选择两家医院2007年1月—2012年12月收治的高级别脑胶质瘤59例,其中南通肿瘤医院54例,启东第二人民医院5例,对调强放疗联合替莫唑胺化疗,治疗高级别脑胶质瘤的疗效和不良反应进行分析,现总结报告如下。
1 资料与方法
1.1一般资料高级别脑胶质瘤59例,其中男35例,女24例;年龄15~79岁,中位年龄50岁。术后病理确诊:Ⅲ级34例,Ⅳ级25例(WHOⅢ级:间变型星形细胞瘤,间变性少突胶质细胞瘤,间变性少突星形胶质细胞瘤,间变性室管膜瘤等;WHOⅣ级:胶质母细胞瘤[2])。所有患者Karnofsky评分≥70分,心、肺、肝、肾等重要脏器和血液学检测正常。两组患者一般资料比较差异无统计学意义(P>0.05),见表1。
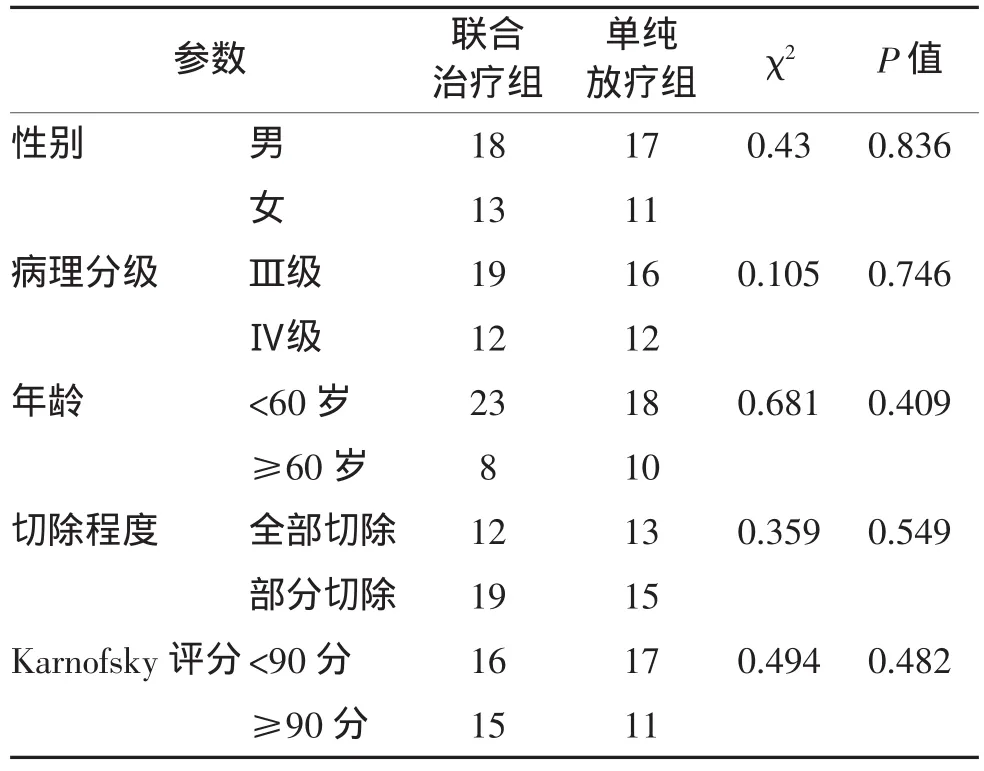
表1 两组高级别脑胶质瘤患者一般资料比较(例)
1.2方法(1)按治疗方式分:A组31例(Ⅲ级18例,Ⅳ级13例),调强放疗基础上联合使用替莫唑胺(江苏天士力帝益药业)化疗;B组28例(Ⅲ级16例,Ⅳ级12例),单纯行调强放疗。(2)放射治疗:手术全切25例,部分切除34例;手术后2~4周皮肤切口愈合后开始行放疗,使用头部热塑模进行固定,在CT模拟机下定位,扫描范围为头顶至下颌下缘,层距3.0mm,均行增强扫描,并结合术后MRI或行MRI图像融合确定靶区。靶区定义:大体肿瘤体积(gross tumor volume,GTV),为MRI T1增强图像显示的术后残留灶和(或)术腔,临床靶体积(clinical target volume,CTV),CTV1为GTV外放1.5~2.0cm,CTV2为GTV外放1.0cm,计划靶体积(planningtaget volume,PTV),PTV1、PTV2分别为CTV1、CTV2外放0.3cm。给予3~5个照射野(共面或非共面),95%等剂量线包括PTV,PTV1照射剂量46~50Gy后,追加照射PTV2剂量10~14Gy,2Gy/f,5f/W。本组患者采用调强放疗技术,放疗剂量56~64Gy,中位剂量60Gy。(3)同步化疗:A组在放疗期间同步口服TMZ胶囊75mg/m2每日1次,每周5次。直至放疗结束。休息4周后,继续化疗,口服TMZ150~200mg/m2,第1~5天,28天1周期,共3~6周期。(4)对症治疗:放疗期间患者有头痛、头晕、恶心等脑水肿症状,在放疗后给予20%甘露醇+地塞米松静脉快速滴注,根据患者症状程度,可以每日给药2~3次。如出现骨髓抑制及消化道症状可行对症治疗。(5)观察指标:近期疗效、生存率和不良反应。近期疗效,放疗结束后3个月行MRI检查,近期疗效参照RECIST标准进行评价[3],生存率观察两组1、2、3年生存率。不良反应,观察治疗期间的血液毒性、胃肠道反应,按RTOG分组标准分为Ⅰ~Ⅳ度。
1.3统计学处理采用SPSS19.0软件统计分析,近期有效率、不良反应的比较采用χ2检验,采用Kaplan-Meier计算法绘制生存曲线,Logrank检验比较生存率,P<0.05为差异有统计学意义。
2 结 果
2.1近期疗效比较A组PR8例,CR17例,有效率为80.6%。B组PR3例,CR10例,有效率为46.4%,近期疗效同步放化疗组高于单纯放疗组,差异有统计学意义(P<0.05),见表2。

表2 两组患者治疗近期疗效比较 例(%)
2.2生存率比较近期疗效同步放化疗组1、2、3年生存率分别为71.0%、32.3%、16.1%,中位生存时间为18个月。单纯放疗组1、2、3年生存率分别为46.4%、17.8%、7.1%,中位生存时间为11个月。生存曲线的Log-rank检验显示差异有统计学意义(χ2= 5.133,P=0.023),如图1。其中手术全部切除的1、2、3年生存率分别为76.0%、44.0%、20.0%,中位生存时间分别为29个月。部分切除亚组的1、2、3年生存率分别为47.1%、11.8%、5.9%,中位生存时间为11个月,两者比较差异有统计学意义(χ2=11.359,P= 0.001)。

图1 两组生存曲线
2.3不良反应两组在治疗期间出现不同程度的骨髓抑制、消化道反应和脑水肿表现,均未出现Ⅲ、Ⅳ级不良反应,两组的不良反应差异无统计学意义(P>0.05)。见表3。

表3 两组患者治疗后不良反应比较(例,%)
2.4死亡原因从手术结束起开始计算随访时间,随访至2013年6月30日,失访1例,随访率98.3%。高级别脑胶质瘤59例中,死亡42例,其中38例(90.5%)死于肿瘤复发或未控,心、脑血管意外死亡2例(4.8%),多脏器功能衰竭1例(2.4%),肺部疾病1例(2.4%)。
3 讨 论
脑胶质瘤是起源于神经胶质细胞,是最常见的中枢神经系统肿瘤。WHO分Ⅰ~Ⅳ级,其中Ⅲ、Ⅳ级为高级别脑胶质瘤。由于其生物学特性呈浸润性生长,且肿瘤倍增速度快[4],手术不易完全切除,术后复发率高。因此术后应尽早辅以放化疗[5],本组近全切除25例(42.4%)。放射治疗可消除术后残留肿瘤,减少和预防肿瘤复发,延长生存时间。但由于颅内正常脑组织和邻近的视神经、晶状体等重要器官的限制,常规放疗难以达到所需剂量。而研究表明放疗剂量与疗效密切相关,高剂量较常规剂量可使患者更多获益[6]。适形调强放疗可以提高靶区适形度,更好地保护正常组织同时提高肿瘤区域的照射剂量,改善肿瘤的治疗增益比。尤其当肿瘤不规则时,调强放疗的优势更为明显。本组患者采用调强放疗技术,高剂量区域的剂量分布与肿瘤区域适形度高,且剂量分布均匀,保护了周围正常脑组织和器官。
高级别脑胶质瘤术后单纯放疗效果并不理想,可能与胶质瘤干细胞(glioma stem cells,GCSs)具有多向分化、自我更新、放疗抗拒等有关。为提高疗效,临床上不断探索更有效的综合治疗方法,传统的化疗药物不良反应重,患者耐受性差,限制了临床应用。替莫唑胺是第二代烷化剂类药物,其分子量小,具有良好的亲脂性,容易通过血脑屏障,通过口服给药,吸收速度快。Stupp等[7]报道大型多中心随机对照研究首次证实了同步放疗联合TMZ可显著提高高级别脑胶质瘤的疗效,改善生存期。郑伟等[8]报道放疗联合TMZ较单纯放疗的有效率提高了近2.5倍,而不良反应轻。康勋等[9]报道也证实TMZ在脑胶质瘤的同步放化疗中的应用是安全的。2012年中国胶质瘤指南,强烈推荐TMZ作为高级别脑胶质瘤的术后同步放化疗的药物。本研究调强放疗联合TMZ组与单纯放疗组1、2、3年生存率和中位生存时间比较差异均有统计学意义,且TMZ联合放疗同步治疗是安全的。本研究中手术全切和部分切除两组的1、2、3年生存率比较差异有统计学意义,说明手术切除程度是影响预后的重要因素。
本研究显示,调强放疗联合替莫唑胺同步化疗近期疗效较好。但高级别脑胶质瘤的远期生存仍不理想,本组42例中38例(90.5%)死于肿瘤复发或未控,因此如何进一步提高生存率是今后研究的热点和难点。调强放疗技术使放疗同步加量(SIB-IMRT)成为可能[10],缩短疗程,改变时间剂量分割能否进一步提高生存获益,有待临床研究。
[参考文献]
[1]高翔.颅脑肿瘤治疗趋势[J].现代实用医学,2012,24 (10):1084-1087.
[2]中华医学会神经外科分会肿瘤专业组.中国中枢神经系统恶性胶质瘤诊断和治疗共识(简化版)[J].中华医学杂志,2009,89(43):3028-3030.
[3]程志祥,王科明.肿瘤疗效评价研究进展[J].中国肿瘤,2009,18(7):548-553.
[4] Asthagiri AR,Pouratian N,Sherman J,et al. Advances in brain tumor surgery[J]. Neurol Clin,2007,25(4):975-1003.
[5]汪洋,盛晓芳,高晶,等.高分级神经胶质瘤112例术后放、化疗疗效及其预后分析[J].肿瘤,2009,29(7):668-672.
[6] Pirtoli L,Rubino G,Marsili S,et al. Three-dimensional conformal radiotherapy,temozolomide chemotherapy,and high -dose fractionated stereotactic boost in a protocol-driven,postoperative treatment schedule for hign-grade gliomas[J]. Tumori,2009,95(3):329-337.
[7] Stupp R,Mason WP,Van Den Bent MJ,et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma [J]. N Engl J Med,2005,352(10):987-996.
[8]郑伟,聂青,康静波,等.高级别脑胶质瘤患者术后同步放化疗的临床疗效研究[J].中华神经医学杂志,2011,10 (9):900-904.
[9]康勋,李珊,谢铮铮,等.恶性脑胶质瘤同步放化疗中替莫唑胺化疗的不良反应及对策[J].首都医科大学学报,2012,33(5):589-593.
[10] Cho KH,Kim JY,Lee SH,et al. Simultaneous integrated boost intensity -modulated radiotherapy in patients with high-grade gliomas[J]. Int J Radiat Oncol Biol Phys,2010,78(2):390-397.
[收稿日期]2014-08-08
[文章编号]1006-2440(2015)01-0063-03
[文献标志码]B
[中图分类号]R730.264
