炎症与心房颤动相关性的研究进展
2015-12-17夏平综述杨浩审校
夏平 综述 杨浩 审校
(皖南医学院附属弋矶山医院心血管内科,安徽 芜湖241000)
炎症与心房颤动相关性的研究进展
夏平 综述 杨浩 审校
(皖南医学院附属弋矶山医院心血管内科,安徽 芜湖241000)
心房颤动(Af)是临床最常见的心律失常之一。目前对Af及其并发症(最重要是血栓形成)的有效治疗仍然是当前心律失常治疗中最薄弱的环节。Af的发病机制尚不完全明确。近年来大量临床和基础研究均提示炎症参与了Af的发生和发展。炎症与各种病理过程有关,如氧化应激、细胞凋亡、纤维化和促进Af基质形成。炎症还与内皮功能障碍、血小板活化、凝血酶联激活相关,这些均参与血栓形成过程。现对炎性介质及抗炎药物在Af中可能的作用机制及与Af的相关性综述如下。
心房颤动;炎症;炎性介质;抗炎药;血栓
心房颤动(Af)是临床最常见的心律失常之一,但因Af的发病机制多样化,尚未根本明确致病原因,故其治疗效果仍不理想。近来有大量研究表明,Af的发病率及预后与血清炎性介质密切相关,炎症参与了Af的各种病理过程,如氧化应激、纤维化及血栓形成等[1]。现就目前炎症及炎症介质与Af的相关性、抗炎可能治疗Af作概述。
1 炎症相关的心血管疾病与Af
1.1 炎症与心力衰竭
充血性心力衰竭、心肌病使Af的发病率增加4~6倍,炎症作为心血管疾病的危险因素之一,可引起心房扩大、心房肌细胞肥厚、心肌纤维化,从而心房出现结构重构[2]。Putko等[3]研究发现心力衰竭患者继发Af的同时,血清炎性介质肿瘤坏死因子(TNF)也升高,提示炎症可能参与Af的发生。
1.2 炎症与术后Af
Maesen等[4]研究发现心脏外科手术后出现心包炎,继发Af的同时血清炎症标志物也升高。心脏手术后16%~50%的患者出现Af[称为术后Af(POAF)],常发生于术后几天内,与血清炎症标志物[C反应蛋白(CRP)、白介素(IL)-6、IL-2]升高相平行。使用抗炎药物会减少POAF的发生率。行经皮冠状动脉介入术(PCI)和心脏外科手术等引起缺血-再灌注时,中性粒细胞被激活,释放TNF、IL-1及IL-6等炎性介质。
1.3 全身炎症性疾病与Af
Schiffrin[5]研究报道炎症通过免疫系统及炎症介质可导致血管重塑、动脉粥样硬化、高血压,进而增加Af发生的风险。丹麦国家中心最新一项全国性研究[6]发现,炎症性肠病(急性期)增加Af和脑卒中发生的风险,表明全身炎症性疾病与Af密切相关。
炎症会导致心血管疾病伴发Af,包括心力衰竭、冠心病及高血压等。炎症也涉及Af各种相关的病理过程,包括氧化应激、纤维化、血栓形成(见图1)。
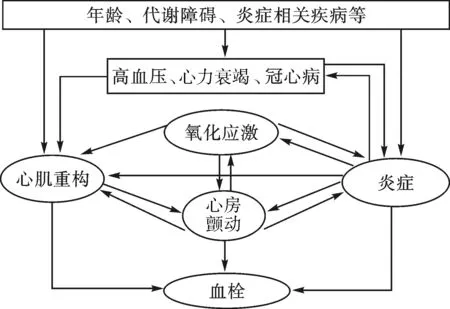
图1 Af、炎症、冠心病、心力衰竭及高血压等之间的联系
2 炎症与Af血栓形成
目前研究表明炎症反应不仅与Af的发生和维持有关,还与Af血栓形成紧密相关。比如Cianfrocca等[7]研究发现CRP水平升高与左心房血栓形成密切相关,可作为血栓形成的独立决定因素。血清CRP水平也是临床上脑卒中的危险因素。炎症相关的多重因素参与Af的血栓形成,主要从以下三个方面来阐述。
2.1 内皮细胞的损伤和功能障碍
心内膜完整和功能正常对于防止血栓形成有非常重要的作用。Af患者左房血流缓慢、瘀滞、形成涡流,可造成心房内膜受损,内皮细胞分泌炎症介质,如CRP、IL-6等,IL-6又可促进组织因子(TF)、纤维蛋白原、Ⅷ因子和血友病因子等炎症介质的释放[8]。血清中的大多数血友病因子大多数由内皮细胞分泌,是反映内皮细胞损伤和功能障碍的标志物,是目前公认的反映内皮损伤比较敏感和可靠的分子标志物。血管性血友病因子(vWF)黏附因子是内皮受损及功能障碍的指标。Wieberdink等[9]研究显示血浆vWF的水平与发生Af和脑卒中的风险密切相关,在老年人中更为明显。
2.2 血小板和内皮细胞的激活
内皮受损,血小板则与暴露的内皮下基质及血浆vWF黏附、聚集,并激活血小板。活化的血小板可释放趋化因子及炎症介质,参与炎症反应,促进白细胞聚集、浸润。白细胞表面的P选择素糖蛋白配基1(PSGL-1)表达在白细胞和淋巴细胞表面。血小板P选择素和PSGL-1结合,加速血小板和白细胞、内皮细胞间的黏附,促进血栓形成。Lim等[10]研究发现发生急性Af时,可导致左心房出现内皮细胞功能障碍、血小板激活和炎症介质的释放。Lim等[11]最新研究报道Af患者行射频消融术后并长期维持窦性心律,可减少血小板活化及减少炎症介质的水平,改善内皮细胞功能。
2.3 凝血酶激活
内皮受损能促进心内膜组织释放TF,暴露于血液中的TF启动外源性凝血途径。凝血酶将纤维蛋白原转变为纤维蛋白,将血小板紧紧地交织在一起。凝血酶是血栓形成的核心成分。所以临床上抗凝治疗比抗血小板更能预防Af的血栓形成。Neumann等[12]研究发现炎症反应能促进单核细胞分泌IL-6和CRP等炎症介质,这些炎症介质能促进TF的释放。Watson等[13]研究发现可溶性白细胞分化抗原40配体(sCD40L)是血小板活化的炎性标志物。sCD40L与位于淋巴细胞、血管内皮细胞上的CD40结合,导致一系列的炎症反应,也能刺激TF的释放,参与血栓形成。
3 与Af相关的炎性介质
3.1 CRP
血清CRP作为炎症的一个敏感性指标,主要由肝脏合成,参与全身的炎症反应。Chung等[14]研究发现,阵发性Af和持续性Af患者血清CRP浓度均高于正常对照者,而持续性Af相对于阵发性Af患者有着更高的CRP浓度。Aviles等[15]在大规模前瞻性研究中发现,CRP升高可作为预测Af发生的独立危险因子,其通过测量5 806例人群CRP基线水平,评估CRP与心血管疾病的关系,随访7.8年,发现CRP水平不仅和Af的发生有关,而且CRP水平越高,发生Af的风险越大。Psychari等[16]研究显示Af的发生与炎性因子及左心房内径有相关性,且Af患者CRP水平和左心房内径存在正相关。随着CRP的升高,炎性反应可能导致心肌细胞发生变性坏死,引起左房扩大、心肌纤维化,从而心房发生结构重构或电重构。Watanabe等[17]研究发现高水平CRP可作为电复律或射频消融术后发生Af的预测因子。
3.2 IL-6
血清IL-6是由激活的淋巴细胞和炎症细胞分泌的促炎性细胞因子。IL-6浓度升高可通过其在炎症反应瀑布上游的重要地位及激活交感神经系统的作用使Af更易发生。Wu等[18]研究发现非阵发性Af患者IL-6水平明显高于阵发性Af患者。Af行电复律或射频消融术后,高浓度的IL-6增加Af复发的风险。IL-6水平升高与Af发生及复发密切相关,可作为一种独立预测Af复发的炎症因子。Marcus等[19]研究发现患者在未发生Af之前IL-6和CRP的水平与对照组相比无明显差异,发生Af后患者IL-6水平明显高于对照组,Af可能导致急性炎症介质分泌,而不是炎症因子增加发生Af的风险。本研究还提示左心房的CRP水平高于冠状静脉窦等心脏其他部位,说明Af可能导致左心房肌细胞在局部分泌CRP。
3.3 TNF-α
TNF-α刺激和诱发急性免疫细胞反应,引起炎症反应。Wu等[18]研究说明了血清TNF-α水平的升高增加发生Af的风险。Pinto等[20]研究报告TNF-α水平升高,增加慢性Af患者的住院率,同时也增加脑卒中的风险。
3.4 IL-8
IL-8由巨噬细胞、单核细胞、内皮细胞等多种细胞分泌,促进白细胞迁移和诱发吞噬作用。还能增强内皮细胞、血小板激活及调节血栓形成。Liuba等[21]研究发现永久性Af组的血清IL-8浓度(在右心房和冠状窦,而不是肺静脉)高于阵发性Af组和对照组。
3.5 IL-10
IL-10抑制T细胞因子,增加B细胞生存、扩散和抗体生产。Li等[22]研究发现Af组血清IL-6、IL-8、IL-10、TNF-α、单核细胞趋化蛋白-1(MCP-1)、血管内皮生长因子水平明显高于对照组,相对于阵发性Af患者,持续性Af的IL-10、TNF-α水平明显升高。
4 抗炎药物干预Af
4.1 他汀类药物
他汀类药物能降血脂、改善内皮功能、稳定斑块、抗炎、抗氧化等。有研究显示他汀类药物对Af有预防作用,特别是减少Af复律后复发的作用。Armyda-3研究[23]显示与安慰剂组比较,阿托伐他汀组术后Af发生率明显下降(35% vs 57%,P=0.003),阿托伐他汀治疗使Af的风险降低61%(P=0.017)。Pena等[24]收集17 120例患者(CRP>2 mg/L),一组给予可定20 mg/d口服,与安慰剂组比较,可定组使发生Af的风险下降27%。Maesen等[4]研究表明在围手术期使用他汀类药物可降低血清炎性介质,减少心脏术后的缺血-再灌注心肌损伤,同时也可降低术后Af的发生率。在2010年欧洲新版指南中,他汀类药物已纳入Af的上游治疗的一级预防的Ⅱb类。
4.2 糖皮质激素
糖皮质激素可减少Af的复发,降低血清CRP浓度。Ho等[25]在病例对照研究中发现与安慰剂组比较,行心脏外科手术后服用糖皮质激素组可预防并降低Af的发生率(25.1% vs 35.1%,P<0.01),同时糖皮质激素组血清IL-6、CRP浓度在术后24 h内下降。但鉴于糖皮质激素不良反应多(如高血压、感染、消化道出血等),临床应用较少或者应用时间较短。
4.3 维生素
维生素C和维生素E是安全、廉价、容易接受的抗氧化剂。Harling等[26]随机对照研究发现预防性使用维生素C可减少POAF的发生率。Rodrigo等[27]研究显示维生素C、维生素E、鱼肝油联合使用也可减少POAF的发生率。
4.4 多不饱和脂肪酸
鱼油含有丰富的多不饱和脂肪酸,具有抗氧化、抗炎作用。Sakabe等[28]在犬(心房起搏导致电重构及心力衰竭所致结构重构)的两种模型上研究发现多不饱和脂肪酸能抑制心力衰竭的心房纤维重构和减少Af的持续发生时间。其有效性可能与抑制相关的蛋白激酶激活有关。
4.5 秋水仙碱
秋水仙碱抑制白细胞激活、内皮细胞黏附和迁移。Imazio等[27]在336例患者双盲随机试验中研究发现,与安慰剂组比较,术后使用秋水仙碱组可减少POAF的发生率(12%vs 22%,P=2.021,发生风险降低45%),并减少住院及康复时间。
5 结语
综上所述,炎症在Af的发生及发展中发挥重要作用,抗炎药物的治疗为Af的进一步治疗提供了新思路。但目前研究无法证实炎症是Af的始动因素还是持续因素,炎症和Af的作用机制还未完全研究清楚。虽很多炎症介质与发生Af的风险密切相关,但目前尚无充分理论依据用来指导Af的管理。我们需大规模的前瞻性研究证明炎症和Af的相关性,从Af的病理生理学机制上寻找更有效的治疗方法,从而使得Af治疗获得新的飞跃。
[1] Guo Y, Lip GY, Apostolakis S. Inflammation in atrial fibrillation[J]. J Am Coll Cardiol,2012,60(22): 2263-2270.
[2] Andrade J, Khairy P, Dobrev D,et al. The clinical profile and pathophysiology of atrial fibrillation: relationships among clinical features,epidemiology,and mechanisms[J]. Circ Res,2014,114(9): 1453-1468.
[3] Putko BN, Wang Z, Lo J, et al. Circulating levels of tumor necrosis factor-alpha receptor 2 are increased in heart failure with preserved ejection fraction relative to heart failure with reduced ejection fraction: evidence for a divergence in pathophysiology[J]. PLoS One,2014,9(6):e99495.
[4] Maesen B, Nijs J, Maessen J,et al. Post-operative atrial fibrillation:a maze of mechanisms[J]. Europace,2012,14(2):159-174.
[5] Schiffrin EL. The immune system: role in hypertension[J]. Can J Cardiol,2013,29(5):543-548.
[6] Kristensen SL, Lindhardsen J, Ahlehoff O, et al. Increased risk of atrial fibrillation and stroke during active stages of inflammatory bowel disease:a nationwide study[J]. Europace,2014,16(4):477-484.
[7] Cianfrocca C, Loricchio ML, Pelliccia F, et al. C-reactive protein and left atrial appendage velocity are independent determinants of the risk of thrombogenesis in patients with atrial fibrillation[J]. Int J Cardiol,2010,142(1):22-28.
[8] Raviele A, Ronco F. Endothelial dysfunction and atrial fibrillation:what is the relationship[J]. J Cardiovasc Electrophysiol,2011,22(4):383-384.
[9] Wieberdink RG, van Schie MC, Koudstaal PJ, et al. High von Willebrand factor levels increase the risk of stroke: the Rotterdam study[J]. Stroke,2010,41(10):2151-2156.
[10]Lim HS, Willoughby SR, Schultz C, et al. Effect of atrial fibrillation on atrial thrombogenesis in humans: impact of rate and rhythm[J]. J Am Coll Cardiol,2013,61(8):852-860.
[11]Lim HS, Willoughby SR, Schultz C, et al. Successful catheter ablation decreases platelet activation and improves endothelial function in patients with atrial fibrillation[J]. Heart Rhythm,2014,11(11):1912-1918.
[12]Neumann FJ,Ott I,Marx N,et al.Effect of human recombinant interleukin-6 and interleukin-8 on monocyte procoagulant activity[J]. Arterioscler Thromb Vasc Biol,1997,17(12):3399-3405.
[13]Watson T, Shantsila E, Lip GY. Mechanisms of thrombogenesis in atrial fibrillation: Virchow's triad revisited[J]. Lancet,2009,373(9658):155-166.
[14]Chung MK,Martin DO,Sprecher D, et al. C-reactive protein elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation[J]. Circulation,2001,104(24):2886-2891.
[15]Aviles RJ, Martin DO, Apperson-Hansen C, et al. Inflammation as a risk factor for atrial fibrillation[J]. Circulation,2003,108(24):3006-3010.
[16]Psychari SN, Apostolou TS, Sinos L,et al. Relation of elevated C-reactive protein and interleukin-6 levels to left atrial size and duration of episodes in patients with atrial fibrillation[J]. Am J Cardiol,2005,95(6):764-767.
[17]Watanabe E, Arakawa T, Uchiyama T,et al. High-sensitivity C-reactive protein is predictive of successful cardioversion for atrial fibrillation and maintenance of sinus rhythm after conversion[J]. Int J Cardiol,2006,108(3):346-353.
[18]Wu N, Xu B, Xiang Y, et al. Association of inflammatory factors with occurrence and recurrence of atrial fibrillation: a meta-analysis[J]. Int J Cardiol,2013,169(1):62-72.
[19]Marcus GM, Smith LM, Ordovas K, et al. Intracardiac and extracardiac markers of inflammation during atrial fibrillation[J]. Heart Rhythm,2010,7(2):149-154.
[20]Pinto A, Tuttolomondo A, Casuccio A, et al. Immuno-inflammatory predictors of stroke at follow-up in patients with chronic non-valvular atrial fibrillation (NVAF)[J].Clin Sci (Lond),2009,116(10):781-789.
[21]Liuba I,Ahlmroth H,Jonasson L,et al.Source of inflammatory markers in patients with atrial fibrillation[J]. Europace,2008,10(7):848-853.
[22]Li J, Solus J, Chen Q, et al. Role of inflammation and oxidative stress in atrial fibrillation[J]. Heart Rhythm,2010,7(4):438-444.
[23]Shroff GR, Orlandi QG. Letter by Shroff and Orlandi regarding article, “Randomized trial of atorvastatin for reduction of postoperative atrial fibrillation in patients undergoing cardiac surgery: results of the ARMYDA-3 (Atorvastatin for Reduction of Myocardial Dysrhythmia After Cardiac Surgery) study”[J]. Circulation,2007,115(15):e404;author reply e405.
[24]Pena JM, MacFadyen J, Glynn RJ, et al. High-sensitivity C-reactive protein, statin therapy, and risks of atrial fibrillation: an exploratory analysis of the JUPITER trial[J]. Eur Heart J,2012,33(4):531-537.
[25]Ho KM,Tan JA.Benefits and risks of corticosteroid prophylaxis in adult cardiac surgery:a dose-response meta-analysis[J]. Circulation,2009,119(14):1853-1866.
[26]Harling L, Rasoli S, Vecht JA,et al. Do antioxidant vitamins have an anti-arrhythmic effect following cardiac surgery? A meta-analysis of randomised controlled trials[J]. Heart,2011,97(20):1636-1642.
[27]Rodrigo R, Korantzopoulos P, Cereceda M, et al. A randomized controlled trial to prevent post-operative atrial fibrillation by antioxidant reinforcement[J]. J Am Coll Cardiol,2013,62(16):1457-1465.
[28]Sakabe M, Shiroshita-Takeshita A, Maguy A, et al. Omega-3 polyunsaturated fatty acids prevent atrial fibrillation associated with heart failure but not atrial tachycardia remodeling[J]. Circulation,2007,116(19):2101-2109.
[29]Imazio M, Brucato A, Ferrazzi P, et al. Colchicine reduces postoperative atrial fibrillation: results of the Colchicine for the Prevention of the Postpericardiotomy Syndrome(COPPS) atrial fibrillation substudy[J]. Circulation,2011,124(21):2290-2295.
Research Progress of Inflammation Associated with Atrial Fibrillation
XIA Ping,YANG Hao
(Cardiology Department,Yijishan Hospital Affiliated with Wannan Medical College,Wuhu 241000, Anhui, China)
Atrial fibrillation (Af) is the most common clinically relevant arrhythmia, however the methods available for treating Af and its complications (of which the most important is thrombogenesis), as well as for assessing Af risk and underlying pathophysiology, are largely limited. Emerging clinical and basic evidence suggests that inflammation may contribute to both the occurrence/maintenance of Af. Inflammation is suggested to be linked to various pathological processes that promote Af substrate formation such as oxidative stress, apoptosis and fibrosis. Inflammation has also been associated with endothelial dysfunction,platelet activation and coagulation cascade activation, leading to thrombogenesis. The role of inflammation and inflammatory biomarkers in the risk management and treatment of Af is reviewed in this article.
atrial fibrillation;inflammation;inflammatory markers;anti-inflammatory drugs;thrombogenesis
夏平(1988—),硕士研究生,主要从事心血管内科研究。Email:462700815@qq.com
杨浩(1966—),副教授,主任医师,主要从事电生理及射频消融研究。Email:yjsxnyh@sina.com
R
A
10.3969/j.issn.1004-3934.2015.05.030
2015-04-13
