接种丛枝菌根真菌对紫茎泽兰生长及氮磷营养的影响*
2015-12-16王鹏鹏,何跃军,吴长榜等
接种丛枝菌根真菌对紫茎泽兰生长及氮磷营养的影响*
王鹏鹏1,何跃军1,吴长榜1,2,蒋长洪1,吴春玉1,谢佩耘1
(1.贵州大学 林学院,贵州贵阳550025;2.贵州省林业调查规划院,贵州贵阳550003)
摘要:利用西南喀斯特地区常见入侵植物紫茎泽兰进行丛枝菌根真菌(AMF)接种与对照处理试验,研究接种AMF对其形态分化、生物量、光合生理及氮磷营养的影响。结果表明:接种AMF显著提高了紫茎泽兰光合生理,显著影响了紫茎泽兰形态分化(地径、苗高、总叶面积、分蘖数)及生物量;接种AMF显著降低了紫茎泽兰氮浓度,提高了紫茎泽兰磷浓度,氮和磷摄取量均有所提高,磷摄取量达到显著水平;对照条件下紫茎泽兰叶片氮磷比为14.01,接种AMF后降低为8.52,接种AMF使紫茎泽兰的生长更大程度上受氮素限制,而不再受氮素和磷素的共同限制。
关键词:丛枝菌根真菌;紫茎泽兰;生长;氮磷营养
紫茎泽兰(Eupatoriumadenophorum)是一种世界性入侵恶性杂草[1],原产于中美洲的墨西哥和哥斯达黎加一带,现已广泛分布于热带和亚热带30多个国家和地区[2],对入侵地生态环境造成极大的破坏。紫茎泽兰自20世纪40年代由缅甸传入中国云南省南部,目前已经在滇、黔、川、桂、藏等地广泛分布并不断向东、向北扩散蔓延,对生态环境平衡构成极大威胁[2~4]。丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是一类能与世界上80 %的维管束植物形成互利共生关系的微生物[5],AMF可以促进植物根系对营养物质的吸收[6~7],提高植物光合速率[8],增强植物抗性及耐性[9~11],影响外来植物入侵过程中植物群落演替进程[12]。
本研究通过比较分析接种AMF对入侵植物紫荆泽兰形态分化、生物量、光合生理及氮磷营养摄取的影响,研究丛枝菌根真菌在紫茎泽兰生长过程中起到的作用,从而为控制紫茎泽兰的入侵提供参考。
1材料与方法
1.1试验材料
供试植物紫茎泽兰种子采集于贵州省关岭布依族苗族自治县(东经105°35′10″~106°0′50″,北纬25°25′19″~26°10′32″)。挑选大小一致、颗粒饱满的种子,经10 %H2O2表面消毒10 min后去离子水反复冲洗干净,初温40℃水中浸泡24 h,置于25℃恒温培养箱中催芽,露白后播种,待幼苗出土10天后间苗,每一种植室保留2棵长势一致的幼苗。
供试土壤供试土壤为贵阳市花溪区贵州大学林学院苗圃喀斯特地段的碱性石灰土,与河沙按照3:1体积比混合均匀,0.14 Mpa湿热连续灭菌1 h。供试土壤理化性质如表1所示。

表1 供试土壤理化性质
供试菌种本研究采用幼套球囊霉(Glomusetunicatum)作为供试菌种,菌种购于北京农林科学院营养资源研究所,本研究所需接种剂为利用已灭菌的土壤种植白三叶草(Trifoliumrepens)扩繁3个月,接种剂含AMF孢子(孢子密度≥15个/g)、菌丝片段及侵染根段。
1.2研究方法
本试验分接种和对照两种处理:每一接种组中加入50 g菌剂,播种5粒种子,覆盖约1 cm厚的灭菌表土,浇足无菌水后将处理放置在试验大棚内培养,待幼苗出土后10天间苗,每一种植室内保留2株苗。对照组中加入50 g菌剂灭菌体(将接种菌剂0.14 Mpa、124~126℃湿热灭菌1 h),再加入10 mL菌剂过滤液(称取接种菌剂50 g,双层试纸过滤后的滤液)到菌剂灭菌体,保证目的菌种以外的其他微生物区系一致,其他处理和培养方法与接种处理一致。每1处理重复4次。
1.3测定方法
在植株生长约12周后收获,进行生长指标测定,收获植物和土壤材料进一步处理分析。
生物量测定收获植物材料后,105℃杀青,80℃烘干至恒重称量。
土壤氮磷测定土壤样品氮采用扩散法测定,磷采用钼锑抗比色法测定[13]。
植物氮磷测定植物样品氮采用扩散法测定,磷采用钼锑抗比色法测定[13]。
叶面积测定扫描仪扫描叶片,利用Photoshop软件对图片进行分析,计算叶面积大小。
1.4数据计算及分析
运用SPSS 19.0软件对试验数据进行统计分析,运用Excel 2007进行图表制作。
2结果与分析
2.1 接种AMF对紫茎泽兰形态分化及生物量的
影响
2.1.1接种AMF对紫茎泽兰形态分化的影响
与对照相比,接种处理紫茎泽兰生长12周后,其形态构件出现明显分化差异(表2)。其地径、苗高、总叶面积及分蘖数均出现显著差异。表明接种AMF能够引起紫茎泽兰形态构件上的分化,并显著地促进紫茎泽兰的生长。

表2 接种AMF对紫茎泽兰形态指标的影响
注:不同字母表示差异显著(P< 0.05),下同。
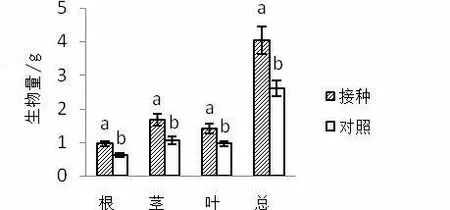
图1 接种AMF对紫茎泽兰生物量的影响
2.1.2接种AMF对紫茎泽兰生物量的影响
由图1可知,与对照相比,接种AMF显著提高了紫茎泽兰根生物量(P=0.002),增长了54.51 %;接种AMF显著提高了紫茎泽兰茎的生物量(P=0.005),增长了65.01 %;接种AMF显著提高了紫茎泽兰叶的生物量(P=0.009),增长了49.67 %;接种AMF提高了紫茎泽兰总生物量(P=0.004),增长了54.93 %。说明接种AMF促进了紫茎泽兰各部分生物量的积累。
2.2接种AMF对紫茎泽兰光合生理的影响
与对照相比,接种处理紫茎泽兰生长12周后,其净光合速率、蒸腾速率和气孔导度均有显著提高(表3),胞间CO2浓度和光合耗水率无显著性差异。说明接种AMF能提高紫茎泽兰光合速率,从而对紫茎泽兰生物量的积累产生影响,进一步影响紫茎泽兰的形态建成和生长发育。

表3 接种AMF对紫茎泽兰光合生理的影响
2.3接种AMF对紫茎泽兰氮和磷营养的影响
2.3.1接种AMF对紫茎泽兰氮和磷浓度的影响
与对照相比,接种AMF显著降低了紫茎泽兰植株根、茎和叶中氮浓度(P<0.05)(图2)。结果表明,接种AMF对紫茎泽兰各部分氮浓度有降低作用。
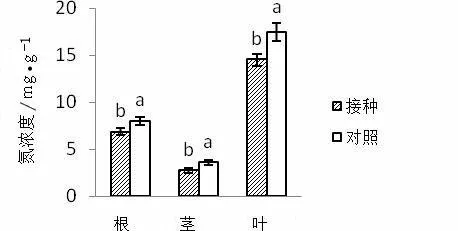
图2 接种AMF对紫茎泽兰氮浓度的影响
与对照相比,接种AMF显著提高了紫茎泽兰植株根、茎及叶中磷的浓度(图3)。说明接种AMF显著提高了紫茎泽兰根、茎、叶各部分的磷浓度,促进了紫茎泽兰对磷的吸收能力。
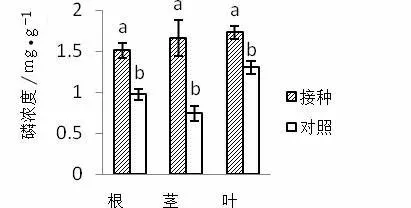
图3 接种AMF对紫茎泽兰磷浓度的影响
2.3.2接种AMF对紫茎泽兰氮和磷摄取量的影响
与对照相比,接种AMF提高了紫茎泽兰植株根、茎、叶和总氮摄取量,分别提高了36.02 %、36.41 %、23.36 %和27.59 %,但未达到显著水平(表4);与对照组相比,接种AMF显著提高了紫茎泽兰根、茎、叶和总磷摄取量,分别提高了134.08 %、200.00 %、92.82 %及126.08 %,差异达到极显著水平(P<0.01)。上述结果表明,接种AMF显著增加了紫茎泽兰各部位磷的摄取量,促进了紫茎泽兰对磷的吸收。

表4 接种AMF对紫茎泽兰氮和磷摄取量的影响
2.4接种AMF对紫茎泽兰氮磷比的影响
当植物叶片的氮磷比小于14时,则表明植物生长更大程度受到氮素的限制作用,而大于16时,则反映植被生产力受磷素的限制更为强烈,介于两者之间表明,受到氮素和磷素的共同限制作用[14~15]。对照处理条件下根、茎和叶氮磷比分别是8.62、5.44和14.01,接种AMF处理条件下紫茎泽兰植株根、茎和叶氮磷比分别是4.66、1.74和8.52,接种AMF对紫茎泽兰植株根、茎和叶氮磷比具有显著影响(图4)。对照组紫茎泽兰叶片氮磷比在14~16之间,说明紫茎泽兰的生长受到氮和磷的共同限制,接种AMF后远小于14,紫茎泽兰生长受磷素的限制作用削弱,更大程度上受到氮素的限制。
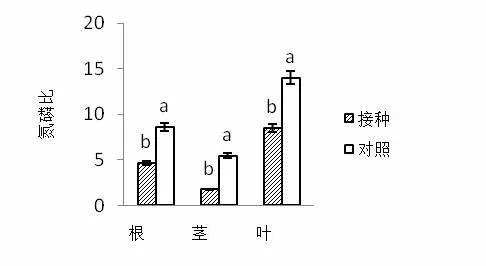
图4 接种AMF对紫茎泽兰氮磷比的影响
3结论与讨论
多数入侵植物都是菌根植物,植物入侵过程中能与新生境土壤中AMF建立良好的互利共生关系,丛枝菌根真菌可能在植物入侵与定殖过程中扮演非常重要的角色[16~18],研究AMF对恶性入侵植物紫茎泽兰生长与氮磷营养的影响,有助于探索AMF在紫茎泽兰入侵中发挥的作用。
何跃军等[8]研究发现接种AM真菌能显著提高构树叶片净光合速率,降低植株叶片对水分的消耗量,提高水分利用效率,提高蒸腾速率和气孔导度。本研究对AMF在紫茎泽兰光合生理中的作用得到同样的结论,接种AMF能提高紫茎泽兰光合速率,光合速率改变可能影响生物量的积累。本研究中发现接种AMF显著提高了紫茎泽兰的地径、苗高、总叶面积、分蘖数等形态分化及生物量,这可能是由于AMF改变了植物矿质元素吸收及光合作用,导致其在形态分化和生物量上发生改变。
植物体内的氮磷含量比率是对植物生长环境土壤氮磷养分可供给性的一种相对指示,同时也能表征植物对氮、磷养分的吸收状况,当氮、磷充足时,植物对氮素和磷素的吸收按生理及物质合成需要进行,而当某种元素处于稀缺状态,另一种元素相对丰富时,植物体内的氮磷比就会发生变化[14~15,19~21]。对紫茎泽兰各部分氮磷比研究发现,接种AMF对紫茎泽兰氮素和磷素的吸收具有不同的效率,未接种AMF条件下紫茎泽兰叶片氮磷比为14.01,接种AMF后紫茎泽兰的氮磷比为8.52,说明接种AMF前紫茎泽兰生长受到氮素和磷素共同限制,接种AMF后更大程度上受到氮素的影响,AMF降低了磷素对紫茎泽兰生长的限制作用,这可能与AMF更大程度上促进紫茎泽兰对磷的吸收有关,使磷素不再是紫茎泽兰生长的限制因子,这对低磷地区紫茎泽兰的生长具有重要意义。
接种AMF对紫茎泽兰生长与氮磷营养的摄取具有显著的促进作用,尤其是在低磷状况下,AMF可能在紫茎泽兰的入侵与定殖过程中发挥促进作用,本研究仅进行了室内接种试验,野外状态下的影响尚不清楚,有待进一步研究,这将有助于进一步说明AMF在植物入侵中的作用。
参考文献:
[1]于文清,刘万学,桂富荣,等.外来植物紫茎泽兰入侵对土壤理化性质及丛枝菌根真菌(AMF)群落的影响[J].生态学报,2012,32(22):7027-7035.
[2]强胜.世界性恶性杂草──紫茎泽兰研究的历史及现状[J].武汉植物学研究,1998,16(4):366-372.
[3]刘伦辉,谢寿昌,张建华,等.紫茎泽兰在我国的分布、危害与防除途径的探讨[J].生态学报,1985,5(1):2-6.
[4]向业勋.紫茎泽兰的分布、危害及防除意见[J].杂草科学,1991(4):10-11.
[5]van der Heijden M G A,Boller T,Wiemken A,etal.Different arbuscular mycorrhizal fungal species are potential determinants of plant community structure[J].Ecology,1998,79(6):2082-2091.
[6]邓胤,罗文倩,朱金山,等.不同氮磷水平条件下接种AMF对玉米生长的影响[J].中国农学通报,2008,24(12):301-303.
[7]何跃军,钟章成,刘济明,等.构树(Broussonetiapapyrifera)幼苗氮、磷吸收对接种AM真菌的响应[J].生态学报,2007,27(11):4840-4847.
[8]何跃军,钟章成,刘锦春,等.石灰岩土壤基质上构树幼苗接种丛枝菌根(AM)真菌的光合特征[J].植物研究,2008,28(4):452-457.
[9]祝英,熊俊兰,吕广超,等.丛枝菌根真菌与植物共生对植物水分关系的影响及机理[J].生态学报,2015,35(8):1-12.
[10]王小坤,赵洪海,李敏,等.丛枝菌根真菌与小麦孢囊线虫的相互作用[J].植物病理学报,2014,44(1):97-106.
[11]Aroca R,Ruiz-Lozano J M,ZamarreoM,etal.Arbuscular mycorrhizal symbiosis influences strigolactone production under salinity and alleviates salt stress in lettuce plants[J].Journal of Plant Physiology,2013,170(1):47-55.
[12]于文清,周文,万方浩,等.丛枝菌根真菌(AMF)对外来植物入侵反馈机制的研究进展[J].生物安全学报,2012,21(1):1-8.
[13]张韫.土壤·水·植物理化分析教程[M].北京: 中国林业出版社,2011.
[14]Verhoeven J T A,Koerselman W,Meuleman A F M.Nitrogen-or phosphorus-limited growth in herbaceous,wet vegetation: relations with atmospheric inputs and management regimes[J].Trends in Ecology & Evolution,1996,11(12):494-497.
[15]阎恩荣,王希华,周武.天童常绿阔叶林演替系列植物群落的N:P化学计量特征[J].植物生态学报,2008,32(1):13-22.
[16]Fumanal B,Plenchette C,Chauvel B,etal.Which role can arbuscular mycorrhizal fungi play in the facilitation of Ambrosia artemisiifolia L.invasion in France?[J].Mycorrhiza,2006,17(1):25-35.
[17]柏艳芳,郭绍霞,李敏,等.入侵植物与丛枝菌根真菌的相互作用[J].应用生态学报,2011,22(9):2457-2463.
[18]季彦华,刘万学,刘润进,等.丛枝菌根真菌在外来植物入侵演替中的作用与机制[J].植物生理学报,2013,49(10):973-980.
[19]Güsewell S.N:P ratios in terrestrial plants: variation and functional significance[J].New Phytologist,2004,164(2):243-266.
[20]Güsewell S.High nitrogen:phosphorus ratios reduce nutrient retention and second-year growth of wetland sedges[J].New Phytologist,2005,166(2):537-550.
[21]Koerselman W,Meuleman A.The vegetation N:P ratios: a new tool to detect the nature of nutrient limitation[J].Journal of Applied Ecology,1996,33:1441-1450.
Effects of Arbuscular Mycorrhizal Fungal Inoculation on Growth and
Nitrogen Phosphorus Nutrition of Eupatorium adenophorum
WANG Peng-peng1,HE Yue-jun1,WU Chang-bang1,2,JIANG Chang-hong1,WU Chun-yu1,XIE Pei-yun1
(1.College of Forestry,Guizhou University,Guiyang Guizhou 550025,P.R.China;
2.Guizhou Forest Inventory and Planning Institute,Guiyang Guizhou 550003,P.R.China)
Abstract:In order to study the effects of morphological differentiation,biomass,photosynthetic physiology and nitrogen phosphorus nutrition of invasive plant Eupatorium adenophorum inoculated with arbuscular mycorrhizal,E.adenophorum was inoculated and noinoculated with arbuscular mycorrhizal fungi in karst limestone soil.The results showed that the morphological differentiation (diameter,height,total leaf areas and tiller number)and biomass were increased significantly with inoculated; Photosynthetic physiology were increased significantly with inoculated; The phosphorus concentration was increased significantly while the nitrogen concentration was decreased significantly,the phosphorus acquisition was increased significantly while the nitrogen acquisition was increased; The ratio N/P of E.adenophorum leaf was 8.52 inoculated with AMF while the rate was 14.01 without AMF inoculation,the growth E.adenophorum of was greatly limited by nitrogen with inoculated AMF,and not jointly limited by nitrogen and phosphorus.
Key words:arbuscular mycorrhizal fungi;Eupatorium adenophorum; growth; nitrogen phosphorus nutrition
中图分类号:Q 948.12+2.3;S 451
文献标识码:A
文章编号:1672-8246(2015)05-0085-05
通讯作者简介:何跃军(1977-),男,教授,博士,主要从事生态恢复和菌根生态研究。E-mail:hyj1358@163.com
作者简介:第一王鹏鹏(1987-),男,硕士生,主要从事菌根生态学研究。E-mail:tsingpow@163.com
基金项目:国家自然基金(31000204;31360106),贵州省优秀青年科技人才专项基金(2013-10),贵州大学引进人才项目 (2012-005),贵州省农业攻关项目(NY2014-3029)。
收稿日期:*2015-04-14
doi10.16473/j.cnki.xblykx1972.2015.05.017
