腔内修复治疗36例复杂性急性Stanford B型主动脉夹层的短期临床疗效分析
2015-12-16郑江华陈开朱彦斌汪海飞陈志龙雍熙
郑江华,陈开,朱彦斌,汪海飞,陈志龙, 雍熙
腔内修复治疗36例复杂性急性Stanford B型主动脉夹层的短期临床疗效分析
郑江华,陈开,朱彦斌,汪海飞,陈志龙, 雍熙
目的:探讨腔内修复治疗复杂性急性Stanford B型主动脉夹层的短期临床疗效。
方法:回顾性分析我院2010-01至2014-06期间行腔内修复治疗的36例复杂性急性Stanford B型主动脉夹层患者的临床资料(包括手术情况及术后计算机断层摄影术血管造影随访情况),其中男性27 例,女性9例;年龄41~62 (平均43.7) 岁。
结果:36 例患者的腔内修复均获成功。22 例行主动脉腔内修复并覆盖左锁骨下动脉开口,10例结合左锁骨下动脉“烟囱”技术行主动脉腔内修复,2例先实施左颈总动脉—左锁骨下动脉人工血管转流后再行腔内修复,2例先实施右颈总动脉—左颈总动脉人工血管转流(左颈总动脉近心端结扎)后再行主动脉腔内修复。内脏动脉及下肢动脉缺血逐渐恢复,无内漏等并发症发生。36例患者中30例患者获得随访,随访率83.33%,随访时间1年。术后1年主动脉夹层全部假腔内血栓形成者10例,部分假腔内血栓形成者20例。与术前比较,术后1年无论是全部假腔内血栓形成者,还是部分假腔内血栓形成者,胸主动脉真腔体积均显著增大[(190.0±68.7)ml vs(125.3±63.4)ml和 (166.2±71.8) ml vs(110.1±62.7)ml], 差异均有统计学意义(P<0.001);而胸主动脉假腔体积均显著缩小[(65.0±67.4)ml vs(185.3±66.6)ml和 (132.3±62.6) ml vs(224.5±72.3)ml], 差异均有统计学意义(P<0.001)。对于全部假腔内血栓形成者,与术前比较,术后1年腹主动脉真腔体积显著增大[(55.5±12.4)ml vs(48.6±12.2)ml,P<0.01];部分假腔内血栓形成者,术后1年腹主动脉假腔体积也显著增大[(58.2±21.5)ml vs(42.5±18.5)ml,P均<0.01], 差异均有统计学意义。
结论:对于复杂的主动脉夹层患者行腔内修复,术中结合覆盖左锁骨下动脉、烟囱技术以及小切口的杂交技术等方法可延长锚定区,拓展主动脉夹层的腔内治疗范围,提高腔内修复的疗效,降低并发症的发生,短期疗效良好。
复杂性主动脉夹层;腔内治疗
(Chinese Circulation Journal, 2015,30:785.)
主动脉夹层是血管外科常见、危险的急重症,它是由各种原因引起的主动脉壁分离。Stanford B型夹层是指夹层限于降主动脉和(或)腹主动脉,没有逆行撕裂至升主动脉[1]。急性Stanford B型夹层分为简单性和复杂性,复杂性约占25%,复杂性Stanford B型夹层是指合并灌注不良综合征(包括内脏、肾以及下肢缺血)、血管破裂或即将破裂、无法控制的高血压、持续的腹痛或胸痛以及计算机断层摄影术(CT)发现有主动脉快速扩张的证据[1-3]。主动脉夹层的凶险程度远远高于脑梗塞、心肌梗死和恶性肿瘤[4],因此需要以外科手术为主紧急治疗。以往的胸主动脉置换、破膜开窗以及血管旁路等外科治疗皆因围手术期死亡率高而被逐渐淘汰。近20年,血管腔内技术发展迅速,由于其创伤小、并发症少、死亡率低等优点,腔内修复业已成为Stanford B型夹层治疗的主流方法[5],其中对于简单病例的治疗,技术上已日趋成熟,理念上也已逐步达成了共识,但对于复杂性急性Stanford B型夹层和复杂解剖条件的急性Stanford B型夹层的治疗,仍需进一步探讨,以寻找优化的腔内治疗方案[6]。
1 资料与方法
一般资料:回顾分析2010-01至2014-06我院36 例复杂性和复杂解剖条件的急性Stanford B型夹层患者,接受血管腔内修复术的临床资料。36例患者中男性27 例,女性9例;年龄41~62(平均43.7)岁。既往病史和现病史:36例患者均合并高血压,其中难以控制的高血压8例;合并糖尿病12例;合并冠心病15例;合并肾功能不全或衰竭的4例;合并单侧肾脏缺血18例;合并双侧肾脏缺血2例;合并肠管缺血5例;合并单侧下肢缺血伴重度间歇性跛行7例;合并腹主动脉真腔被压迫至重度狭窄或完全闭塞4例。持续性胸痛5例,持续性胸腹痛20例。36例患者均结合病史和计算机断层摄影术血管造影(CTA)确诊,其中28例弓降部裂口距左锁骨下动脉开口距离小于2 cm,6例裂口位于左颈总动脉与左锁骨下动脉之间,2 例裂口位于无名动脉与左颈总动脉之间。
手术方法:主动脉夹层的腔内修复:全麻后,左肱动脉穿刺,在导丝引导下将黄金标记导管经左锁骨下动脉置于升主动脉,根据病变形态选择X线投照角度(通常正位和左前斜45°),造影检查第一裂口的位置:(1)评估病变血管及主动脉分支血管状况,确定优势椎动脉;(2)评估腹腔干、肠系膜上动脉以及肾动脉等内脏动脉的真假腔供血情况,确定主动脉夹层向下的范围;(3)测定近端锚定区大小及直径;(4)如果近端锚定区不够,评估是否能覆盖左锁骨下动脉,或是通过“烟囱”技术或小切口“杂交”手术延长近端锚定区,最后决定能否行主动脉腔内修复;(5)如决定行主动脉腔内修复,则于一侧腹股沟区作斜切口(通常选择股总动脉未被累积的一侧),显露股总动脉并预备阻断。手术过程:全身肝素化(5 mg/kg)后,直视下穿刺股总动脉,置入6F鞘,导丝引导下置入黄金标记导管于升主动脉,再次造影,测定覆膜支架覆盖的长度,交换超强导丝,导入合适直径和长度的覆膜支架释放系统,控制性降压后,释放覆膜支架。再次造影,了解覆膜支架封堵裂口的情况,是否有内漏,必要时球囊扩张或增加覆膜支架的延长段(Cuff)。最后缝合股动脉切口及腹股沟斜切口。36例患者中有32例使用美国Cook公司的ZenithTX2 支架,4例使用上海微创公司的Hercules-T 支架。
随访:所有患者于术后第12个月复查CTA。
统计学方法:采用 SPSS11.5进行统计学分析。计量资料以均数±标准差表示,手术前后比较采用t检验,P<0.05为差异有统计学意义。
2 结果
36 例患者的腔内治疗均获成功,成功率100%。其中22例行主动脉腔内修复并覆盖左锁骨下动脉开口,10例结合左锁骨下动脉“烟囱”技术行主动脉腔内修复,2例先实施左颈总动脉—左锁骨下动脉人工血管转流后再行腔内修复,2例先实施右颈总动脉—左颈总动脉人工血管转流(左颈总动脉近心端结扎)后再行主动脉腔内修复(图1)。内脏动脉及下肢动脉恢复真腔供血,其中5例合并肠管缺血术后逐渐改善,20例合并单侧肾脏缺血逐渐好转,7例合并单侧下肢缺血伴重度间歇性跛行逐渐恢复,4例合并腹部动脉真腔被压迫至重度狭窄或完全闭塞段逐渐恢复。无内漏等并发症发生,所有患者均痊愈出院。
随访结果:36例患者中30例患者获得随访,随访率83.33%,随访时间1年。所有支架形态良好,无移位,第一裂口封堵良好,无新的裂口出现,假腔血栓逐渐形成,其中10例(33.33%)全部假腔形成血栓,远端破口封闭,远端内膜完整,假腔体积减少,真腔体积增大。20例假腔内部分血栓形成,主要以假腔近端为主,远端假腔仍在,远端破口存在,即内膜仍不完整,但远端直径无明显变化。
30例患者术后1年随访胸、腹主动脉真、假腔体积变化(表1):表1 显示,无论是全部假腔内血栓形成者,还是部分假腔内血栓形成者,胸主动脉真腔体积均显著增大,而胸主动脉假腔体积则显著缩小,其术后1年与术前比较差异均有统计学意义(P均<0.01)。对于全部假腔内血栓形成者,腹主动脉真腔体积显著增大;部分假腔内血栓形成者,腹主动脉假腔体积也显著增大,其术后1年与术前比较差异均有统计学意义(P均<0.01)。
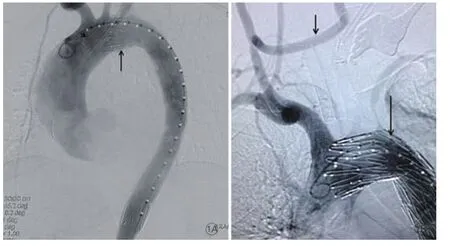
图1 主动脉腔内修复手术示意图
表1 30例患者术前及术后1年随访胸、腹主动脉真、假腔体积变化

表1 30例患者术前及术后1年随访胸、腹主动脉真、假腔体积变化
注:*术后1年与术前比较
?
3 讨论
手术时机的选择:由于88%的急性Stanford B型夹层患者通过保守治疗,都能平稳渡过急性期(发病后2周)[7],并且由于急性期行腔内治疗有主动脉夹层逆向撕裂至升主动脉导致死亡的风险[8],所以除非有破裂或先兆破裂、内脏动脉缺血、下肢动脉缺血以及急性脊髓缺血者需积极进行腔内治疗,否则建议在2周后再行腔内治疗。
复杂性急性Stanford B 型夹层腔内治疗:对于内脏动脉缺血者,术前CTA的评估非常重要,尤其是对肠系膜上动脉和肾动脉的评估。如果肠系膜上动脉来自真假腔同时供血,术后不会加重肠管缺血。如果一侧肾动脉来自假腔,另一侧来自真腔,不必考虑术后肾缺血的问题。如果肠系膜上动脉或双肾动脉来自假腔供血,术后可能导致严重的肠管缺血或肾缺血,有学者把这种状况作为腔内修复的禁忌证,但临床情况并非如此,主动脉夹层有多个破口,第二、三破口通常位于内脏动脉附近,无第二裂口的夹层往往易于急性死亡而来不及就诊。因此针对第一裂口的腔内修复术后,内脏动脉附近的裂口依然存在,假腔内的血流不会停止,因此不会导致肠管缺血或肾缺血。舒畅等[9]报道4例肠系膜上动脉供血完全来自假腔,腔内修复后均未导致严重的缺血,其中3 例患者术后第1 天彩色多普勒超声心动图示肠系膜上动脉供血仅正常的30% ~50%,2 周后复查显示肠系膜上动脉血供基本恢复,其余病例术后肠缺血症状均消失。本组5例合并肠管缺血,其中3例来自真假腔供血,2例完全来自假腔供血,18例合并单侧肾脏缺血,2例合并双侧肾脏缺血,腔内修复后,缺血症状均改善。
对于第一裂口距左锁骨下动脉小于15 mm者,覆膜支架近端锚定区域不够,而且主动脉弓弯曲的解剖形态、高压、高速血流以及病变本身引起的动脉形态、血流动力学改变都会影响腔内治疗效果,甚至直接导致手术失败[10,11]。因此,为了争取更长的近端锚定区,需要覆盖左锁骨下动脉开口,这时需要评估优势椎动脉, Willis环是否完整,如果是右侧椎动脉为优势,Willis环完整,则可直接覆盖左锁骨下动脉,即覆膜支架近端紧贴左颈动脉开口释放,无需重建左锁骨下动脉血流。这种方法可能会导致大脑或左上肢缺血的潜在风险[12,13],但多可通过对侧椎动脉Willis环和胸壁、肩周动脉的代偿而避免。另外,左锁骨下动脉反流可能会导致Ⅱ型内漏,然而,这与腹主动脉瘤腔内修复术后发生的Ⅱ型内漏不同:肠系膜下动脉和(或)腰动脉常开口于瘤腔,支架与瘤壁间存在较大间隙,不利于血栓形成,而左锁骨下动脉开口能被支架较好贴附,充分利用支架径向支撑力和主动脉血压-左锁骨下动脉反流压力差阻止Ⅱ型内漏的发生[14]。本组有22 例行主动脉腔内修复并直接覆盖左锁骨下动脉开口,术后左上肢桡动脉无搏动,均未出现脑缺血及左上肢缺血症状,支架形态良好,无内漏发生。司逸等[15]报道封堵55例左锁骨下动脉,其中17例是左侧优势动脉,14例是右侧优势椎动脉,其余椎动脉对称,术后有13例出现头晕症状,7例出现左上肢间歇性跛行。出现脑缺血及左上肢缺血并发症的原因与左侧优势椎动脉时封堵左锁骨下动脉有关。因此,当左侧优势椎动脉时,建议重建左锁骨下动脉血流,包括左颈动脉-左锁骨下动脉人工血管转流、烟囱技术。烟囱技术是指在腔内修复过程中,置入一端与覆膜支架平行释放,另一端位于分支动脉内的带膜或者裸支架,这样覆膜支架可以跨越分支动脉开口释放,同时又保证了分支动脉的血供,因分支血管内支架的释放位置形似烟囱而得名[10]。实施烟囱技术要求:(1)主动脉弓较陡(Ⅲ型弓)[16]; (2)目标分支动脉与主动脉弓所成的夹角<30°[8]; (3)裂口不在主动脉弓的外侧曲线[17]。这三点是适合选择烟囱术式的重要条件。如果主动脉弓平坦(Ⅰ型弓)或目标分支动脉与主动脉弓所成夹角偏大甚至垂直,则置入颈动脉内的支架在进入弓部近端时势必出现弯折,从而影响远期通畅率,烟囱技术一方面通过主动脉锚定区的延伸来防止内漏,另一方面烟囱本身又增加了发生内漏的可能[18],研究发现,如果裂口位于弓的外侧曲线,行烟囱技术发生Ⅰ型内漏的几率显著增高[19,20]。因此,应用烟囱技术治疗复杂病变的效果取决于如何在Ⅰ型内漏与争取锚定距离之间达成平衡,并严格遵循烟囱技术的适应证。本组10例结合左锁骨下动脉“烟囱”技术行主动脉腔内修复,2例先实施左颈总动脉—左锁骨下动脉人工血管转流后再行腔内修复,2例先实施右颈总动脉-左颈总动脉人工血管转流(左颈总动脉近心端结扎)后再行主动脉腔内修复。术后无内漏等并发症发生。Zhu等[21]报道34例结合烟囱技术的B型夹层的腔内修复,无名动脉3例,左颈总动脉8例,左锁骨下动脉23例,技术成功率82%,Ⅰ型内漏发生率15%,无围手术期死亡和脑卒中,技术成功率低于本组,内漏发生率高于本组,这可能与方法有关:本研究在无名动脉以及左颈总动脉的裂口采用的是小切口杂交手术,对于裂口位于主动脉弓外侧曲线的病例采用的也是小切口杂交手术而不是烟囱技术。
本研究有30例患者获得随访,随访时间1年,所有支架形态良好,无移位,第一裂口封堵良好,无新的裂口出现,所有病例假腔血栓逐渐形成,其中10例(33.33%)全部假腔形成血栓,远端破口封闭,远端内膜完整,假腔体积减少,真腔体积增大。20例假腔内部分血栓形成,主要以假腔近端为主,远端假腔仍在,远端破口存在,即内膜仍不完整,但远端直径无明显变化。Tolernaar等[22]报道,43例接受腔内修复的主动脉夹层患者,术后1年随访,其中16例(37%)假腔内全部血栓形成,与本组相似。
综上所述,对于复杂性和复杂解剖条件的急性Stanford B型夹层治疗,结合覆盖左锁骨下动脉、杂交和烟囱技术等方法能提高腔内修复疗效并降低并发症,近期疗效良好。
[1] Coady MA, Ikonomidis JS, Cheung AT, et al. Surgical management of descending thoracic aortic disease: open and endovascular approaches: a scientific statement from the American Heart Association. Circulation, 2010, 121: 2780-2804.
[2] Fattori R, Cao P, De Rango P, et al. Interdisciplinary expert consensus document on management of type B aortic dissection. J Am Coll Cardiol , 2013, 61: 1661-1678.
[3] Tsai TT, Trimarchi S, Nienaber CA. Acute aortic dissection: perspectives from the international registry of acute aortic dissection(IRAD). Eur J Vasc Endovasc Surg , 2009, 37: 149-159.
[4] 易定华, 段维勋. 中国主动脉夹层诊疗现状与展望. 中国循环杂志, 2013, 28: 1-2.
[5] 陈纪言, 罗淞元, 刘媛. 急性主动脉夹层的腔内修复术治疗现状与展望. 中国循环杂志, 2014, 29: 1-2.
[6] 舒畅, 方坤. 复杂性型主动脉夹层的腔内治疗. 中国血管外科杂志(电子版), 2012, 4: 212-213.
[7] 蒋俊豪, 季瀛豪, 郭大乔, 等. 急性Stanford B型主动脉夹层腔内修复术的指征和治疗时机选择. 中华外科杂志, 2009, 47: 1784-1786.
[8] Dong ZH, Fu WG, Wang YQ, et al. Retrograde type A aortic dissection after endovascular stent graft placement for treatment of type B dissection. Circulation, 2009, 119: 735-741.
[9] 舒畅, 李全明, 姜晓华, 等. 复杂型主动脉夹层的腔内治疗. 中国普通外科杂志, 2006, 15: 897-900.
[10] Dake MD, Miller DC, Mitchell RS, et al. The “first generation” of endovascular stent-grafts for patients with aneurysms of descending thoracic aortic. J Thorac Cardiovasc Surg , 1998, 116: 689-703.
[11] Criado FJ, Clark NS, Barnatan MF. Stent graft repair in the aortic arch and descending thoracic aorta: a 4-year experience. J Vasc Surg , 2002, 369: 1121-1128.
[12] Chung J, Kasirajan K, Veeraswamy RK, et al. Left subclavian artery coverage during thoracic endovascular aortic repair and risk of perioperative stroke or death. J Vasc Surg, 2011, 54: 979-984.
[13] Manninen H, Tulla H, Vanninen R, et al. A Endangered cerebral blood supply after closure of left subclavian artery: postmortem and clinical imaging studies. Ann Thorac Surg, 2008, 85: 120-125.
[14] 竺挺, 符伟国, 王玉琦, 等. 复杂主动脉瘤及主动脉夹层的腔内治疗策略. 中华外科杂志, 2011, 49: 491-494.
[15] 司逸, 符伟国, 王玉琦, 等. 胸主动脉腔内修复术封堵左锁骨下动脉的前瞻性研究. 中华外科杂志, 2009, 47: 1868-1872.
[16] Criado FJ. Chimney grafts and bare stents: aortic branch preservation revisited. J Endovasc Ther, 2007, 14: 823-824.
[17] Xue Y, Sun L, Zheng J, et al. The chimney technique for preserving the left subclavian artery in thoracic endovascular aortic repair. Eur J Cardiothoracic Surg , 2015, 4: 7: 623-629.
[18] Ohrlander T, Sonesson B, Ivancev K, et al. The chimney graft: a technique for preserving or rescuing aortic branch vessels in stentgraft sealing zones. J Endovasc Ther, 2008, 15: 427-432.
[19] Pamler RS, Kotsis T, Gorich J, et al. Complications after endovascular repair of type B aortic dissection. J Endovasc Ther, 2002, 9: 822-828.
[20] Sze DY, van den Bosch MA, Dake MD, et al. Factors portending endoleak formation after thoracic aortic stentgraft repair of complicated aortic dissection. Circ Cardiovasc Interv, 2009, 2: 105-112.
[21] Zhu Y, Guo W, Liu X, et al. The single-centre experience of the supra-arch chimney technique in endovascular repair of type B aortic dissections. Eur J Vasc Endovasc Surg , 2013, 45: 633-638.
[22] Tolenaar JL, Kern JA, Jonker FH. Predictors of false lumen thrombosis in type B aortic dissection treated with TEVAR. Ann Cardiothorac Surg, 2014, 3: 255-263.
Short Term Clinical Efficacy of Endovascular Repair for Complicated Acute Type Stanford B Aortic Dissection in 36 Patients
ZHENG Jiang-hua, CHEN Kai, ZHU Yan-bin, WANG Hai-fei, CHEN Zhi-long, YONG Xi.
Department of Vascular Surgery, Affiliated Hospital of North Sichuan Medical College, Nanchong (637000), Sichuan, China
Objective: To investigate the short term clinical efficacy of endovascular repair for complicated acute type Stanford B aortic dissection.Methods: To retrospectively analyze the clinical data of 36 patients with complicated acute type Stanford B aortic dissection who received endovascular repair in our hospital from 2010-01 to 2014-06 including operational procedure and postoperative follow-up of CT angiography. There were 27 male and 9 female patients with the average age of 43.7 years (41-62) years.Results: Successful operations were conducted in all 36 patients. 22 patients received endovascular repair combinedwith covering left subclavian artery (LSA),10 received endovascular repair combined with chimney technique, 2 received endovascular repair combined with vascular prosthesis bypass from left common carotid artery to LSA, 2 received endovascular repair combined with vascular prosthesis bypass from right common carotid artery to left common carotid artery, whose proximal parts were ligated. Viscera artery and lower extremity artery supply were restored gradually. No complication of endoleak occurred. There 30/36 (83.33%) patients were followed-up for 1 year, and 10 patients developed thrombus in full false lumen and 20 developed thrombus in partial false lumen after 1 year. Compared with pre-operative values, thoracic aortic true lumen volume increased in either thrombus in full false lumen (190 ± 68.7) ml vs, (125.3 ± 63.4) ml and thrombus in partial false lumen (166.2 ± 71.8) ml vs (110.1 ± 62.7) ml, P<0.001; thoracic aortic false lumen volume decreased (65.0 ± 67.4) ml vs (185.3 ± 66.6) ml and (132.3 ± 62.6) ml vs (224.5 ± 72.3) ml, P<0.001. Compared with preoperative values, for patients with thrombus in full false lumen, the abdominal aortic true lumen volume increased (55.5 ± 12.4) ml vs (48.6 ± 12.2) ml, P<0.01; for patients with thrombus in partial false lumen, the abdominal aortic false lumen volume also increased (58.2 ± 21.5) ml vs (42.5 ± 18.5) ml, P<0.01.Conclusion: For endovascular repair of complicated aortic dissection, covering LSA with chimney technique and hybrid operation of small incision could extend anchor zone and expand the range of endovascular repair which may improve the effect and reduce the complication for good short term effect.
Complicated aortic dissection; Endovascular repair
2014-09-15)
(编辑:梅 平)
637000 四川省南充市,川北医学院附属医院 血管外科
郑江华 副教授 博士 主要从事血管外科基础与临床研究 Email:zhengjianghua@126.com 通讯作者:郑江华
R541
A
1000-3614(2015)08-0785-05
10.3969/j.issn.1000-3614.2015.08.017
