天然四倍体泥鳅雄核发育二倍体诱导条件优化
2015-12-13林忠乔李雅娟张赛赛姜志强王伟王玉生
林忠乔,李雅娟,张赛赛,姜志强,王伟,王玉生
(农业部北方海水增养殖重点实验室,大连海洋大学,辽宁大连 116023)
天然四倍体泥鳅雄核发育二倍体诱导条件优化
林忠乔,李雅娟*,张赛赛,姜志强,王伟,王玉生
(农业部北方海水增养殖重点实验室,大连海洋大学,辽宁大连 116023)
为探索安全、易操作的鱼类雄核发育新途径。以天然四倍体泥鳅为父本,二倍体泥鳅为母本人工催产授精,冷休克诱导雄核发育二倍体。试验选用L9(34)设计,进行三因素三水平正交试验,受精后时间为A,设0、5和10 min;处理温度为B,设0、3和6℃;处理时间C,设45、60和75 min。染色体倍性鉴定采用单个胚胎染色体计数法。结果表明,最高雄核发育二倍体诱导率为63.33%;根据正交试验直观分析结果,得出诱导天然四倍体泥鳅雄核发育二倍体各因素最优水平组合:受精后5 min,处理温度3℃,处理时间60 min;影响雄核发育三因素主次顺序为:受精后时间→处理温度→处理时间。
天然四倍体泥鳅;冷休克;雄核发育二倍体;正交试验
网络出版时间2015-12-28 13:49:05[URL]http://www.cnki.net/kcms/detail/23.1391.S.20151228.1349.004.html
林忠乔,李雅娟,张赛赛,等.天然四倍体泥鳅雄核发育二倍体诱导条件优化[J].东北农业大学学报,2015,46(12):58-64.
Lin Zhongqiao,Li Yajuan,Zhang Saisai,et al.Optimizer of induction androgenetic dipoid in natural tetraploid loach[J].Journal of Northeast Agricultural University,2015,46(12):58-64.(in Chinese with English abstract)
雄核发育(Androgenesis)是指用精子生产只含父系遗传物质的个体繁殖方式[1]。雄核发育遗传物质完全来自父本,在生产和科研上,具有快速建立纯系、性别决定机制判别、单性种群利用、保护濒危鱼类、遗传分析、隐性基因检测等特殊优势作用[2]。目前,人工诱导鱼类雄核发育途径有两种:第一种是二倍体鱼类,经卵子遗传失活,染色体加倍获得纯合雄核发育二倍体。实现该途径需解决卵子染色体遗传失活及染色体加倍两个关键问题。现有使卵子染色体遗传失活最常用的方法有电离辐射(γ射线、Х射线)或紫外线(UV)照射等,应用辐射方法对卵子的遗传物质灭活简便易行,但射线在破坏卵子细胞核的同时,对细胞质和其他细胞器也造成不同程度破坏,此卵子受精后,单倍体虽能较好地通过胚胎发育,但到孵化期或孵化后数天,会因“单倍体综合症”而陆续死亡。染色体加倍主要利用温度、压力刺激或化学诱变剂阻止第一次卵裂,但所获二倍体存活率极低。第二种是四倍体鱼类,只经卵子遗传失活,无需染色体加倍即可获得杂合雄核发育二倍体。实现此途径需具有四倍体雄鱼,但人工诱导四倍体难度大,且该途径也需卵子遗传失活,成活率较低。最近,Morishima等报道3℃冰水处理泥鳅(Misgurnus anguillicaudatus)受精卵60 min能诱导产生雄核发育后代[3]。Hou等进行人工诱导四倍体泥鳅的冷休克诱导雄核发育二倍体研究[4]。
大连海洋大学农业部北方海水增养殖重点实验室利用3℃冰水处理大鳞副泥鳅受精卵60 min,成功诱导雄核发育单倍体,并探讨雄核发育的细胞学机制是卵核与第二极体一同释放[5]。因此,利用天然四倍体鱼类,探索无需卵子失活及不经染色体加倍处理,快速、高效生产雄核发育二倍体具有可行性。
近10年本实验室对我国长江流域特有的天然四倍体泥鳅进行系统研究,结果发现,天然四倍体泥鳅是含有四套染色体组的遗传四倍体(4n= 100)、是同源四倍体、能产生正常的2n配子(雌或雄)[6-9]。因此,本试验以天然四倍体泥鳅为父本,二倍体泥鳅为母本人工催产授精,冷休克诱导雄核发育二倍体,运用正交试验设计,探讨冷休克诱导雄核发育二倍体的适宜条件。旨在探索既不需要卵子遗传失活,也不需要染色体加倍的安全、易操作的鱼类雄核发育新途径,为提高人工诱导鱼类雄核发育二倍体诱导率和成活率提供技术参数。
1 材料与方法
1.1材料
天然四倍体泥鳅(4n=100)(♂)取自湖北省赤壁市,倍性经血红细胞核体积测量和流式细胞仪检测确定。二倍体泥鳅(2n=50)(♀)取自大连市农贸市场,暂养于细胞遗传与工程实验室水族箱中,温度(22±1)℃。
1.2方法
1.2.1人工催产及授精
挑选天然四倍体雄鱼和大连本地二倍体雌鱼,注射绒毛膜促性腺激素(HCG)(注射剂量:♀20~25 UI·尾-1,♂减半)人工催产,12 h后确认雌鱼排卵情况,轻压二倍体雌鱼腹部若有卵排出,用稀释1 000倍的苯甲醇将泥鳅麻醉,待雌鱼麻醉后,挤卵,将卵收集到铺有保鲜膜的9 cm培养皿中,用毛细管收集精液于1.5 mL塑料离心管中(用精子稀释液稀释100倍),光学显微镜下观察精子活力。
1.2.2试验设计
试验选用L9(34)设计,三因素三水平正交试验,试验设计见表1,受精后时间为A,设0、5和10 min;处理温度为B,设0、3和6℃;处理时间C,设45、60和75 min。影响雄核发育二倍体率三因素主次顺序和最优水平组合以直观分析法获得。
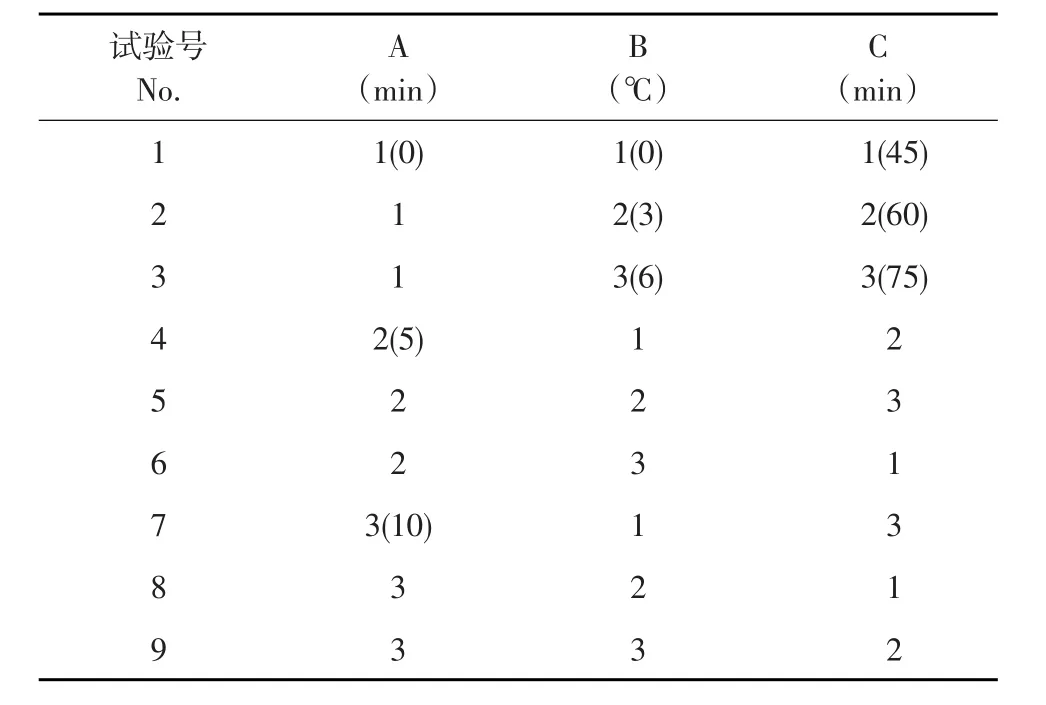
表1 正交试验设计Table 1Orthogonal test design
1.2.3冷休克处理
受精后0、5、10 min时将受精卵分别放入0、3和6℃中,处理45、60、75 min后,将受精卵放入(20±1)℃曝气水中孵化。
1.2.4胚胎染色体倍性鉴定
采用单个胚胎染色体计数法。取发育至肌肉效应期的胚胎30~50个,剥去卵膜和卵黄,0.0025%秋水仙素处理45 min,0.8%柠檬酸低渗20 min,用预冷的卡诺固定液(甲醇∶冰醋酸=3∶1)固定3次,每次15~20 min,-20℃冷冻过夜。次日冷滴片,室温下自然风干,10%吉姆萨染液染色30 min,自来水冲洗,自然风干。普通光学显微镜下选择分散均匀、图像清晰的中期分裂相观察拍照。每个处理统计30个单个胚胎染色体数目。
1.2.5数据处理
鱼卵发育至原肠晚期时统计受精率(受精卵数占总卵数的百分数);鱼卵发育至孵出前期时统计孵化率(孵化苗数占受精卵数的百分数);开口摄食时统计成活率(成活胚胎占总受精卵数的百分数)。
2 结果与分析
2.1不同处理组染色体数目分布
通过染色体计数法分析正交试验1~9组单个胚胎(30个·组-1)的染色体数目组成,结果表明,不同处理组均出现不同频率的整倍体和非整倍体,整倍体中有雄核发育二倍体(2n=50)(见图1a)、正常三倍体(3n=75)(见图1b)及四倍体(4n=100)(见图1c)。雄核发育二倍体率最高是第5组即受精后5 min,处理温度3℃,处理75 min,2n=50有19个,众数百分比为63.33%(见图2 e),其次是第4组即受精后5 min,处理温度0℃,处理60 min,2n=50有18个,众数百分比为60%(见图2 d)。同时在1、2、3、6、7及9组发现频率不同的四倍体(见图2 a,b,c,f,g,i),其中,第2组即受精后0 min,处理温度3℃,处理60 min,4n=100有8个,众数百分比最高为26.67%(见图2 b)。
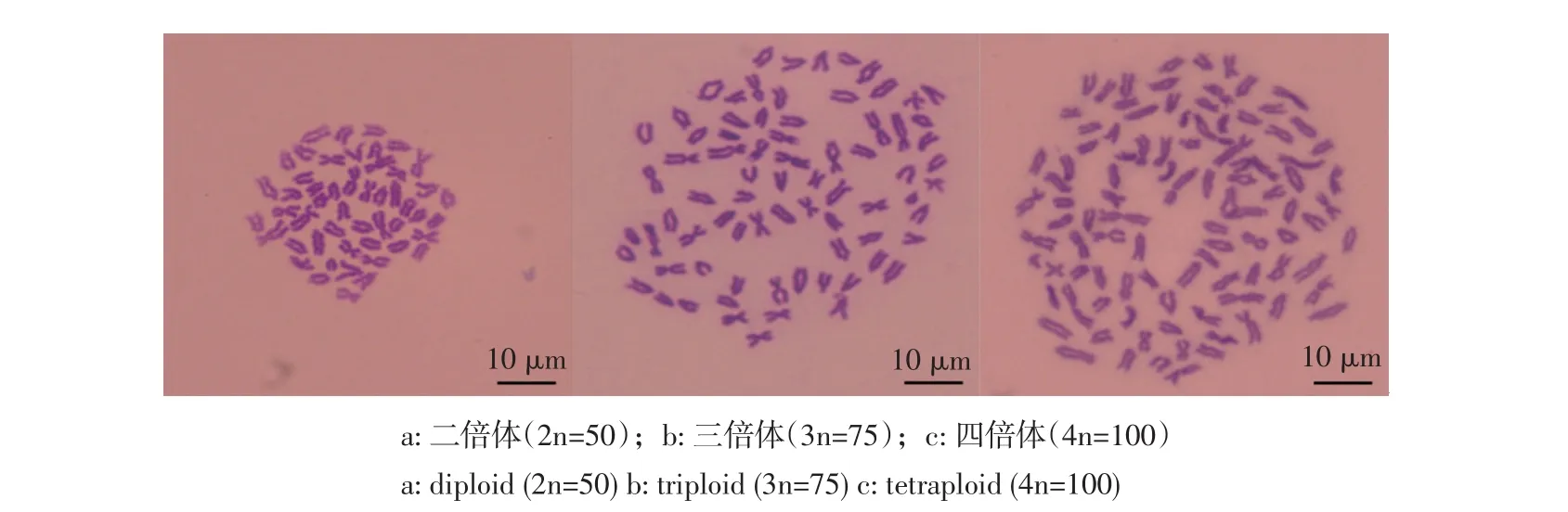
图1 胚胎染色体中期分裂相Fig.1Metaphase spread of embryo
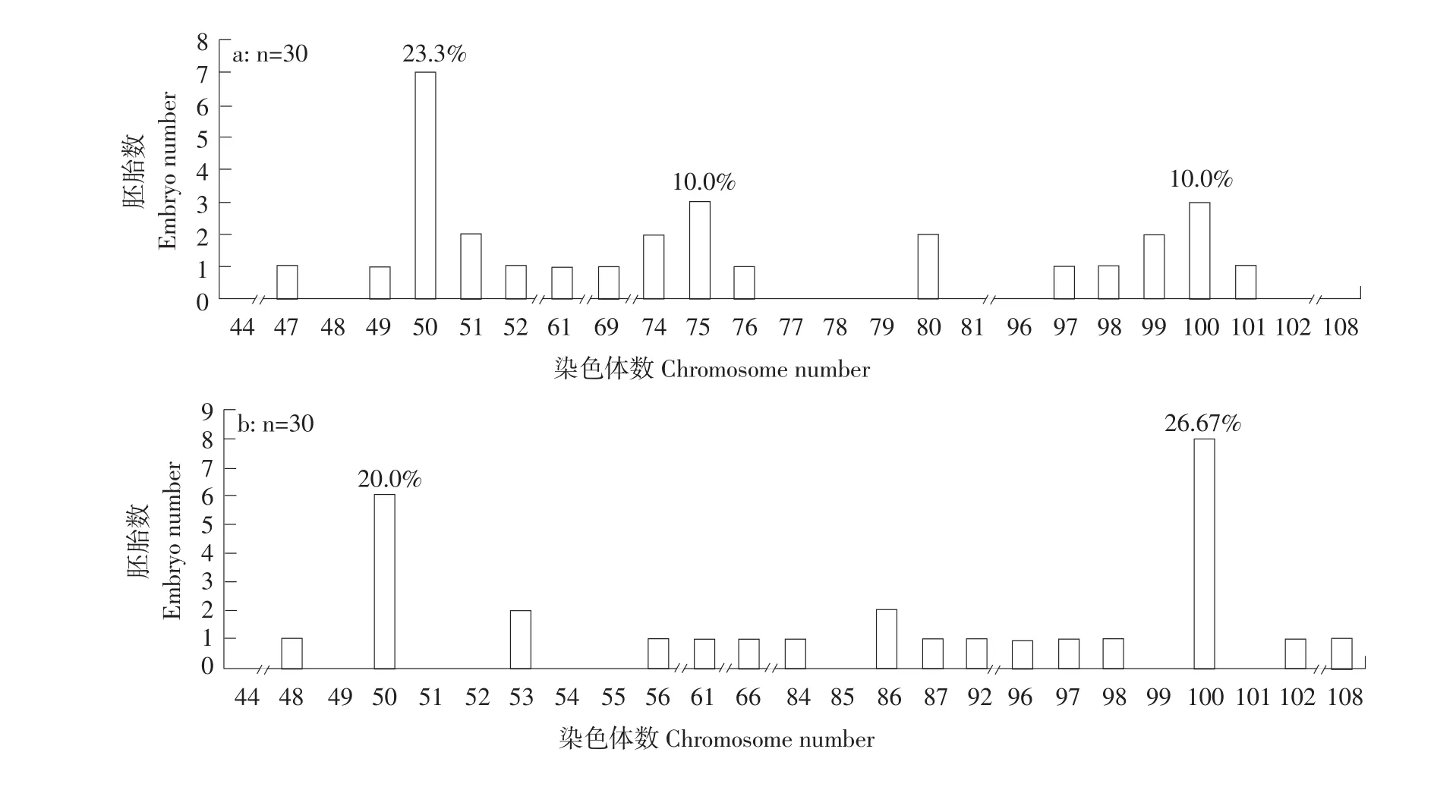
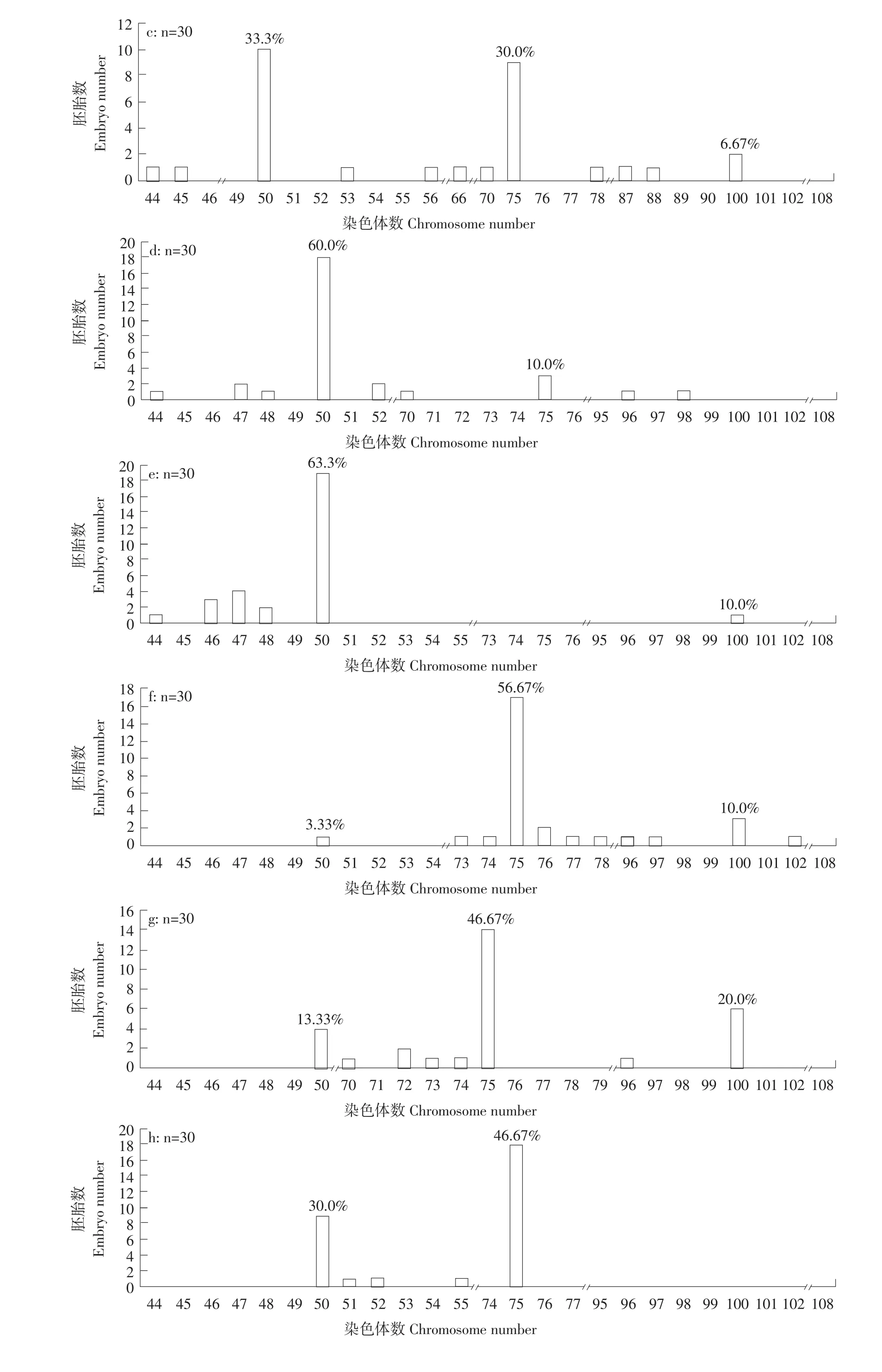
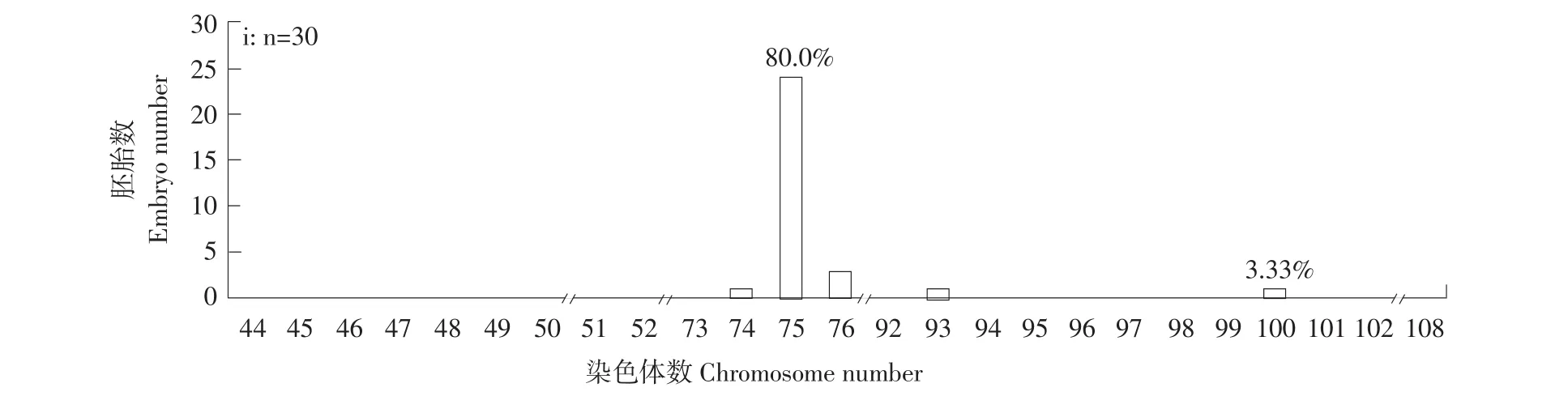
图2 正交试验各组胚胎染色体数目分布频率Fig.2Distribution frequency of number of chromosome at embryo period in each group of the orthogonal text
2.2正交试验结果
根据直观分析结果见表2。由表2可知,极差R值,影响雄核发育3因素主次顺序为:受精后时间→处理温度→处理时间。为更直观了解雄核发育与各因素水平变化情况,作各因素水平对二倍体率效应图。
据图3可知,A和B因素折线图中的直线陡度较大,说明二者对雄核发育二倍体的效应大,为主要因素,C因素为次要因素。得到最优水平组合:受精后5 min、处理温度3℃、处理时间60 min。
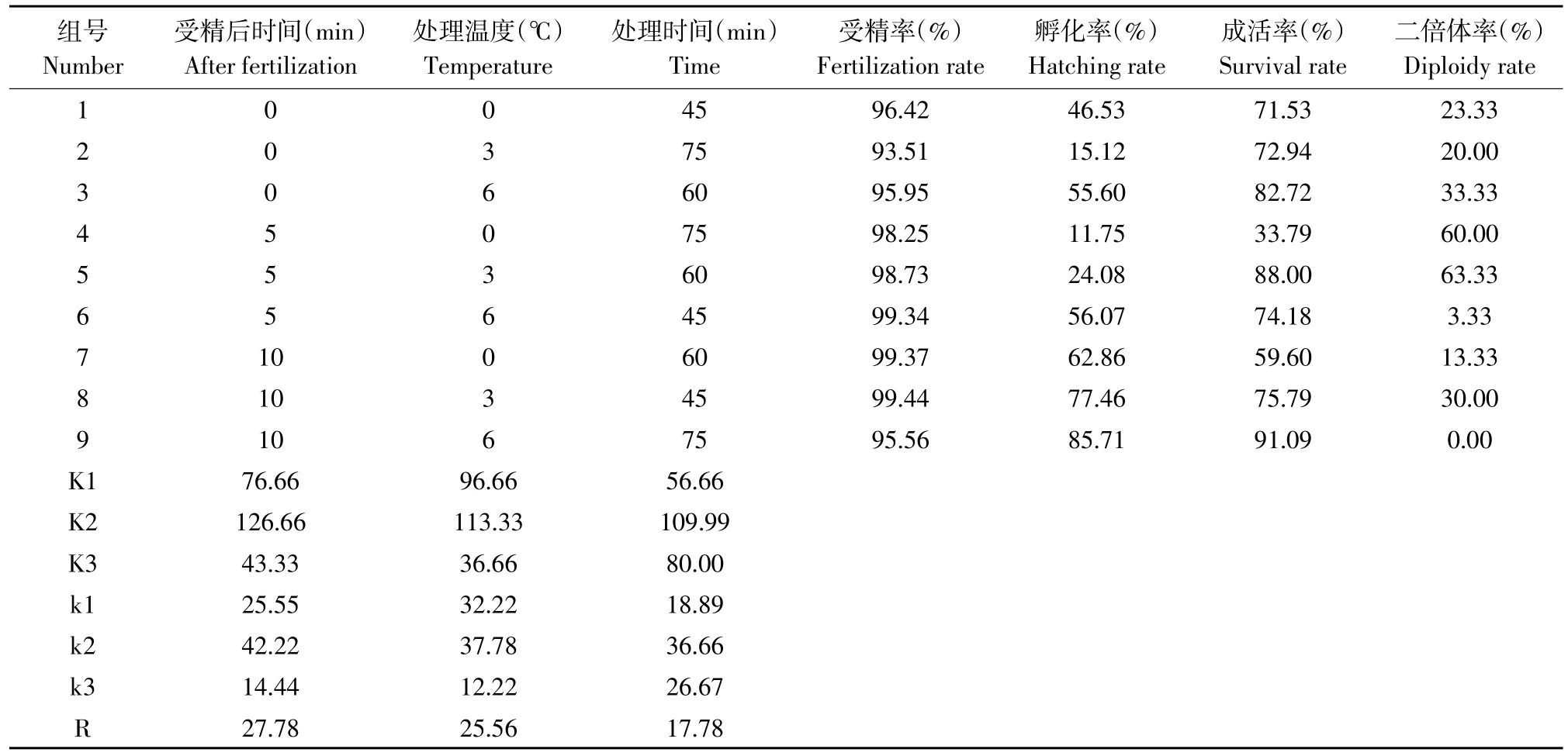
表2 正交试验结果及直观分析Table 2Results of orthogonal test and intuitive analysis
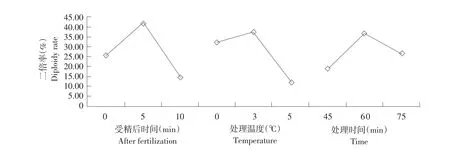
图3 三因素水平对雄核发育二倍体诱导率的效应Fig.3Effects of the three factors and their levels on diploidy
3 讨论与结论
利用不同温度处理受精卵得到单倍体后代方法,目前国内外鲜有报道。Gervai等发现利用冷休克处理鲤鱼受精卵[10],除三倍体外,也发现高频率的雄核发育单倍体胚胎。Ueda报道虹鳟鱼受精后30 s或3.5 h后用30℃热水处理7 min可获得低频率的雄核发育二倍体个体[11]。近来Morishima等报道3℃冰水处理泥鳅受精卵60 min可产生雄核发育后代[3]。王玉生等报道3℃冰水处理大鳞副泥鳅受精卵60 min可产生雄核发育单倍体[5]。上述方法可克服射线处理卵核造成的低成活率问题,成本低、易操作、有利于大规模生产使用,在遗传育种方面有重要意义。
关于冷休克诱导雄核发育的细胞学机制,Gervai等认为雄核发育可能是冷休克损伤雄性或雌性原核[10]。Morishima等[3]、王玉生等[5]通过受精细胞学观察认为雄核发育是雌性原核和第二极体的共同释放。因此,冷休克诱导雄核发育的三大要素(处理起始时间,处理温度及处理时间)中处理起始时间尤为重要,处理晚第二极体释放,处理早可能极体尚未释放,无法产生作用。本研究发现泥鳅在(20±1)℃情况下受精后10 min释放第二极体。赵振山等研究发现[12],大鳞副泥鳅卵与泥鳅精子受精后6~9 min时雌核膨胀核化,并向卵子内部移动,也间接说明6~9 min时第二极体已排出卵外。本试验中,雄核发育二倍体率较高的第4组(60%)和第5组(63.33%),均为受精后5 min开始低温处理,而在受精后0、10 min时对受精卵冷休克处理,所得二倍率普遍较低,这可能是由于此时第二极体尚未形成或已排出体外,低温处理无法再对其产生影响所致,出现二倍体率低的现象,因此判定受精后5 min左右冷休克处理效果最佳。
另外,处理温度对胚胎发育过程的极体释放以及第一次卵裂也有较大影响。目前,利用温度诱导多倍体报道很多,王军等在受精后2 min时对大黄鱼受精卵低温(3~4℃)处理8~10 min[13],得到34%三倍体诱导率。蔡国雄在受精后5 min时[14],用1.5℃冰水处理真鲷受精卵,得到17%三倍体和28%嵌合体。张新辉等以孵化温度26~27℃、受精后3 min以0~2℃处理25 min诱导团头鲂三倍体率为60.67%[15],根据冷休克抑制第二极体释放的方式诱导团头鲂三倍体。另外斑马鱼(Danio rerio)[16]、团头鲂(Megalobrama amblycephala)[17]、刺鲶鱼(Silurus asotus)[18]、斑点叉尾鮰(Letalurus punetaus)[19]等在早期胚胎发育过程中,用热休克适当处理可得到三倍体和四倍体。吴玉萍等对斑马鱼热休克(39℃)处理,三倍体诱导率为53.8%[16]。王军等在大黄鱼受精后2.5 min时37℃处理5 min[13],也可获得较高三倍体诱导率。说明适当温度处理使杂交后代倍性增长或加倍。本研究发现,在泥鳅胚胎发育早期利用不同温度(0、3、6℃)处理不同时间,经早期单个胚胎染色体数目观察发现,正交试验各组中除有雄核发育二倍体(2n=50)和正常三倍体(3n=75)胚胎外,部分组中还出现四倍体(4n= 100)现象,其形成机制可能是二倍体雌鱼与四倍体雄鱼杂交,冷休克抑制受精卵第二极体释放形成二倍体卵核再与四倍体雄鱼产生的二倍体精核结合形成四倍体,其细胞学机制有待进一步研究。以往报道人工诱导鱼类四倍体形成途径主要是抑制卵裂,但难度大,成功率低。
本研究发现,在第2组即受精后0 min,处理温度3℃,处理60 min,4n=100有8个(26.67%)。说明利用二倍体与四倍体杂交冷休克处理受精卵可获得四倍体,为人工诱导鱼类四倍体提供新途径。
本研究运用正交试验,筛选到天然四倍体泥鳅雄核发育二倍体冷休克诱导适宜参数,即受精后5 min、处理温度3℃、处理时间60 min,雄核发育二倍体率最高为63.33%。3因素主次顺序为:受精后时间→处理温度→处理时间。结果表明,无需卵子失活及染色体加倍,仅用冷休克可成功诱导天然四倍体泥鳅雄核发育二倍体,雄核发育二倍体率高达63.33%。为提高人工诱导鱼类雄核发育二倍体诱导率和成活率提供参考。
[1]范兆廷,宋苏祥.鱼类的雌核发育雄核发育和杂种发育[J].水产学报,1993,17(2):179-187.
[2]赵振山,吴清江,高贵琴.鱼类雄核发育的研究进展[J].遗传学报,2000,22(2):109-113.
[3]Kagayaki M,Takafumi F,Mami S,et al.Cold-shock eliminates female nucleus in fertilized eggs to induce androgenesis in the loach(Misgurnus anguillicaudatus),a teleost fish[J].Bio Med Central Biotechnology,2011,11(76):116.
[4]Jilun Hou,Takafumi Fujimoto,Etsuro Yamaha,et al.Production of androgenetic diploid loach by cold-shock of eggs fertilized with diploid sperm[J].Theriogenology,2013,80:125-130.
[5]王玉生,李雅娟,于长宁,等.冷休克诱导大鳞副泥鳅雄核发育单倍体的研究[J].水产学报,2014,38(2):161-169.
[6]Li Y J,Tian Y,Zhang M Z,et al.Chromosome banding and FISH with rDNA probe in the diploid and tetraploid loach Misgurnus anguillicaudatus[J].Ichthyological Research,2010,57(4):358-366.
[7]Li Y J,Yu Z,Zhang M Z,et al.The origin of natural tetraploid loach Misgurnus anguillicaudatus(Teleostei:Cobitidae)inferred from meiotic chromosome configurations[J].Genetica,2011,139: 805-811.
[8]Li Y J,Yu Z,Zhang M Z,et al.Induction of viable gynogenetic progeny using eggs and UV-irradiated sperm from the Chinese tetraploidloach,Misgurnusanguillicaudatus[J].Aquaculture International,2013,21(4):759-768.
[9]Li Y J,Zhang M Z,Qian C,et al.Fertility and ploidy of gametes of diploid,triploid and tetraploid loaches,Misgurnus anguillicaudatus,in China[J].Journal of Applied Ichthyology,2012,28(6): 900-905.
[10]Gervai J,Páter S,Nagy A,et al.Induced triploidy in carp, Cyprinus carpio L.[J].Journal of Fish Biology,1980,17(6):667-671.
[11]Ueda T.The possible induction of androgenetic diploid rainbow trout by an application of heat-shock[J].Chromosome Information Service,1996,61(1):12-13.
[12]赵振山,曹志华.大鳞副泥鳅卵与泥鳅精子杂交受精细胞学的观察[J].华中农业大学学报,1999,18(1):75-77.
[13]王军,尤锋.大黄鱼三倍体诱导的初步研究[J].厦门大学学报:自然科学版,2001,40(4):927-928.
[14]蔡国雄.真鲷三倍体诱导初步研究[J].热带海洋,1997,16(4): 95-98.
[15]张新辉,罗伟,高泽霞,等.团头鲂三倍体的诱导及其鉴定[J].水产科学,2013,32(9):503-507.
[16]吴玉萍,叶玉珍,吴清江.热休克诱导斑马鱼异源三倍体的研究[J].海洋与湖沼,2000,31(5):465-470.
[17]Zou S,Li S,Cai W,et al.Establishment of fertile tetraploid population of blunt snout bream(Megalobrama amblycephala)[J]. Aquaculture,2004,238(1):155-164.
[18]Haniff M A,Sridhar S,Nagarajan M.Induction of triploidy and tetraploidy in stinging catfish Heteropneustes fossilis(Bloch),using heat shock[J].Aquac Res,2004,35(10):937-942.
[19]Bidwell C A,Chrisman C L,Libey G S.Polyploidy induced by heat shock in channel catfish[J].Aquaculture,1985,51(1):25-32.
Optimizer of induction androgenetic dipoid in natural tetraploid loach/
LIN Zhongqiao,LI Yajuan,ZHANG Saisai,JIANG Zhiqiang,WANG Wei,WANG Yusheng(Dalian Ocean University Key Laboratory of Mariculture&Stock Enhancement in North China's sea, Ministry of Agriculture,Dalian Liaoning 116023,China)
In order to explore a new safe,easy operated approach of ichthyic androgenotes,used natural tetraploid loach as male parent and diploid one as female parent,to fertilized and hasten parturition manually,and induced androgenetic diploid loach by cold-shock of eggs fertilized with diploid sperm in this study.The orthogonal experiment of three factors and three levels[L9(34)]was used.The time after fertilization was A:0,5,10 min;processing temperature was represented as B:0, 3,6℃;processing time was represented as C:45,60,75 min.The identification of chromosome ploidy used counting method of singe embryo chromosome.The highest induction rate of androgenote diploid was 63.33%;according to the result of orthogonal experimental,could know the optimal solution of induction androgenetic diploid loach with the combination of several factors:5 minutes after fertilization, the oosperm was treated under 3℃for 60 minutes.The three factors affect androgenesis could be ranked as follow:fertilization time,processing temperature and processing time.
natural tetraploid loach;cold-shock;androgenesis diploid;orthogonal text
S966.4;S917.4
A
1005-9369(2015)12-0058-07
2015-02-11
国家自然科学基金(31272650);大连海洋大学博士启动基金项目(017208)
林忠乔(1990-),男,硕士研究生,研究方向为水产动物良种繁育。E-mail:linzhongqiao90@163.com
李雅娟,教授,研究方向为水产动物遗传育种。E-mail:liyajuan@dlou.edu.cn
