3.0 T DCE-MRI定量分析在前列腺癌与增生鉴别诊断中的应用价值
2015-12-13徐嬿冷晓明郑芸赵曼曾道辉韩晓蕊冯欣王晓春
徐嬿,冷晓明,郑芸,赵曼,曾道辉,韩晓蕊,冯欣,王晓春
广州中医药大学第一附属医院影像科,广州 510405
前列腺疾病严重威胁着男性的健康,其中最具危害的还是前列腺癌。MRI检查是前列腺疾病最佳的影像学检查方法,典型的前列腺癌常表现为外周带的T2WI低信号结节影,但前列腺炎、纤维化、出血、钙化、内分泌治疗后也可表现为外周带低信号影,因此敏感性、特异性不高[1]。此外,常规MRI对发生在中央带的癌结节的检测率较低,有时中央带癌结节的MRI表现与增生结节类似,较难鉴别[2-3],这些都对前列腺癌的诊断增加了困难。近年来有研究表明DCE-MRI的敏感性及特异性较常规T2WI图像高,大大提高了前列腺疾病的诊断[4-5]。本研究主要研究动态增强的定量参数对前列腺癌与其增生的鉴别诊断价值以及定量指标Ktrans、Kep、Ve与肿瘤组织Gleason评分的相关性,提示肿瘤的恶性程度,为临床提供诊断及治疗依据。
1 材料和方法
1.1 病例资料
搜集2013年7月至2014年12月在我院行常规MRI和DCE-MRI检查的前列腺患者43例,年龄47~84岁,平均68岁,前列腺特异性抗原(prostate specifi c antigen,PSA)水平4.9~100 ng/ml,所有被试人员均签署知情同意书。患者入选标准:①行前列腺MRI检查前未经过内分泌、放疗等非手术治疗;②MR检查前一个月未进行过前列腺穿刺;③行前列腺MRI检查后行直肠超声引导下标准12针法穿刺活检或前列腺根治术并经病理证实。
1.2 检查方法
MRI检查采用GE HDxt 3.0 T 磁共振扫描仪,体相控阵线圈,扫描中心位于耻骨联合上方约2 cm处,扫描前嘱受检者适量饮水,膀胱中度充盈,防止过度充盈引起波动伪影及检查时间过长患者无法耐受检查。扫描序列包括常规冠状位、轴位、矢状位T2WI、轴位T1WI及DCE-MRI序列。其中DCE-MRI扫描采用LAVA-FLEX扫描序列,动态增强扫描前先行多翻转角扫描序列,共7个多翻转角序列,每个序列均扫描一个时相,翻转角(Flip Angle)分别为:3、6、9、12、5、10、15。扫描参数:TR/TE为4.272/2.06,层厚/层间隔为4 mm/2 mm,矩阵288×224,重建矩阵512×512,视野350×350,时间分辨率16 s。多翻转角序列扫完后行动态增强扫描,扫描参数:翻转角为15,TR/TE为4.272/2.06,层厚/层间隔为4 mm/2 mm,矩阵288×224,重建矩阵512×512,视野350×350,时间分辨率16 s,共扫描35个时相。扫描开始同时注射对比剂钆双胺注射液(欧乃影,GE医疗)。对比剂经肘前静脉留置针高压注射器快速注射,注射速率 2 ml/s,注射剂量15 ml,然后注射生理盐水20 ml,注射速率2 ml/s。
1.3 图像及数据分析
DCE-MRI定量分析采用血流动力学定量分析软件Omni Kinetics(GE医疗,中国)进行后处理。首先导入7个多翻转角序列进行T1 mapping计算用于时间亮度图像到时间对比剂浓度图像转换。然后将动态增强序列导入,选择动脉血管层面勾画圆形的感兴趣区(region of interest,ROI)得到该区域内正常供血血管的时间浓度曲线作为动脉输入函数(arterial input function,AIF)曲线。将AIF曲线作为参照,选择Extended Tofts Linear双室模型对病灶层面进行血管渗透性定量分析,获得血管渗透性参数容积转运常数(Ktrans)、速率常数(Kep)、血管外细胞外容积分数(Ve),并生成病灶增面各参数红蓝伪彩图相关参数图像。勾画病灶ROI时通过根治术后大体标本切片和直肠超声引导下穿刺活检病理结果明确癌组织和增生组织,穿刺采用标准12针法穿刺法。主要观察肿瘤的位置、形态、大小和边界,在动态增强原始图像上勾画病灶ROI,各个参数伪彩图ROI相同。画定ROI后通过软件对前列腺癌组织和增生组织的Ktrans、Kep、Ve进行自动分析。ROI的放置原则为:①选择各区中心层面放置ROI;②放置于各分区强化最明显的区域;③ROI为圆形,面积约为20 mm2;④尽量避开外周带与中央腺体交界处、精囊根部、血管、出血或钙化灶等,在中央区放置ROI时应注意避开尿道。每个病灶重复3次ROI勾画,取3次测量的平均值。
1.4 统计学分析
采用SPSS 13.0统计软件进行统计学分析,采用两独立样本t检验比较前列腺癌组与增生组Ktrans、Kep、Ve的差异,采用直线相关性检验评价Ktrans、Kep、Ve与病理Gleason评分的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 穿刺病理结果
本研究共收集71份可用组织样本,包括38份前列腺癌和33份前列腺增生组织样本。前列腺癌患者术后Gleason评分:评分≤7分者16例,8分者11例,9分者8例,10分者3例。前列腺癌结节在T2WI上表现为外周带低信号结节,DWI上以高信号为主,动态增强扫描多表现为快进快出,呈高灌注表现(图1);前列腺增生结节在T2WI以高信号为主,DWI上呈等或稍高信号,动态增强扫描多表现为渐进性强化,强化程度无明显下降(图2)。
2.2 DCE-MRI定量分析结果

图1 77岁,前列腺癌患者,PSA值为69.5 ug/L(ng/ml),Gleason评分为7分。A:轴位T2WI,示前列腺右侧外周区及中央区低信号结节影,边界不清;B:DWI b=1000,结节呈不均匀高信号;C、D:分别为轴位DCE第11期及30期动态图像,示该结节早期强化明显,后期强化程度明显下降;E~G:分别为DCE Ktrans图、Kep图、Ve图,结节表现为高灌注,该结节定量分析指标Ktrans=0.316 min-1,Kep=0.752 min-1,Ve=0.328;H:病理图HE×100,示轻至中度异型细胞排列呈小腺管样浸润,胞浆透亮,可见核仁 图2 65岁,前列腺增生者,PSA值为6.5 ug/L(ng/ml)。A:轴位T2WI,示前列腺中央区左侧高信号结节影,边界清;B:DWI b=1000,结节呈等信号;C~D:分别为轴位DCE第16期及35期动态图像,示该结节第16期开始强化,以边缘强化为主,后期强化程度变化不明显;E~G:分别为DCE Ktrans图、Kep图、Ve图,该结节定量分析指标Ktrans=0.218 min-1n,Kep=0.504 min-1,Ve=0.307;H:病理图HE×100,示前列腺腺体、平滑肌及纤维组织增生,局部较多淋巴结细胞浸润Fig.1 Seventy-seven years old prostate cancer patient,PSA =69.5 ug/L(ng/ml),Gleason score was 7.A:The axial T2 weighted imaging,showed the low signal nodules in the right peripheral zone and central area of the prostate,with unclear boundary; B:DWI b=1000,the nodules showed non-homogeneous high signal; C—D:Axial images in the 11th phase and 30th phase of dynamic contrast-enhanced MRI,the nodule with early enhancement signifi cantly,lately the degree of enhancement decreased signifi cantly; E—G:The Ktrans,Kep and Ve chart,the nodule showed high perfusion,the nodule quantitative analysis index showed Ktrans=0.316 min-1,Kep=0.752 min-1,Ve=0.328; H:Pathology picture of HE×100,showed mild to moderate abnormal cells infi ltrated like small tube,with translucent cytoplasm,nucleolus showed mild to moderate atypia arranged in small tube like infi ltration,cytoplasm translucent,the nucleolus were visible.Fig.2 Sixty-fi ve years old prostate hyperplasia patient,PSA =6.5 ug/L(ng/ml).A:The axial T2 weighted imaging,showed the high signal nodules in the left central area of the prostate,with clear boundary; B:DWI b=1000,the nodules showed homogeneous signal; C—D:Axial images in the 16th phase and 35th phase of dynamic contrast-enhanced MRI,the edge of the nodule was enhanced in the 16th phase,and there was no obvious change in the degree of late enhancement; E—G:The Ktrans,Kep and Ve chart,the nodule quantitative analysis index showed Ktrans=0.218 min-1,Kep=0.504 min-1,Ve=0.307; H:Pathology picture of HE×100,showed prostate gland,smooth muscle and fi brous tissue hyperplasia,local lymph node cell infi ltration.
前列腺癌与前列腺增生的Ktrans、Kep、Ve值见表1。统计学分析显示前列腺癌组织的Ktrans、Kep、Ve明显高于前列腺增生,差异有统计学差异(P<0.001)。
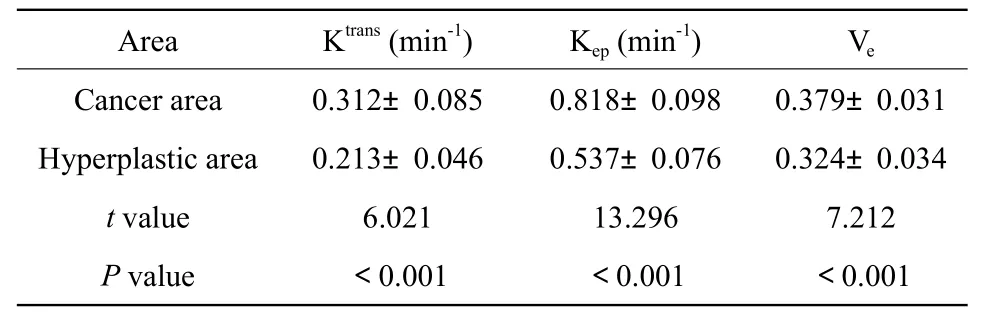
表1 前列腺癌与前列腺增生Ktrans、Kep、Ve值比较结果Tab.1 Comparison results of Ktrans,Kep and Ve values between prostate cancer and benign prostatic hyperplasia
2.3 前列腺癌区Ktrans、Kep、Ve与病理Gleason评分的相关性分析
前列腺癌区Ktrans、Kep、Ve与病理Gleason评分的相关性分析见表2。结果显示前列腺癌区的Ktrans、Kep、Ve值与Gleason评分无明显相关性。
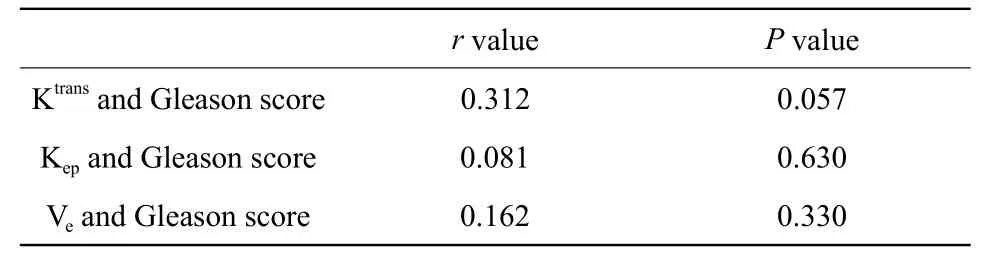
表2 前列腺癌区Ktrans、Kep、Ve值与Gleason评分直线相关分析结果Tab.2 Results of linear correlation between Ktrans,Kep,Ve and Gleason score in prostate cancer region
3 讨论
DCE-MRI通过检测人体前列腺组织的血流动力学变化,可将局部血流变化量化并进行分析,从而有效评估前列腺肿瘤微血管特性。肿瘤组织的血管生长速度与微血管的通透性密切相关[6],前列腺癌的血管生长与肿瘤的潜在生长、转移及预后都有密切关系。因此,通过DCE-MRI技术获得微血管通透性的定量指标并进行相关分析,可以实现对前列腺癌的无创诊断并评估预后。
与以往DEC-MRI侧重于通过时间-信号曲线,获取起始强化时间、强化曲线的平均和初始上升梯度、最大信号强度等数据并只能进行半定量分析相比,目前DCE-MRI定量分析则以血流动力学模型为基础,通过分析对比剂渗漏和回流以及在血管内外所占的比例,精确、可重复的测量肿瘤微血管生理解剖及功能。排除了以往方法中诸如信号强度不稳、受心输出量及对比剂注射速度影响等干扰因素。准确地反映组织内对比剂浓度变化和组织生理学信息,实现对肿瘤生理的准确评估。
本研究中的主要测量参数为:转运常数Ktrans、速率常数Kep、细胞外间隙分数Ve,均与肿瘤组织血管通透性、血液灌注和血管容积等基本生理特征相关,并且可以应用药代动力学模型从DCE-MRI数据中得出。其中,Ktrans是指对比剂分子从血管内向血管外细胞间隙的通过率,反映对比剂分子通过血管壁的能力大小;Kep指渗漏到血管外细胞间隙的对比剂分子流回血管内的速率,反映对比剂在细胞外间隙的平均驻留时间;Ve则是血管外细胞外间隙内对比剂的容积分数[7]。本研究通过DCE-MRI定量分析发现前列腺癌组织的各指标Ktrans、Kep、Ve均明显高于前列腺增生。前列腺癌组织中的微血管生成速度较前列腺增生更快,并且由于癌组织代谢旺盛,单位体积癌组织的血管密度较正常组织更高,而由于新生血管的内皮细胞间隙较正常血管内皮细胞间隙大,因此新生血管具有更大的渗透性[8]。Ktrans、Kep是反映组织微血管密度和渗漏的指标[9],因而前列腺癌组织的Ktrans、Kep较前列腺增生高,此结果与多数文献报道一致[10-11]。以往研究分歧较大的是关于Ve值的结果,有研究认为癌区与增生区的Ve值无明显统计学差异[1],也有研究认为癌灶的Ktrans、Kep、Ve参数高于增生组织[12]。本研究发现前列腺癌组织的Ve值较前列腺增生组织高,原因考虑为由于肿瘤组织代谢旺盛,新生毛细血管壁不完整,肿瘤血管具有较大的通透性,同时由于肿瘤组织较正常组织有较大的细胞外间隙,血管内外以及血浆与细胞外间隙间的对比剂浓度的差别促使对比剂通过血管壁进行转移,导致血管外细胞外间隙内对比剂增多,因此Ve值升高。该结论与Cornud等人[12]研究结果相似。
目前关于DCE-MRI与Gleason评分相关性的研究还未得出一致的结论[13]。Gleason评分是评估前列腺癌侵袭性的病理学标准,是预后评估最有意义的指标 。Gleason评分总共分为5级,1级表示肿瘤组织结构分化最好,预后最好;5级表示肿瘤组织结构分化最差,预后最差;级别随着组织结构分化程度及预后变差而升高。Gleason评分=主要结构类型(分级)+次要结构类型(分级),主要结构类型为癌区最常见的类型,次要结构类型为癌区第二常见的类型并且要求占标本的5% 以上。如果癌区只有一种结构类型,则认为其主要结构类型分级与次要结构类型一致,Gleason评分为两种结构类型相加,范围为2~10分[8]。
前列腺癌的分期和预后与肿瘤微血管密度密切相关。肿瘤组织分化程度越差,组织细胞的异型性越大,细胞增殖就越快,新生微血管越多,组织灌注及毛细血管通透性则升高。相关性研究表现前列腺癌的Gleason评分越高,其Ktrans值越大[14]。本组研究结果显示前列腺癌区的Ktrans、Kep、Ve与Gleason评分无明显相关性。分析原因可能有以下几点:(1)本研究样本量较少,Gleason评分分布较集中,高Gleason评分的病例相对较少,可能会使结果产生偏倚;(2)由于前列腺癌组织的多样性,缺乏对组织主要、次要结构级别的细致分类,只是主要、次要结构级别的简单相加,忽略了主要、次要结构各自对肿瘤侵袭性的影响;(3)缺乏根治术后大切片的病理标本,本研究中多数病例是由穿刺活检取得的结果,而穿刺活检的结果与根治术大切片病理结果的Gleason评分往往不一致;此外穿刺活检可能会遗漏前列腺尖部的病变及早期体积较微小的病灶[15],从而会导致病理结果的假阴性。
综上所述,DCE-MRI定量分析指标对前列腺癌与前列腺增生的鉴别诊断具有重要价值,为预测肿瘤的恶性程度和预后提供有意义的信息。而定量分析指标与前列腺癌Gleason评分的关系还需扩大样本进一步研究。
[References]
[1]Jing GD,Wang J,Chen LG,et al.3.0 T dynamic contrast-enhanced MRI in clinical diagnosis of prostate cancer.Radiol Practice,2014,29(5):482-486.景国东,汪剑,陈录广,等.3.0 T动态增强MRI在前列腺癌诊断中的价值.放射学实践,2014,29(5):482-486.
[2]Shimizu T,Nishie A,Ro T,et al.Prostate cancer detection:the value of performing an MRI before a biopsy.Acta Radiol,2009,50(9):1080-1088.
[3]Zhang XQ,Wang XY,Lu J,et al.MR imaging of incidentally detected prostate carcinoma in the central gland of prostate:preliminary study.Chin J Magn Reson Imaging,2010,1(4):264-267.张学琴,王霄英,陆健,等.前列腺中央腺体偶发癌的MRI初步研究.磁共振成像,2010,1(4):264-267.
[4]Zhang N,Chen M,Liu X.Functional magnetic resonance imaging in early noninvasive diagnosis of prostate cancer.Chin J Magn Reson Imaging,2010,1(4):313-316.张娜,陈敏,刘新.功能磁共振成像无创性诊断前列腺癌的研究进展.磁共振成像,2010,1(4):313-316.
[5]Jackson AS,Reinsberg SA,Sohaib SA.Dynamic contrastenhanced MRI for prostate cancer localization.Br J Radiol,2009,82(974):148-156.
[6]Kim JK,Hong SS,Choi YJ,et al.Wash-in rate on the basis of dynamic contrast-enhanced MRI:usefulness for prostate cancer detection and localization.J Magn Reson Imaging,2005,22(5):639-646.
[7]Bonekamp D,Macura KJ,Russell H.Dynamic contrast-enhanced magnetic resonance imaging in the evaluation of the prostate.Topic in Magnetic Resonance Imaging,2008,19(6):273-284.
[8]Kozlowski P,Chang SD,Meng R,et al.Combined prostate diffusion tensor imaging and dynamic contrast enhanced MRI at 3T-quantitative correlation with biopsy.J Magn Reson Imaging,2010,28(5):621-628.
[9]van Niekerk CG,van der Laak JA,Hambrock T,et al.Correlation between dynamic contrast-enhanced MRI and quantitative histopathologic microvascular parametersin organ-confined prostate cancer.Eur Radiol,2014,24(10):2597-2605.
[10]Langer DL,van der Kwast TH,Evans AJ,et al.Prostate cancer detection with multi-parametric MRI:logistic regression analysis of quantitative T2,diffusion-weighted imaging,and dynamic contrastenhanced MRI.J Magn Reson Imaging,2009,30(2):327-334.
[11]Jackson AS,Reinsberg SA,Sohaib SA,et al.Dynamic contrasterdamaced MRI for prostate cancer locatation.Br J Radiol,2009,82(974):148-156.
[12]Cornud F,Beuvon F,Thevenin F,et al.Quantitative dynamic MRI and localization of non-palpable prostate cancer.Prof Urol,2009,19:401-413.
[13]Engelbrecht MR,Huisman HJ,Laheij RJ,et al.Discrimination of protate cancer from normal peripheral zone and central glandtissue by using dynamic contrast-enhanced MR imaging.Radiology,2003,229(1):248-254.
[14]Wang L,Mazaheri Y,Zhang J,et al.Assessment of biologic aggressiveness of prostate cancer:correlation of MR signal intensity with Gleason grade after radical prostatectomy.Radiology,2008,246(1):168-176.
[15]Bigler SA,Deering RE,Brawer MR.Comparison of microscoric vascularity in benign and malignant prostate tissue.Hum pathol,1993,24(2):220-226.
