反相高效液相色谱法测定血液中去甲万古霉素浓度的研究
2015-12-13李顺炜袁孔现詹三华
李顺炜,袁孔现,朱 虹,詹三华
(铜陵市人民医院药剂科,安徽铜陵 244000)
反相高效液相色谱法(reversed phase high-performance liquid chromatography,RP-HPLC)是由非极性固定相和极性流动相组成的液相色谱体系[1],十八烷基键合硅胶为典型固定相,甲醇和乙腈则为典型流动相。RP-HPLC作为液相色谱的主要分离模式,几乎可分离测定所有能溶于极性或弱极性溶剂中的有机物。
去甲万古霉素(Norvancomycin)为糖肽类抗感染药物,为快效杀菌剂,抑制细菌细胞壁糖肽聚合物的合成,进而妨碍细胞壁的形成。临床上主要用于重症感染患者的治疗,对金黄色葡萄球菌、表皮葡萄球菌和肺炎链球菌等有较强的抗菌作用[2]。由于其抗感染治疗作用显著,存在不合理使用的可能,需要加强对该类药物的使用监管[3]。因其具有明确的耳、肾毒性[4],使用时除需严格控制适应证外,用药剂量亦需个体化设计[5],有条件的要进行药物浓度监测(TDM)。本文通过查阅文献[6-8],并根据现有条件,建立了一种快速测定去甲万古霉素血药浓度的方法,血液取样量少,操作简单、快速,灵敏度和准确度较高,适用于临床进行药物浓度监测和个体化给药。
1 仪器与试药
1.1 仪器 LC-20AD系列高效液相色谱仪,包括LC-20AD输液泵、SPD-20AV型 UV/VIS检测器,CTO-20A型柱温箱、LC solution色谱工作站和CBM-20Alite系统控制器(日本岛津制作所)。SIGMA高速离心机和MDF-382E超低温冰箱(日本三洋电机生物医学有限公司)。
1.2 试药 去甲万古霉素标准品(中国药品生物制品检定所,批号130338-200303),替硝唑对照品(中国药品生物制品检定所,批号100336-200402)、甲硝唑对照品(中国药品生物制品检定所,批号0191-9804)。甲醇(色谱纯,美国 Tedia公司,批号001916)、乙腈(色谱纯,美国 Tedia公司,批号1108469)。特级新生牛血清(中美合资兰州民海生物工程有限公司,批号20100310)。高氯酸、磷酸、磷酸二氢钾、尿素为分析纯。纯化水为本实验室自制亚沸蒸馏水。
2 方法与结果
2.1 色谱条件 色谱分析使用Kromasil C18柱(150 mm×4.6 mm,5μm),流动相组成为甲醇—乙腈—40 mmol·L-1KH2PO4缓冲液(含 0.1% 磷酸)=15∶5∶80(v/v),进样量为 20 μL,流速为 1.0 mL·min-1,柱温35℃,紫外检测波长236 nm。灵敏度AUFs=0.02,以峰面积、内标法定量。
2.2 流动相和过渡相的配制 精密称取KH2PO4(分析纯)5.44 g,加入1 000 mL 纯化水、1.0 mL 磷酸混匀,配制成40 mmol·L-1KH2PO4溶液。取800 mL KH2PO4溶液,与150 mL甲醇(色谱纯)、50 mL乙腈(色谱纯)混匀,经0.45μm微孔滤膜过滤,脱气5 min,即配制成流动相。过渡相使用甲醇-纯化水(20∶80,v/v)。
2.3 标准溶液、沉淀剂及助溶剂的配制 将去甲万古霉素标准品和替硝唑标准品置于105℃烘箱中干燥2 h。精密称取100.0 mg去甲万古霉素标准品,以2%尿素溶液定容至100 mL并摇匀,配制成1 000.0 mg·L-1标准贮备液。精密称取 20.0 mg替硝唑标准品,以纯化水定容至100 mL摇匀,配制成200 mg·L-1内标液。取15 mL高氯酸加纯化水至100 mL,配制成15%高氯酸溶液作为沉淀剂。称取20 g尿素加纯化水至100 mL,配制成20%尿素溶液作为助溶剂。以上所有配制溶液均放置于4℃冰箱中保存备用。
2.4 血样处理 取血清200μL,加入内标液20μL后涡旋混匀,再加入20%尿素溶液和沉淀剂各100 μL,涡旋混匀1 min后,经14 800 rpm高速离心8 min,取上清液20μL进样,记录色谱图,见图1。
2.5 标准曲线绘制 取去甲万古霉素标准储备液,用2%尿素溶液分别稀释成浓度为20.0、40.0、80.0、160.0、320.0、640.0 mg·L-1标准溶液备用。取新生牛血清200μL置于离心管中,分别加入上述不同浓度标准溶液各50μL,混匀,使其浓度分别为5.0、10.0、20.0、40.0、80.0、160.0 mg·L-1。按“2.4”项下操作,以替硝唑为内标,每一浓度平行3份,以样品的峰面积计算其实际测算值。计算结果取平均值(Y)对去甲万古霉素理论浓度(X)作线性回归,得回归方程为 Y=0.963 1X+0.068 2,r=0.996 8(n=6)。以信噪比(S/N)≥3计算最低检测限为 2.5 mg·L-1。
2.6 回收率与精密度 制备去甲万古霉素浓度分别为 5.0、20.0、80.0 mg·L-1的血清样品,照“2.4”项下操作,每种浓度一天内分别进样5次,用标准曲线方程带入所测得样品峰面积,计算血清浓度,用实测浓度和样品浓度的比值表示方法回收率,计算RSD,得日内差异。每日测定1次,连续测定5 d,计算RSD,得日间差异,结果见表1。
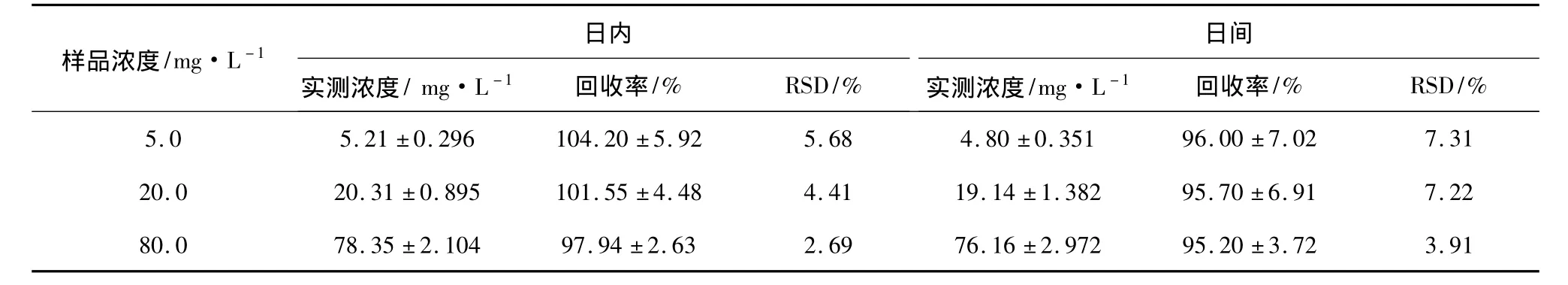
表1 回收率和精密度实验结果(n=5)
2.7 稳定性考察 配制含去甲万古霉素5.0、20.0、80.0 mg·L-1三种浓度血清质控样品,分别在室温下放置4 h,在-40℃冻融 1次、2次,以及-40℃冷冻1周、1个月的条件下,按“2.4”项下操作,每一浓度平行5次,计算各种条件下的实测值和RSD,考察其稳定性。考察结果RSD<10%,证明该方法完全符合去甲万古霉素常规血药浓度监测的要求,结果见表2。

表2 稳定性考察(n=5)
2.8 干扰试验 考虑临床普遍存在合并用药的实际情况,试验考察了常用的头孢哌酮、阿奇霉素、左氧氟沙星等抗感染药物,抗真菌药氟康唑以及泼尼松、甲泼尼龙、地塞米松等激素类药物对去甲万古霉素色谱行为的影响,均未发现上述药物对样品色谱峰有明显干扰,满足常规血药浓度监测要求。
2.9 临床应用 随机抽取我院已持续规范使用去甲万古霉素至少3 d的在院患者,分别于用药前和用药后10 min内各抽样一次,以用药前血样为谷浓度样本,用药后10 min内血样为峰浓度样本[9],按“2.4”项下操作,测得去甲万古霉素浓度结果见表3,所测结果符合临床实际。

表3 患者去甲万古霉素血药浓度监测结果
3 讨论
本实验过程中在使用流动相前后用过渡相低压灌注以防止流动相中的KH2PO4在回路和色谱柱中析出。
尿素对去甲万古霉素有助溶作用。使用2%尿素水溶液溶解去甲万古霉素保证标准溶液稳定,血样处理时加入20%尿素助溶可以提高万古霉素的响应值。
[6],含去甲万古霉素的血样处理都用沉淀蛋白——离心法,所用沉淀剂有硫酸锌、高氯酸[7-8],本试验采用15%高氯酸作为沉淀剂,加入助溶剂后高速离心,抽取上清液进样。使用15%高氯酸可以充分沉淀血清中蛋白质,满足实验要求。
文献报道[6-7]使用万古霉素和去甲万古霉素互为内标检测两者浓度,在实验过程中我们发现这两者出峰位置较近,难以严格区分,且药品去甲万古霉素中一般都含有少量万古霉素[10],使用万古霉素作为内标检测去甲万古霉素血药浓度容易出现较大误差。本实验内标物替硝唑,与受试药物去甲万古霉素可完全分离,两者完全无干扰。考虑到上述两药合并使用的可能性,检测去甲万古霉素血药浓度时必须明确患者是否同时使用替硝唑,否则测定结果会出现较大偏差。在患者并用去甲万古霉素和替硝唑的前提下,可换用甲硝唑代替替硝唑为内标物。试验证明去甲万古霉素与甲硝唑、替硝唑三者分离良好,均无干扰。
去甲万古霉素有效血药浓度谷、峰值参照万古霉素有效血药浓度谷、峰值设定[11]。为确保去甲万古霉素抗感染治疗的有效性和安全性,避免产生不良反应,尤其是耳、肾毒性的发生与去甲万古霉素的血药浓度过高密切相关,临床应用时可依据监测血药浓度并及时调整用药剂量以避免器官损害风险。特别是对于长期使用的患者、出生低体重儿、新生儿和幼儿,与可引起肾脏及听力损害的药物(如庆大霉素、链霉素、两性霉素B)[12]联用的患者。
去甲万古霉素抗菌活性近似于万古霉素,合适的血药浓度对于敏感细菌有较好的抑制、杀灭作用,可替代万古霉素用于当其他药物如青霉素或患者不能耐受的严重葡萄球菌或其他革兰阳性菌感染,特别是用于耐甲氧西林金黄色葡萄球菌(MRSA)的感染。去甲万古霉素长期使用时峰浓度不宜超过 30~40 mg·L-1,谷浓度需要 10~15 mg·L-1,治疗低敏感性MRSA感染时谷浓度可保持 15 ~20 mg·L-1[13]。去甲万古霉素存在一定程度的暴露-耳、肾毒性,当用药后出现血清肌酐升高可定义为肾脏毒性,由于密集用药会增加肾脏毒性,为治疗MRSA感染而使用高剂量去甲万古霉素时需格外关注;使用去甲万古霉素时需作听力监测,特别是高危患者,出现耳鸣时应立即停用去甲万古霉素。
参考文献:
[1]Amitava Dasgupta原著,陆 林主译.药物监测方法:治疗性用药与药物滥用[M].北京:人民卫生出版社,2011:44.
[2]李信胜,黄 丽,沈世红,等.重症医学科患者医院获得性感染的病原菌分布及耐药性分析[J].安徽医药,2013,17(9):1606-1608.
[3]李培芳,方 焱,翟 飞.某三甲医院2011年抗菌药物临床应用专项整治活动效果[J].安徽医药,2013,17(4):691-693.
[4]毛 璐,李 锦.去甲万古霉素与万古霉素不良反应分析[J].中国医药,2014,9(1):121-123.
[5]万古霉素临床应用剂量专家组.万古霉素临床应用剂量中国专家共识[J].中华传染病杂志,2012,30(11):641-646.
[6]黄晓会,刘 艳,张 健.HPLC法测定人血清中万古霉素及去甲万古霉素浓度及临床应用[J].中国药物应用与监测,2014,11(2):92-94.
[7]张华峰,宋 青,戴 博,等.高效液相色谱法测定人血浆中万古霉素和去甲万古霉素的浓度[J].解放军药学学报,2011,27(2):66-68.
[8]裔照国,季宏建.人血浆中去甲万古霉素质量的HPLC法检测[J].抗感染药学,2011,8(1):36-38.
[9]翁心华,黄仲义,中国新药与临床杂志编辑部,等.万古霉素临床应用中国专家共识(2011版)[J].中国新药与临床杂志,2011,30(8):561-573.
[10]陈新谦,金有豫,汤 光 主编.新编药物学[M].17版.北京:人民卫生出版社,2011:85.
[11]汪宝军,胡庭杰.HPLC法测定人血清中去甲万古霉素浓度[J].齐鲁药事,2011,30(8):468-470.
[12]四川美康医药软件研究开发有限公司编著.药物临床信息参考[M].重庆:重庆出版社,2008:194.
[13]斯威曼SC(Sean C Sweetman)编,李大魁,金有豫,杨 光,等译.马丁代尔药物大典(原著第37版)[M].北京:化学工业版社,2013:339.
