类风湿性关节炎痰瘀积分与炎症因子相关性研究※
2015-12-09叶锦夏陈进春邱明山
●叶锦夏 陈进春 邱明山
类风湿性关节炎(Rheumatoid Arthritis,RA)是一种临床常见的以累及周围关节为主的慢性多系统炎症性自身免疫性疾病。炎症反应与其发生、发展有密切关系。其中TNF-α可促进骨吸收,并可导致骨质破坏,抑制骨胶原的合成,总效应为导致滑膜炎症反应﹑促进软骨基质的崩解。IL-1可间接刺激破骨细胞的形成并调节破骨细胞的功能。IL-6可通过增强IL-1和TNF-α的炎症效应加重RA的致病作用。CRP、ESR在炎症、感染时明显升高,由于类风湿性关节炎为慢性炎症病变,故常用CRP、ESR反映类风湿疾病活动情况。
本病属中医学“痹证”范畴,目前认为正气不足是本病发生的内在因素,痰浊瘀血痹阻经络为其主要病机。痹证初始感受外邪,机体气血运行受阻,血脉不畅,凝滞于内,继而气滞血瘀而产生瘀血,而瘀血又可作为病理产物进一步留滞机体,闭阻经脉,影响气血运行,成为痹症的一个致病因素。而痰浊是水液输布障碍,水湿内停,留滞机体而成。湿邪为酿生痰浊的一个主要原因,不论外感湿邪,抑或是脾虛生湿,湿邪日久皆易聚而成痰。瘀血、痰浊不仅为病因,且为病理产物,循环往复,最终造成痰瘀互结,胶着骨骱,痹阻经络,是RA发病的重要病理机制[1]。
本研究拟对RA患者痰瘀积分及炎症指标进行检测,并对其在发病机制中作用进行初探性研究,以期更好地为中医治疗提供较为客观的理论依据,充分挖掘中医在RA防治中的优势。
1 资料与方法
1.1 研究对象 本研究共收集85例类风湿性关节炎患者,均来源于2013年12月~2014年12月厦门市中医院风湿肾病科门诊及住院患者,其中痰瘀组43人,非痰瘀组42人。
1.2 诊断标准
1.2.1 西医诊断标准 参照2009年美国风湿病学院(ACR)和欧洲风湿病防治联合会(EULAR)联合重新制定诊断标准,即评分≥6.0分的患者明确诊断为类风湿性关节炎。(1)受累关节:1个中到大的关节(0分);2~10个中大关节(1分);1~3个小关节(2分);4~10个小关节(3分);超过10个,其中至少1个为小关节(5分)。(2)血清学:类风湿因子和抗环瓜氨酸肽抗体阴性(0分);两个测试至少有1项低滴度阳性。低滴度定义为超过正常上限,但不高于3倍正常值上限(2分);至少有一项高滴度阳性,如滴度超过3倍正常上限(3分)。(3)滑膜炎持续时间少于6周(0分);6周或更长的时间(1分)。(4)急性期反应物c-反应蛋白和红细胞沉降率均正常(0分);c反应蛋白或血沉高于正常(1分)。
1.2.2 中医诊断及辨证标准 参照《中药新药临床研究指导原则》中关于RA“中医证候诊断标准”以及所确定的瘀血痹阻证的辨证标准[2],并参照《实用中医风湿病学》中痰瘀痹阻证的诊断要点所制定的痰瘀痹阻证的评分标准[3],见表1。

表1 痰瘀痹阻证评分标准
1.3 纳入标准 (1)符合上述西医诊断标准和中医证型诊断标准的RA患者;(2)年龄在18~70岁;(3)签署知情同意书者。
1.4 排除标准 (1)合并多器官严重疾病的患者;(2)重叠其它风湿免疫系统疾病的患者;(3)孕妇或者哺乳期女性患者;(4)精神病患者。
1.5 方法 (1)采集患者的一般临床资料如性别、年龄、病程等;(2)由具有丰富临床经验的风湿免疫专业副主任中医师以上人员判定中医临床证型;(3)记录相关数据:CRP、ESR、IL -1、IL-6、TNF - α。其中CRP检测采用免疫速率散射比浊法自动测定,ESR检测采用全自动动态血沉分析仪用魏氏法测定,IL-1、IL-6及TNF-α采用Elisa方法检测。
1.6 统计学分析 采用SPSS17.0软件进行统计分析;计数资料采用卡方检验;计量资料先行正态性检验与方差齐性检验。若呈正态分布,采用t检验;若不符合正态分布,则采用数据变换或秩和检验。
2 结果
2.1 RA患者一般临床资料分析 本次研究共收集类风湿性关节炎病例85例,痰瘀痹阻型43例,男性11例,女性32例,年龄24~68岁,病程0.5~22年,非痰瘀痹阻型42例,男性8例,女性34例,年龄18~70岁,病程1~21年。两组患者在性别、年龄、病程上经统计学分析,P>0.05,差异无统计学意义,说明两组间具有可比性。见表2。
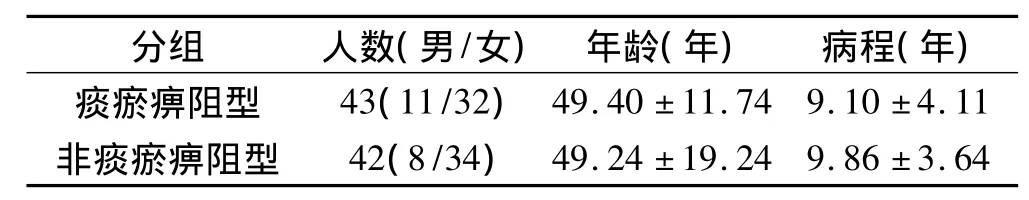
表2 RA患者一般临床资料分析
2.2 痰瘀积分与炎症因子相关分析 见图1~5。
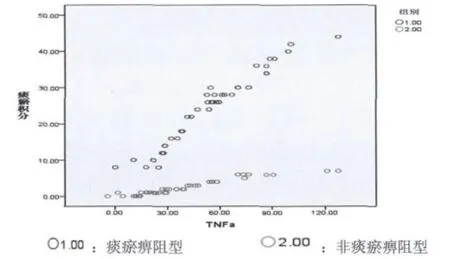
图1 痰瘀积分与TNF-α相关分析
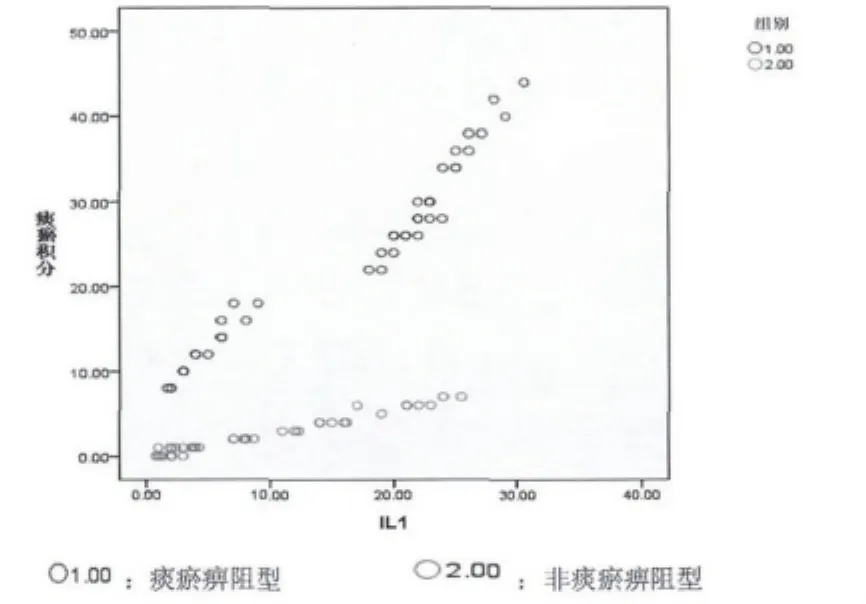
图2 痰瘀积分与IL-1相关分析
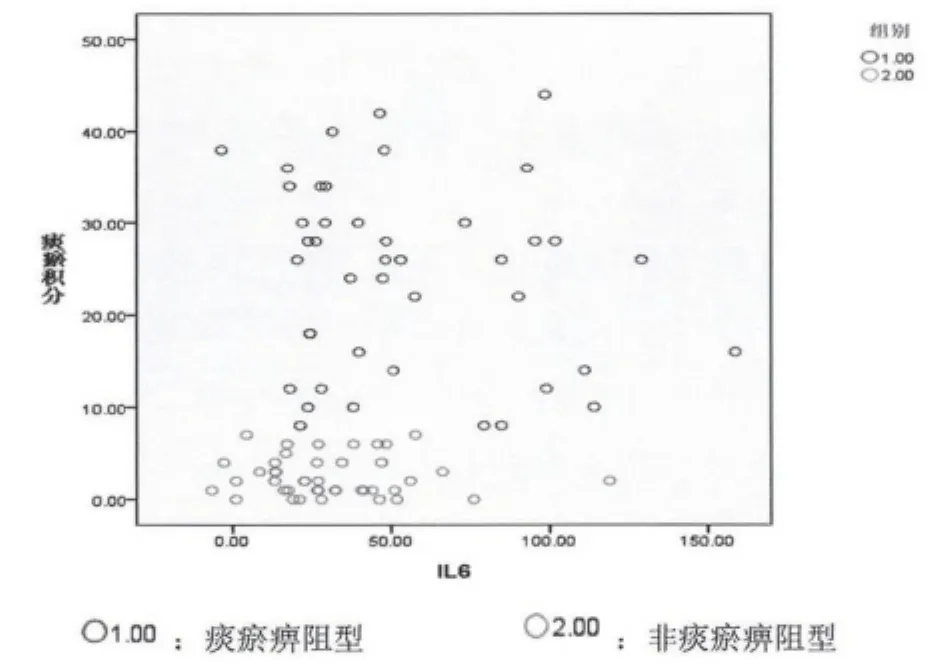
图3 痰瘀积分与IL-6相关分析
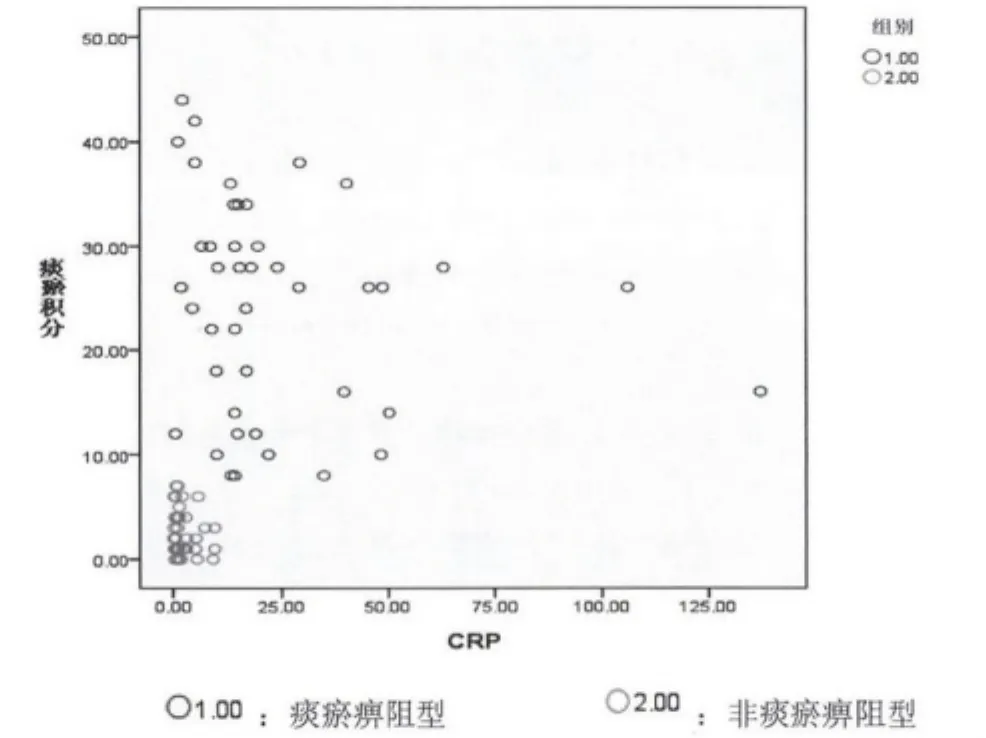
图4 痰瘀积分与CRP相关分析
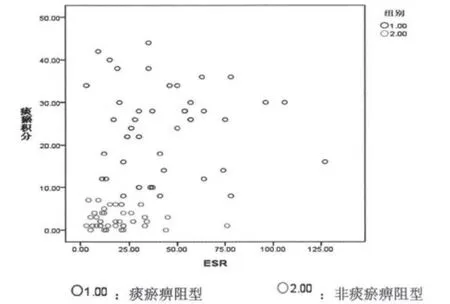
图5 痰瘀积分与ESR相关分析
3 讨论
类风湿性关节炎是一种慢性全身性炎症性疾病,属于自身免疫炎性疾病范畴[4]。炎症因子是由多种细胞分泌的具有生物活性小蛋白物质的总称,许多细胞因子已被公认为是类风湿性关节炎关节损伤的重要介质,这些炎症因子参与类风湿性关节炎的发生发展整个病理过程。其中TNF-α和RA关系最为密切,是一种在RA发病过程中居核心地位的促炎症性细胞因子[5]。人TNF-α基因定位在染色体6q21.3区域,与主要组织相容性抗原复合体III类基因(MHC-III)紧密连锁,所编码的前体蛋白含233个氨基酸,主要由活化的巨噬细胞分泌,其与受体结合发挥作用。在RA中的炎症因子调控、成纤维样滑膜细胞的增殖以及骨损伤过程中均有重要作用。TNF-α能刺激滑膜纤维母细胞和软骨细胞产生前列腺素E2(PGE2)和胶原酶,PGE2可通过G蛋白-腺苷酸环化酶-环磷酸腺苷信号通路发挥作用,促进骨质破坏和骨的吸收以及纤维母细胞增生,从而抑制骨胶原的合成,导致滑膜炎症反应﹑软骨基质的崩解[6]。TNF-α通过核因子NF-κB途径促进软骨细胞分泌纤维蛋白溶酶原激活剂,使纤维蛋白溶酶原转换成纤维蛋白溶酶而降解纤维蛋白,促进胶原的分解代谢,加快关节的损伤。故TNF-α可通过多种途径介导类风湿性关节炎骨破坏和损伤[7]。此外,TNF-α可以调控类风湿性关节炎中炎症因子的生成,相关报导指出,IL-1、IL-6以及IL-8等细胞因子的产生均具有TNF-α依赖性。IL-1是Th17细胞分泌的细胞炎症因子,可诱导急性期炎症反应。在类风湿性关节炎中,它可从多方面激活血管内皮细胞,从而增加内皮细胞黏附分子表达。在关节炎时,IL-1与黏附分子相互作用而被汇集到关节内,加重免疫性炎性反应,并可通过诱导成骨细胞和其他细胞产生核因子B受体活化因子配体间接影响成骨细胞的生成;同时还能通过作用于细胞c-Src和肿瘤坏死因子受体相关因子6调控破骨细胞的功能[8]。IL-1亦是骨质吸收和骨质破坏的主要细胞因子之一,可通过刺激破骨细胞形成,也可以直接刺激成熟的破骨细胞发挥作用,直接作用于炎性部位,诱导组织破坏和其持续性细胞浸润,主要作用于软骨、软骨下骨、肌腱和韧带,最终致关节的炎性破坏,甚至功能障碍[9]。IL-6是由T细胞、单核细胞及成纤维细胞等产生的糖蛋白,其在类风湿性关节炎的发生、发展中起以下作用:(1)促进活化B细胞增殖,并分化为Ig分泌细胞;(2)能诱导肝细胞分泌急性相蛋白,促进Ig的合成;(3)可能调节成纤维细胞的增殖。CRP是一种主要由肝脏合成炎症反应的急性时相反应蛋白,机体在炎症感染、组织损伤、恶性肿瘤、重病肝炎时明显升高,由于类风湿性关节炎是慢性炎症病变呈持续、反复发作的过程,在类风湿性关节炎的实验室诊断常用RF、ESR等,CRP测定较ESR更能反映类风湿疾病活动情况[10]。TNF-α与多种病情活动指标相关,血清和滑液中TNF-α水平与类风湿因子滴度、血沉和C反应蛋白成正相关关系[11]。上述多种炎症因子是反应炎症程度的主要指标,在类风湿性关节炎早期和活动期明显升高,也是最终评价类风湿性关节炎活动期的主要指标。炎症因子组成一个炎症因子系统,作用于骨关节,最终导致了骨骼影像学改变。
近年来随着对类风湿性关节炎病因、病机的认识不断深入,“痰瘀致痹”学说也越来越受到重视。娄多峰教授等就指出“邪”、“瘀”在痹病中的发病作用,尤其强调“瘀”的作用[12]。朱良春教授认为类风湿性关节炎患者病机为病邪乘虚袭踞经隧,气血为邪所阻,阻滞经脉,留滞于内,深入骨骸,胶着不去,痰瘀交阻,凝涩不通,尤其强调痰瘀互阻为本病病机[1]。朱孟铸等强调痰瘀流注关节、肌肉,闭阻经脉,经脉运行不畅,关节肌肉出现红、肿、热、痛、麻木、屈伸不利等,痰瘀既是类风湿性关节炎的病理产物,也是致病因素[13]。谢海洲认为因脾虚生内湿,久生痰浊,血虚生内风,阴虚生内热,阳虚生内寒,气虚生瘀血,痰浊、瘀血从内而生,留滞经脉,停滞关节,痹从内生[14]。唐先平认为瘀血、痰浊不仅为各种原因所致的病理产物,而且又作为病因重新作用于机体,往复循环,而造成痰瘀互结,胶着骨骱,痹阻经络,是RA发病的重要病理机制[15]。笔者总结多年治疗类风湿关节炎经验,认为痰瘀在本病的发生发展起重要作用。邪痹经脉,经脉阻滞,影响气血津液运行输布,津停为痰,血滞为瘀,且闽南地区地处沿海,气候潮湿,居民喜食膏粱厚味,易生痰湿,最终致痰浊瘀血阻痹经络,病程缠绵,顽固不愈。本病无论新久皆可生痰致瘀,针对病机特点,从涤痰、化瘀入手,辨证论治,可以起到事半功倍的效果。
本次试验共收集RA病例85例,男性19例,女性66例,男女比例为1∶3.47,与流行病学统计类风湿性关节炎发病男女比例为1∶3相符合。祖国医学认为痹证主要病机为痰瘀痹阻,特别是厦门地处沿海,气候潮湿,居民喜食膏粱厚味,易生痰湿,最终致痰浊瘀血痹阻经络,故本研究将痹证分为痰瘀痹阻型及非痰瘀痹阻型。研究显示,不论是痰瘀痹阻型或非痰瘀痹阻型痰瘀积分与 TNF- α、IL-1、IL -6、CRP、ESR 均显著相关,提示痰瘀贯穿于痹证始终,且与炎症水平呈显著正相关。
本次研究由于试验时间和项目经费所限,未能进一步探讨TNF-α、IL-1、IL-6信号转导通路,待条件允许的情况下,可增加研究的样本量及NF-KappaB、ERK等信号转导通路相关指标,以进一步明确炎症因子的作用机理。
[1]朱良春.朱良春医集[M].中南大学出版社,2006,9:108 -111.
[2]郑筱萸主编.中药新药临床研究指导原则(试行)[M].中国医药科技出社,2002:116 -117.
[3]王承德主编.实用中医风湿病学(第2版)[M].北京:人民卫生出版社,2009:254.
[4]叶任高,陆再英.内科学[M].7版.北京人民卫生出版社,2007:56.
[5]Cvetkovic JT,Wallberg Jonsson,Stegmayr B,et al.Susceptibility for and clinical manifestations of rheumatoid arthritis are associated with polymorphisms of the TNF - α,IL -1β and IL -1 Ra genes[J].J Rheumatol,2002,29(2):212-219.
[6]陈如平,王昌兴,王伟东.类风湿性关节炎中肿瘤坏死因子的表达及意义[J].医学综述.2011,05:647 -649.
[7]QUIRKE A M,FISHER B A,KINLOCH A J,et al.Citrullination of autoantigens:upstream of TNFalpha in the pathogenesis of rheumatoid arthritis[J].FEBS letters,2011,585(23):3681 -3688.
[8]Nakamura I,Kadono Y,Takayanagi H,et al.IL - 1 regulates cytoskeletal organization in osteoclasts via TNF receptor-associated factor 6/c- Src complex.J Immunol 2009,168(10),5103-9.
[9]董 怡,张卓莉.白细胞介素-1家族在类风湿关节炎和骨关节炎中的作用[J].中华风湿病学杂志,2004,8(5):257 -258.
[10]Mallya R.Correlation of clinical parameters of disease activity in rheumatoid arthritis with serum concentration of C-reaction protein and erythrocyte sedimentation rate.J Rheumat ol,2009,9:224.
[11]Glossop JR,Dawes PT,Nixon NB.Polymorphism in the tumour necrosis factor receptor II gene is associated with circulating levels of soluble tumour necrosis factorreceptors in rheumatoid arthritis[J].Arthritis Res T-her,2005,7(6):R1227 -R1234.
[12]李满意,娄玉钤,杨林江.类多峰教授治疗类凤湿关节炎经验总结[J].风湿病与关节炎,2013,07:45 -50.
[13]朱孟铸,王喻飞.从痰瘀论治类风湿性关节炎的临床研究[J].山东医学高等专科学校学报,2013,(4):102.
[14]谢海洲.谢海洲医学文集[J].北京:中医古籍出版社,2004:316.
[15]唐先平.“痰瘀相关”与类风湿性关节炎[J].中华中医药杂志,2005,20(3):173.
