丙泊酚对帕金森小鼠黑质多巴胺能神经元凋亡的影响
2015-12-08余志阳潘士勇刘清珍陈春龙李伟彦朱四海
余志阳,潘士勇,刘清珍,刘 健,陈春龙,李伟彦,朱四海
帕金森病(Parkinson's disease,PD)是以中脑黑质多巴胺能神经元进行性变性、缺失,导致黑质纹状体多巴胺能神经系统失调而引发的中枢神经系统退行性疾病[1]。PD的发病机理复杂,“氧化应激伤学说”得到公认,即自由基通过氧化神经膜类脂、破坏多巴胺能神经元膜功能或直接破坏细胞DNA,最终导致多巴胺能神经元的凋亡[2-3]。目前丙泊酚脑保护研究多限于缺血再灌注后或缺血再灌注预处理方面[4-5],而关于丙泊酚对PD患者多巴胺能神经元凋亡的影响较少研究。本研究通过小鼠腹腔注射1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)构建 PD 模型、丙泊酚干预、检测黑质中相关蛋白表达水平,测定凋亡细胞,探讨丙泊酚对PD小鼠多巴胺能神经元凋亡的影响。
1 材料与方法
1.1 实验动物 经南京军区南京总医院动物医学伦理会批准,健康雄性C57BL6小鼠48只,体重25~30 g,出生36~40周,由南京军区南京总医院动物实验中心提供。饲养条件:维持室温(25±2)℃,人工昼夜循环光照节律(12~12 h),自由进食及饮水。
1.2 方法
1.2.1 动物分组及模型制备 C57BL6雄性小鼠48只,实验动物随机分为6组。Ⅰ组(n=8):腹腔注射等渗盐水3 mL/kg,1次/d,连续5 d。Ⅱ组(n=8):腹腔注射 MPTP(Sigma,USA)30 mg/kg,1 次/d,连续5 d。Ⅲ组(n=8):最后一次注射MPTP后2 h,腹腔注射脂肪乳(Sino-Swed Pharmaceutical Corp,China)10 mL/kg。Ⅳ组(n=8):最后一次注射MPTP后24 h,腹腔注射脂肪乳10 mL/kg。Ⅴ组(n=8):最后一次注射MPTP后2 h腹腔注射丙泊酚(Astrazeneca,Italy)100 mg/kg。Ⅵ组(n=8):最后一次注射MPTP后24 h腹腔注射丙泊酚100 mg/kg。
1.2.2 标本采集 最后一次腹腔注射药物后12 h将每组4只小鼠麻醉,经左心室等渗盐水灌洗后,再用含4%多聚甲醛的磷酸缓冲液(PBS)灌注固定,迅速开颅取脑。石蜡包埋,切取中脑黑质区,切片厚度为 5 μm。
1.2.3 免疫组化染色 每组小鼠中随机取4只进行免疫组化染色。切片脱蜡后,用TBS(pH 7.4)洗3次,每次10 min。切片进行水浴法抗原修复后降至室温;TBS洗3次,每次10 min;加H2O2阻断内源性过氧化物酶,TBS洗3次,每次10 min。分别采用兔抗小鼠 Bcl-2、Caspase-3多克隆抗体(1∶200,Cell Signaling Technology,USA)加入稀释的羊抗兔IgGHRP,室温温育 1 h,PBS(pH 7.4)漂洗 5 min,共 3次。滴加DAB显色液显色10 min,蒸馏水冲洗、复染、脱水、封片。
1.2.4 免疫蛋白印迹(Western blot) 每组剩余4只小鼠进行免疫蛋白印迹分析。小鼠麻醉后取中脑黑质部分,置入组织蛋白提取液中,低温匀浆,取出上清液。蛋白定量后取30 μg样品,经8%SDS凝胶电泳后,转移至硝酸纤维膜上,室温下5%脱脂奶粉封闭2 h后,取相应条带分别加入Bcl-2兔抗小鼠一抗(1∶1000,Cell Signaling Technology,USA),Caspase-3兔抗小鼠一抗(1∶1000,Cell Signaling Technology,USA),4℃孵育过夜,TBST清洗3次,每次5 min,加 HRP 标记的羊抗兔二抗(1∶1000,Sigma,USA),室温孵育1 h。TBST洗膜3次,每次5 min。暗室内加ECL显影液显色曝光,扫描。内参为 β-actin(1∶1000,Cell Signaling Technology,USA)。
1.3 统计学处理 采用SPSS 16.0统计软件,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化 Ⅰ组小鼠黑质可见大量神经元(图1A),排列整齐呈条带状。Ⅱ组和对照组比较,黑质区神经元明显减少(图1B)。Ⅴ、Ⅵ组与Ⅱ组比较,神经元明显增多(图1B、E、F),但Ⅲ、Ⅳ组与Ⅱ组比较,黑质区神经元减少无差异(图1B、C、D)。

图1 6组小鼠黑质区多巴胺能神经元免疫组化染色结果(×200)
2.2 Western blot检测 PD模型组小鼠黑质区Caspase-3蛋白含量最高(图2)。丙泊酚24 h干预组小鼠黑质区Bcl-2蛋白的含量最高(图3)。
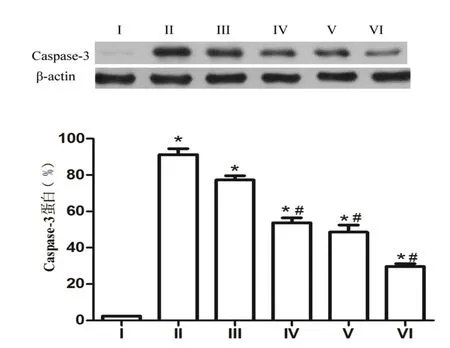
图2 6组小鼠黑质区Caspase-3蛋白的含量

图3 6组小鼠黑质区Bcl-2蛋白的含量
3 讨论
PD是发生于中年以上的中枢神经系统进行性退行性疾病,其主要病理改变为黑质致密部多巴胺能神经元变性和坏死,流行病学研究显示该病为老年性痴呆(Alzheimer’s disease)以外第二多见的神经退行性病变[6]。随着人口老年化,接受外科手术的老年患者逐年增加,这意味着越来越多的PD患者亦接受手术麻醉。为了选择有利于PD患者的麻醉药物,本研究探讨了常用的静脉麻醉药丙泊酚对PD模型小鼠黑质神经元凋亡的影响,发现①丙泊酚减轻MPTP诱导帕金森小鼠黑质区组织学的改变,减少凋亡细胞的产生;②丙泊酚可抑制帕金森小鼠黑质凋亡蛋白Caspase-3的表达,同时上调抗凋亡蛋白Bcl-2的表达。
PD发病机制至今尚未完全阐明,普遍认为线粒体DNA的突变和氧化应激是主要致病因素[7]。MPTP可成功诱导小鼠PD模型[8],其机理可能为氧化应激造成的线粒体复合酶的功能抑制[2],引起细胞色素C释放,激活Caspase-3引起凋亡的产生[9-10]。Caspase-3和Bcl-2在细胞凋亡过程中起主要作用,Bcl-2和前凋亡蛋白Bax聚合为复合体,降低Bax活性,抑制凋亡的发生[11-12]。研究表明PD患者黑质区蛋白存在自由基调节损伤机制,自由基调节损伤可激活前凋亡蛋白Bax,同时还可破坏线粒体DNA(mtDNA),进一步加重 PD 症状[13-14]。而抑制Caspse-3蛋白的表达可以减轻黑质神经元凋亡[15]。
丙泊酚作为静脉麻醉药物广泛使用于临床麻醉及重症监护患者的镇静治疗,研究表明丙泊酚可通过清除自由基、降低脂质过氧化作用、抑制凋亡蛋白的产生,而产生脑保护作用[4,16]。丙泊酚的脑保护作用还表现为减少缺血再灌注后脑梗死面积[17]。此外研究显示丙泊酚对MPTP诱导的PD小鼠多巴胺能神经元产生保护作用,其机理是通过抑制环氧化酶(COX)蛋白表达来实现[17]。因此,在本研究中我们假设氧化应激在PD病程发展中具有重要作用[7],丙泊酚具有抗氧化、抑制凋亡蛋白表达等脑保护作用,对MPTP诱导的PD小鼠黑质神经元亦具保护作用。
本研究中,在MPTP诱导的小鼠帕金森模型中,免疫组化显示黑质区多巴胺能神经元凋亡细胞增加,经丙泊酚干预后多巴胺能神经元凋亡细胞减少,说明丙泊酚具有抗凋亡作用。丙泊酚处理后的MPTP小鼠,免疫组化及Western blot显示Bcl-2表达增加,而Bcl-2具有抗凋亡作用,可抑制脂质过氧化[16],表明丙泊酚抑制PD小鼠黑质区神经元凋亡可能通过抑制氧化应激实现的。Wang等[17]认为丙泊酚脑保护并不存在剂量依赖性,而Gelb等[18]认为镇静剂量的丙泊酚不产生脑保护作用。本研究中丙泊酚剂量100 mg/kg,PD小鼠接受腹腔注射后2 min后肢体反射消失,但呼吸存在,30 min后可恢复处理前状态,这与Kozue等[19]认为100 mg/kg丙泊酚腹腔注射可提供MPTP诱导PD小鼠中等麻醉深度结果一致。
本研究还观察了模型建立后2 h和24 h给予丙泊酚对黑质神经元凋亡的影响,发现24 h后给予丙泊酚显示出更好的抗凋亡作用,这可能与MPTP诱导的黑质神经元凋亡的时程相关,即模型建立后24 h时神经元的凋亡较2 h时更显著,此时给予丙泊酚显示更明显的抗凋亡效果,其机制需要进一步研究。此外,相关研究认为通过连续5次腹腔注射MPTP可以构建稳定的小鼠亚急性PD模型[20],故本研究中小鼠PD模型制备后未施行为学检测。
综上所述,丙泊酚可减轻MPTP诱导的小鼠黑质神经元的凋亡,该效应可能与其抑制Caspase-3活性、促进Bcl-2作用有关。
[1] 郭玉霞,杨 波,石 磊,等.姜黄素对中脑定位注射脂多糖引起帕金森样病变小鼠抗炎机制研究[J].医学研究生学报,2012,25(6):582-587.
[2] 胡 晓,王 省,闫福岭,等.帕金森病患者便秘发生情况的临床观察[J].东南国防医药,2013,15(4):332-334.
[3] Korah PK,Nandhu MS,Jes P.Oxidative stress mediated neuronal damage in the corpus striatum of 6-hydroxydopamine lesioned Parkinson's rats:neuroprotection by serotonin,GABA and bone marrow cells supplementation[J].J Neurosci,2013,331(2):31-37.
[4] Yoshinori K,Yoshimi N,Tatsuya H,et al.Propofol exerts greater neuroprotection with disodium edentate than without it[J].J Cerebral Blood Flow Metabolism,2008,28(1):354-366.
[5] Cui DR,Wang L,Jiang W,et al.Propofol prevents cerebral ischemia-triggered autophagy activation and cell death in the rat hippocampus through the NF-kB/p53 signaling pathway[J].Neurosci,2013,246(2):117-132.
[6] 沈 琮,张 兰,李 林.以a-synuclein为靶点的抗帕金森病药物研究进展[J].中国药理学通报,2014,830(2):149-153.
[7] Michael T,Lin M,Flint B.Mitochondrial dysfunction and axidative stress in neurodegenerative diseases[J].Nature,2006,443(19):787-795.
[8] Mermill JE,Koyanagi Y,Zack J.Rapamycin protects against neuron death in in vitro and in vivo models of Parkinson,s disease[J].Neurosci,2010,30(1):1166-1175.
[9] Zhai A,Zhu X,Wang X,et al.Secalonic acid A protects dopaminergic neurons from 1-methyl-4-phenylpyridinium(MPP+)-induced cell death via the mitochondrial apoptotic pathway[J].Eur J Pharm,2013,713(1-3):58-67.
[10] Song JX,Shaw PC,Wong NS,et al.Chrysotoxine,a novel bibenzyl compound selectively antagonizes MPP+ ,but not rotenone,neurotoxicity in dopaminergic SH-SY5Y cells[J].Neurosci Lett,2012,521(1):76-81.
[11]刘红军,朱红梅,程祝强,等.吗啡和曲马多对MADB-106乳腺癌细胞增殖和凋亡的影响[J].东南国防医药,2014,16(5):449-452.
[12] Thierry R,Reynald O,Laurent M,et al.Bcl-2 prolongs cell survival after Bax-induced release of cytochrome C[J].Nature,1998,391(29):496-499.
[13] Anthony HS.Mitochondria in the aetiology and pathogenesis of Parkinson’s disease[J].Lancet Neurol,2008,7(1):97-108.
[14] Perier C,Tieu K,Guegan C,et al.Complex I deficiency primes Bax-dependent neuronal apoptosis through mitochondrial oxidative damage[J].Proc Nall Acad Sci USA,2005,102(1):19126-19131.
[15] Burguillos MA,Deierborg T,Kavanagh E,et al.Caspase signaling controls microglia activation and neurotoxicity[J].Nature,2011,472(7343):319-324.
[16] Xi HJ,Zhang TH,Tao T,et al.Propofol improved neurobehavioral outcome of cerebral ischemia-reperfusion rats by regulating Bcl-2 and Bax expression[J].Brain Res,2011,1410(1):24-32.
[17] Wang HY,Wang GL,Yu YH,et al.The role of phosphoinositide-3-kinase/Akt pathway in propofol-induced postconditionging against focal cerebral ischemia-reperfusion injury in rats[J].Brain Res,2009,1297(4):177-184.
[18] Gelb AW,Bayona NA,Wilson JX,et al.Propofol anesthesia compared to awake reduces infarct size in rats[J].Anesthesiology,2002,96(2):1183-1190.
[19] Kozue K,Takefumi I,Koh S.Possible role of propofol’s cyclooxygenase-inhibiting property in alleviating dopaminergic neurona loss in the substantia nigra in an MPTP-induced murine model of Parkinson’s disease[J].Brain Res,2011,1387(1):125-133.
[20] Petroske E,Meredith GE,Callen S,et al.Mouse model of Parkinsonism:a comparison between subacute MPTP and chronic MPTP/probenecid treatment[J].Neuroscience,2001,106(1):589-601.
