MMF联合糖皮质激素治疗伴肾功能损害的进展性Ig A肾病的不同疗效的特点分析
2015-12-08张希燃王凉孙铸兴
张希燃,王凉,孙铸兴
无锡市人民医院肾内科,江苏无锡 214023
MMF联合糖皮质激素治疗伴肾功能损害的进展性Ig A肾病的不同疗效的特点分析
张希燃,王凉,孙铸兴
无锡市人民医院肾内科,江苏无锡 214023
目的 分析吗替麦考酚酯(Mycophenolatemofetil,MMF)联合糖皮质激素治疗伴肾功能损害的进展性IgA肾病时不同疗效的特点,探讨对疗效有预测价值的临床、病理特征。 方法 整群选择2010年2月—2013年6月在无锡市人民医院经肾脏病理检查诊断的原发性IgA肾病42例,对符合进展性IgA肾病特点,同时伴有肾功能损害,并接受MMF联合糖皮质激素治疗的病例进行回顾性分析研究。结果 共42例患者纳入该研究,男性(21例)占61.9%,CKD3~4期患者占74.6%,平均eGFR(50.29±19.04)mL/min·1.73m2,平均蛋白尿(3.15±1.73)g/d;42例(100.0%)均予MMF联合泼尼松治疗,其中CR21例(50.0%),PR15例(35.6%),NR6例(14.3%),治疗有效率85.6%。比较发现,NR患者基线蛋白尿高于CR、PR患者(P<0.01),血浆白蛋白低于后两者(P<0.05)。肾活检时,NR组血肌酐最高(P<0.05)、eGFR水平最低(P<0.05)。NR患者病理上肾小管萎缩、间质纤维化最严重(P<0.01),细胞性新月体最少见(P<0.01)。单因素、多因素COX回归分析结果表明,蛋白尿>3.5g/d、eGFR<30 mL/min·1.73m2、严重肾小管间质慢性病变为疗效差的独立危险因素。细胞性新月体为疗效良好的独立预测因素(P<0.001)。不良反应在疗效差的患者中更多见(P<0.05)。 结论MMF联合糖皮质激素治疗伴肾功能损害的进展性IgA肾病总有效率高,安全性好。尿蛋白>3.5 g/d、eGFR<30 mL/ min·1.73m2、严重肾小管间质慢性损害均为疗效差的独立危险因素。细胞性新月体为疗效良好的独立预测因素。
MMF;糖皮质激素;进展性IgA肾病;临床病理特征;疗效分析
IgA肾病(IgA nephropathy,IgAN)是全球最常见的一种原发性肾小球肾炎,约占亚洲地区原发性肾小球疾病的45%[1],也是我国ESRD(End stage renal disease,ESRD)的主要病因之一。诸多的循证医学证据已表明,蛋白尿是IgA肾病预后不良的独立危险因素[2]。因此,RAS阻断剂、糖皮质激素以及多种免疫抑制剂已被指南推荐应用于IgA肾病的治疗[3]。但对于伴肾功能损害的进展性IgA肾病的治疗,是否可以选择MMF联用糖皮质激素,目前仍存在争议[4-5]。该研究通过回顾性分析2010年2月—2013年6月该中心资料,旨在评估在此类患者中联合应用MMF及糖皮质激素治疗的疗效及安全性,分析不同疗效患者的特点,探讨对疗效有一定预测价值的临床或病理特征。
1 资料与方法
1.1 一般资料
整群选取自2010年2月—2013年6月于无锡市人民医院住院经肾活检术明确为IgA肾病,临床表现为进展性IgA肾病[6],存在慢性肾功能损害(eGFR下降),并接受MMF联合糖皮质激素治疗的患者共51例。除外9例失随访,余42例均符合以下条件:①光镜、电镜均提示肾小球系膜区弥漫IgA沉积;②无过敏性紫癜、类风湿性关节炎、乙肝病毒相关性肾炎、自身免疫性甲状腺疾病相关肾病、系统性红斑狼疮等继发性因素;③无糖尿病肾病、肥胖相关性肾病等其他合并症;④肾活检时蛋白尿≥1.5 g/d且25 mL/min·1.73m2≤eGFR≤70 mL/min·1.73 m2(MDRD公式);⑤治疗方案为MMF联合醋酸泼尼松口服,MMF起始剂量1.0 g/d,治疗6个月,维持剂量0.5 g/d,治疗12个月;泼尼松起始剂量0.8 mg/(Kg·d)治疗4周,每2周减量5 mg,规律减至维持剂量0.1~0.2 mg/(Kg·d),总疗程18个月;⑥随访≥18个月。
1.2 方法
1.2.1 临床资料及实验室数据收集 收集患者性别、年龄、肾活检时间、CKD分期、SBP、DBP、肾性贫血、RAS阻断剂应用、随访期间不良反应发生情况等资料。记录肾活检时的24 h尿蛋白(Upro)、尿RBC、尿N-乙酰-β-葡萄糖苷酶(NAG)、尿视黄醇结合蛋白(RBP)、血清肌酐(Scr)、总胆固醇(Chol)、血浆白蛋白(Alb)、血红蛋白(Hb)、血清IgA(IgA)、红细胞沉降率(ESR)。根据MDRD公式估算eGFR(mL/min·1.73㎡)。
1.2.2 肾脏牛津病理分型 肾组织光镜病理按照2009 Oxford病理分型标准进行分型。系膜细胞增殖M0(<4个系膜细胞/系膜区),M1(4~5个系膜细胞/系膜区),M2(6~7个系膜细胞/系膜区),M3(>8个系膜细胞/系膜区);内皮细胞增殖E1(见内皮细胞增殖改变);节段硬化S1(见节段硬化改变);肾小管萎缩、间质纤维化T0(<25%),T1(25%~50%),T2(>50%)。细胞性新月体C1(有细胞性新月体),C0(无细胞性新月体)。
1.2.3 相关指标定义 进展性IgA肾病指符合IgA肾病的病理诊断,尿蛋白定量>1.0 g/d,常伴有高血压,eGFR正常或有所下降一组IgA肾病。完全缓解(complete remission,CR)指尿蛋白定量<0.5 g/24 h,白蛋白>35 g/ L,同时血肌酐无上升;部分缓解(part remission,PR)指蛋白尿较基线下降>50%,且≤3.5 g/24 h,同时血肌酐无上升或较基线上升<15%;未缓解(no remission,NR)指蛋白尿增加或较基线下降<50%,或血肌酐较基线上升≥15%。有效率为完全缓解及部分缓解率之和。
1.3 统计方法
2 结果
2.1 肾活检时的一般情况
该组42例患者中男性26例(61.9%),女性16例(38.1%)。肾活检时的平均年龄(33.83±1.83)岁,起病至行肾活检的中位时间为12.0(0.5~168)个月。如表1所示,肾活检时33例(78.6%)处于CKD3~4期,且均合并肾性高血压,余9例(21.4%)为CKD2期,5例(11.9%)存在肾性贫血。肾活检时平均蛋白尿为(3.15±1.73)g/d,平均eGFR(50.29±19.04)mL/min·1.73m2。42例(100.0%)均接受MMF联合糖皮质激素治疗。其中40例(95.2%)接受RAS阻断剂治疗,平均随访18个月,21例(50.0%)完全缓解(CR),15例(35.6%)部分缓解(PR),6例(14.3%)未缓解(CR),治疗有效率85.6%。
2.2 不同疗效组临床特征比较
比较不同疗效患者的临床特征后发现,NR患者基线蛋白尿明显高于CR及PR患者〔NR(5.75±0.72)vs CR(2.36±1.07)、PR(3.40±1.72)g/d,(P<0.01)〕,其血浆白蛋白低于后两者〔(NR(28.55±5.73)vs CR(36.29±3.97)、PR(34.85±4.73)g/L,(P<0.05)〕。肾活检时,NR患者的血肌酐水平高于其余两组(P<0.05),同时eGFR水平最低(P<0.05)。3组间尿NAG、尿RBP差异有统计学意义(P<0.01)(表2,3)。分析结果显示,3组间年龄、性别、CKD分期、血压情况、尿RBC、Hb、TC、ESR均差异无统计学意义(P>0.05)。
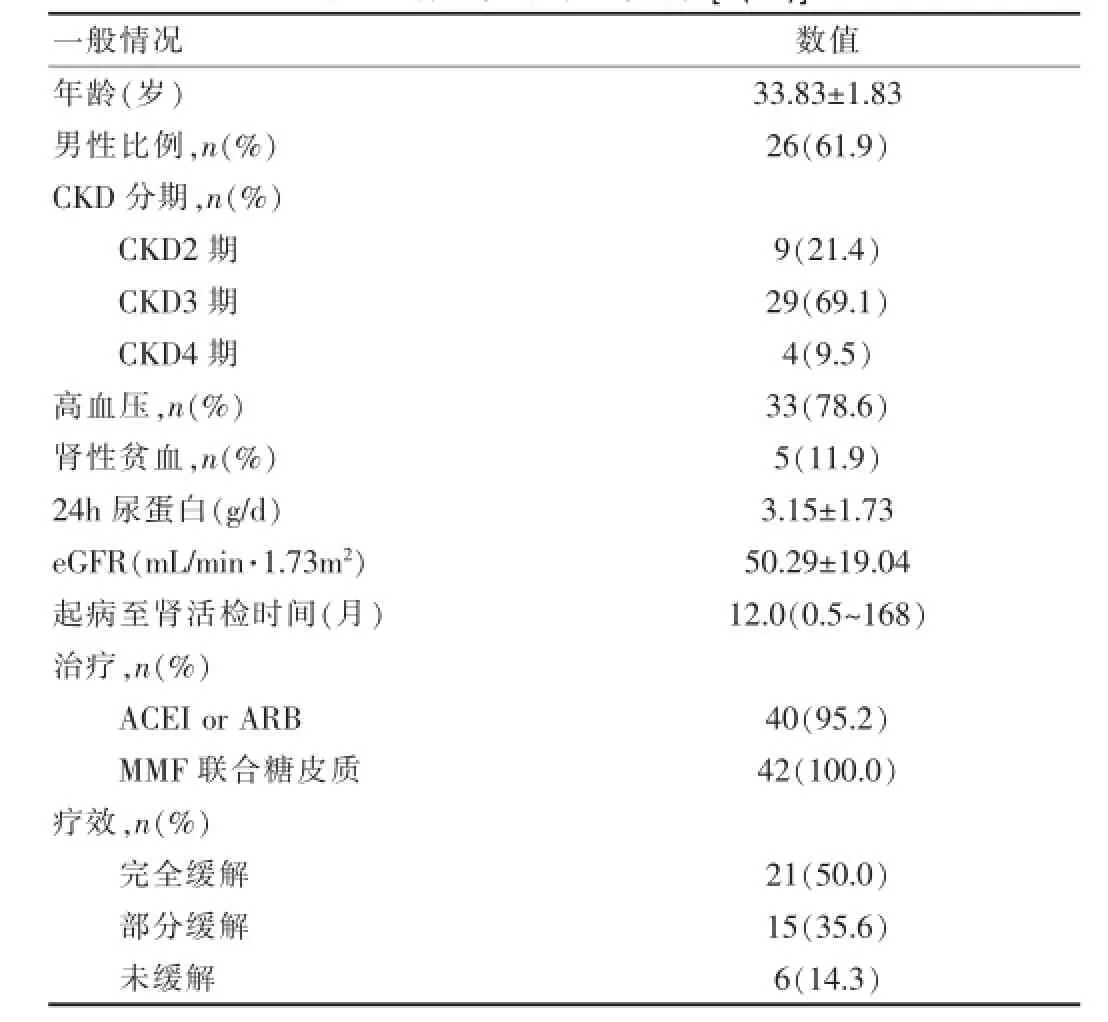
表1 肾活检时的基本特征[n(%)]
2.3 不同疗效组病理特征比较
比较3组患者的病理特征后发现,NR组肾小管萎缩、间质纤维化表现最突出(P<0.01),细胞性新月体表现更罕见 (P<0.01)。同时,球性硬化 [完全缓解组为(36.03±13.80)%,部分缓解组为(36.06±18.85)%,未缓解组为(38.85±4.68)%]、节段硬化、系膜细胞增殖、内皮细胞增殖等病理表现在不同疗效的患者之间差异无统计学意义(P>0.05)(表4)。
2.4 影响疗效的危险因素分析
单因素COX回归分析结果显示,蛋白尿>3.5g/d(P<0.001)、eGFR<30 mL/min﹒1.73㎡(P<0.001)、严重肾小管萎缩(P<0.001)均为疗效差的危险因素。病理上存在细胞性新月体表现为疗效良好的预测因素。多因素COX回归分析结果进一步表明,蛋白尿>3.5 g/d(HR2.083,95%CI:0.774~4.515,P<0.001)、eGFR<30 mL/ min·1.73m2(HR 1.768,95%CI:0.147~4.011,P<0.001)、严重肾小管萎缩 (HR 3.109,95%CI:0.391~7.149,P<0.001)均为MMF联合糖皮质激素治疗伴肾功能损害的进展性IgA肾病疗效差的独立危险因素。病理上细胞性新月体形成为疗效良好的独立预测因素 (单因素COX模型HR 2.719,95%CI:0.471~15.687,P<0.001)(表5)。
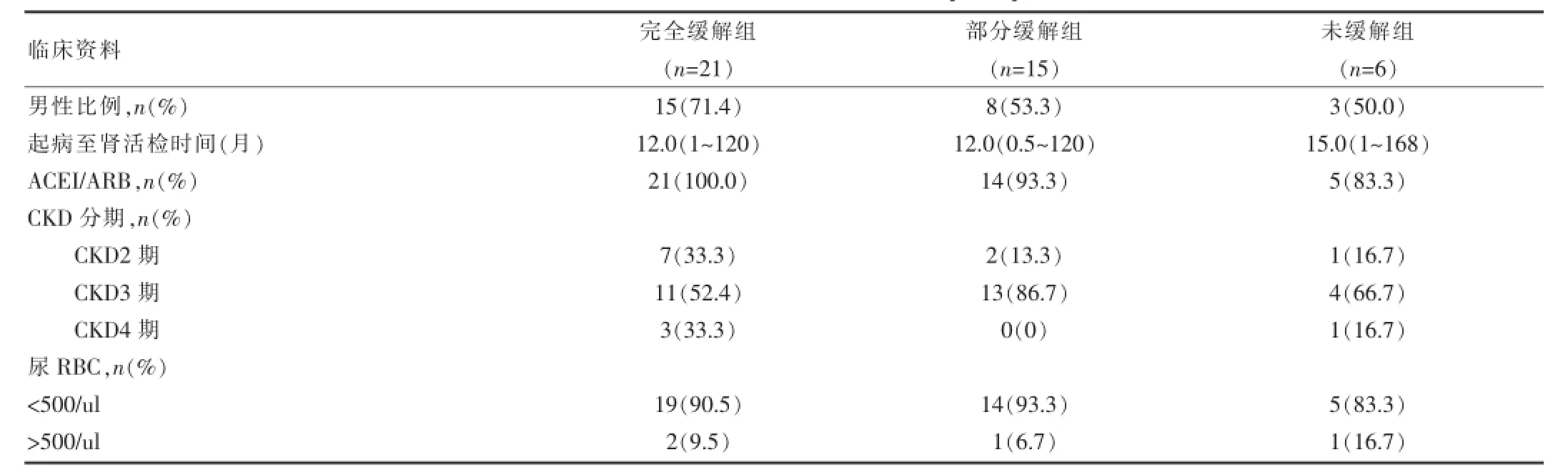
表2 不同疗效的患者临床指标的比较[n(%)]

表3 不同疗效的患者临床指标的比较[n(%)]

表4 不同疗效的患者病理指标的比较
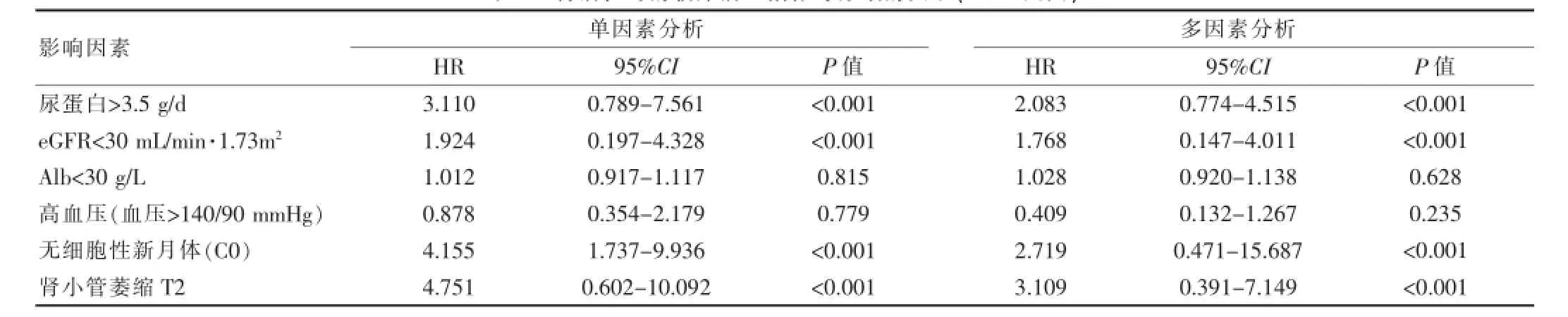
表5 肾活检时的临床病理指标与疗效的关系(COX回归)
2.5 不同疗效组之间不良反应的比较
平均随访18个月,共4例(9.5%)出现不良反应。CR组中1例(4.8%)于治疗第2个月出现腹泻症状,PR组中1例(6.7%)于治疗第1周出现胃部不适,经对症治疗后均好转。NR组中2例(33.3%)分别于治疗第5个月、第8个月因肺部感染住院,经积极治疗后感染控制,后继续按原方案接受免疫抑制剂联合糖皮质激素治疗。NR组不良反应发生率高于CR组(χ2=3.857)、PR组(χ2=3.489)(P<0.05)。
3 讨论
IgA肾病作为世界范围内最常见的原发性肾小球疾病,其对治疗的反应及预后情况在不同国家间存在较大的差异[7]。目前蛋白尿已被公认为影响IgA肾病预后的最主要的危险因素之一[8-9],并且认为蛋白尿降至1.0 g/d以下可以显著降低患者进入终末期肾脏病的风险[8]。有研究表明,基线eGFR水平也是IgA肾病进展至ESRD的危险因素之一[10]。现有的关于亚洲人群IgA肾病治疗的研究中,均对纳入对象的eGFR水平有一定要求[11-12]。那么,对于eGFR水平偏低,同时存在1g以上蛋白尿,而病理表现不符合新月体肾炎诊断的IgA肾病,除外RAS阻断剂,是否可以给予糖皮质激素联合免疫抑制剂治疗。大规模临床研究已表明,MMF是一种安全、有效的新型免疫抑制剂,不良反应较少。尤其在狼疮性肾炎、新月体肾炎等的治疗中能够明显降低蛋白尿、延缓肾功能进展。MMF主要通过选择性地耗竭T、B淋巴细胞内的鸟嘌呤核苷酸来抑制T、B淋巴细胞的增殖,进而抑制细胞介导的免疫反应和抗体生成,同时抑制粘附分子的糖基化和表达,抑制淋巴细胞和单核细胞向炎症细胞部位的趋化,此外还可阻断血管平滑肌细胞和系膜细胞的增生,选择性地阻断一氧化氮合成酶,诱导活化T细胞的凋亡。
但在原发性IgA肾病的治疗中MMF疗效如何,目前的研究结论不一,在Maes等[13]的小样本量的RCT研究中,MMF联合糖皮质激素治疗伴肾功能损害的进展性IgA肾病较安慰剂对照组,在减少蛋白尿及延缓肾功能进展方面均未见明显优势,鉴于可能带来的副作用,作者不建议使用。Ruan等[14]的结论则是MMF、糖皮质激素较RAS阻断剂治疗进展性IgA肾病能够更明显的降低尿蛋白水平。
该研究结果显示,对于蛋白尿≥1.5g/d同时25≤eGFR≤70 mL/min·1.73m2的进展性 IgA肾病,给予MMF联合中等剂量泼尼松口服治疗1.5年,有效率达85.6%,其中完全缓解率达50.0%。Chen等[15]报道的完全缓解率为44.4%。该研究中MMF起始剂量为1.0g/d,总疗程18个月,泼尼松起始剂量0.8 mg/(Kg·d),4周后(每2周减量5 mg)规律减至0.1~0.2 mg/(Kg·d),总疗程18个月。所有病例均未见明显不良反应发生,推断这与联合用药并控制糖皮质激素、MMF的起始剂量及治疗疗程有关。Chen等[16]通过荟萃分析研究表明,MMF治疗进展性IgA肾病时疗程应控制在18个月以内,延长疗程对患者无更多获益,反而可能带来更多不良反应。
该研究中单因素、多因素COX回归分析结果均表明,进展性IgA肾病若表现为大量蛋白尿,伴肾功能减退,尤其肾脏病理提示肾小管萎缩、间质纤维化慢性改变突出,应用MMF联合糖皮质激素治疗往往疗效差。这与Ruan等[14]的观点一致。通过比较各疗效组不良反应后发现,未缓解患者感染等严重不良反应发生率更高(P<0.05),因此,对此部分患者应尽量避免使用糖皮质激素或免疫抑制剂治疗。该研究还显示,细胞性新月体病理改变在治疗有效的患者中更多见,存在一定比例的细胞性新月体为疗效良好的独立预测因素。因此,如果肾脏病理提示较多细胞性新月体形成,在无禁忌症情况下应当优先选择MMF联合糖皮质激素治疗。当然,这并非说明新月体比例越高,疗效越好。细胞性新月体病理改变提示体内T、B淋巴细胞活化、抗体的合成、肾脏局部固有细胞的增殖比较活跃,因此,糖皮质激素及免疫抑制剂通过控制淋巴细胞的活化等一系列机制从而减少蛋白尿,延缓肾损害进展[17]。该组病例的中位细胞性新月体比例约为15%,且临床非急进性肾炎表现,因此疗效良好。
由于该研究属回顾性分析研究,存在一定的局限性,因此,MMF联合糖皮质激素治疗伴肾功能损害的进展性IgA肾病的长期疗效、安全性及预后情况有待更大样本量、更长随访周期的前瞻性研究来进一步评估。
总之,该研究结果表明,MMF联合糖皮质激素治疗伴肾功能损害的进展性IgA肾病总有效率良好,不良反应发生率低,安全性好。大量蛋白尿(尿蛋白>3.5g/L)、eGFR明显下降(eGFR<30 mL/min·1.73㎡)、严重肾小管间质慢性损害改变均为疗效不佳的独立危险因素,对具有上述临床病理特征的患者应避免选择MMF联合糖皮质激素治疗方案。病理上细胞性新月体形成为疗效良好的独立预测因素。
[1]Li LS,Liu ZH.Epidemiologic data of renal diseases from a single unitin china:analysis based on 13,519 renalbiopsies[J]. Kidney Int,2004,66(3):920-923.
[2]Donadio JV,Bergstralh EJ,Grande JP,et al.Proteinuria patterns and their association with subsequent end-stage renal disease in IgA nephropathy[J].Nephrol Dial Transplant, 2002,17(7):1197-1203.
[3]Garabed EK,NorbertLA.IgA nephropathy[J].Kidney international Supplements,2012(2):209-217.
[4]GaosiXiu,WeipingTu,Dongfeng Jiang,et al.Mycophenolatemofetil treatment for IgA nephropathy:A meta-analysis[J]. Am J Nephrol,2009,29(5):362-367.
[5]Liu X,Dewei D,Sun shiren,et al.Treatment of severe IgA nephropathy:mycophenolatemofetil/prednisone compared to cyclophosphamide/prednisone[J].Int J ClinPharmacolTher, 2014,2(2):95-102.
[6]CheungC,Bashir S,Barratt J.IgA nephropathy [J].J Am Soc Nephrol,2005,16(7):2088-2097.
[7]Geddes CC,Rauta V,C Gronhagen-Riska,et al.Atricontinental view of IgA nephropathy[J].Nephrol Dial Transplant, 2003,18(8):1541-1548.
[8]Berthoux F,Mohey H,Laurent B,et al.Predicting the Risk for Dialysis or Death in IgA Nephropathy[J].J Am Soc-Nephrol,2011,22(4):752-761.
[9]Reich HN,Troyanov S,Scholey JW,et al.Remission of proteinuria improves prognosis in IgA nephropathy[J].J Am Nephrol,2007,18(12):3177-3183.
[10]D'Amico G.Natural history of idiopathic IgA nephropathyand factors predictive of disease outcome[J].SeminNephrol, 2004,24(3):179-196.
[11]Hirokazu Imai,Naoto Miura.A treatment dilemma in adult IgA nephropathy:what is the appropriate target,preservation of kidney function or induction of clinical remission[J]. ClinExpNephrol,2012(16):195-201.
[12]JK Kim,JH Kim,SC lee,et al.Clinical Features and Outcomes of IgA Nephropathy with nephritic syndrome[J].Clin J Am SocNephrol,2012(7):427-436.
[13]Maes BD,Oyen R,Claes K,et al.Mycophenolatemofetil in IgA nephropathy:results of a 3-year prospective placebocontrolled randomized study[J].Kidney Int,2004,65(5): 1842-1849.
[14]YPRuan,WF Chen,et al.Role ofimmunosuppressive thera-py and pred ictors of therapeutic effectiveness and renal outcome in IgA nephropathy with proteinuria[J].Arch Med Sci,2015,11(2):332-339.
[15]Chen X,Wu J,Tang L,et al.A randomised control trial of mycophenolatemofetiltreatmentin severe IgA nephropathy[J]. Zhonghua Yi Xue Yuan ZaZhi,2002(82):796-801.
[16]YY Chen,YM Li,et al.Efficacy and safety of mycophenolatemofetiltreatment in IgA nephropathy:a systematic review[J].BMC Nephrol,2014(15):193-203.
[17]Choi MJ,Gimenez,Briggs WA,et al.Mycophenolatemofetil treatment for primaryglomerulardiseases[J].Kidney Int,2002 (61):1098-1104.
Different Efficacies of MMF Combined with Prednisone for Progressive IgA Nephropathy with Renal Impairment
ZHANG Xi-ran,WANG Liang,SUN Zhu-xing
Department of Nephrology,Wuxi People's Hospital,Wuxi,Jiangsu Province,214023 China
Objective To analyze the different efficacies of MMF combined with prednisone for progressive IgA nephropathy with renal impairment and investigate the clinicopathological features that can be the predictive markers of the efficacies. Methods 42 patients with biopsy-proven primary IgA nephropathy treated by MMF combined with prednisone in Wuxi People's Hospital from February 2010 to June 2013 were enrolled in this retrospective analysis,and they also had characteristics of progressive IgA nephropathy accompanied by renal dysfunction.Results Of the 42 cases enrolled in study,men (21 cases)accounted for 61.9%,CKD3-4 patients accounted for 74.6%,with an average eGFR(50.29±19.04)mL/min.1.73㎡and an average proteinuria(3.15±1.73)g/d.All the 42 cases(100.0%)were treated with MMF combined with prednisone. The complete remission(CR),partial remission(PR)and no remission(NR)rate was 50.0%(21 cases),35.6%(15 cases)and 14.3%(6 cases)respectively.The treatment efficiency was 85.6%.Compared to the responders(CR and PR groups),non-responders(NR group)got higher baseline proteinuria(P<0.01)and lower serum albumin(P<0.05).Among the three groups at renal biopsy,NR group showed the highest serum creatinine(P<0.05)and lowest eGFR(P<0.05).Besides,renal tubular atrophy and interstitial fibrosis appeared much severer in NR group(P<0.01),of them cellular crescents performance was rarer to be seen(P<0.01).Both univariate and multivariate COX regression analysis showed that proteinuria>3.5g/d,eGFR<30mL/ min﹒1.73m2,severe renal tubular atrophy were independent risk factors for poor effects.Cellular crescents was an independent predictor of satisfactory effect(P<0.001).Adverse effects were more usually seen when there was poor therapy effect(P<0.05).Conclusion MMF combined with prednisone for progressive IgA nephropathy with renal impairment got good effect and safety.Urine protein>3.5g/d,eGFR<30mL/min﹒1.73m2,severe chronic damage of renal tubular were independent risk factors of poor curative effect.Cellular crescent performance was an independent predictor of good curative effect.
MMF;Prednisone;Progressive IgA nephropathy;Clinicopathological features;Therapeutic effect analysis
R4
A
1674-0742(2015)12(a)-0004-06
10.16662/j.cnki.1674-0742.2015.34.004
2015-09-07)
张希燃(1987-),女,江苏无锡人,硕士,住院医师,主要从事肾脏病临床及科研工作。
孙铸兴(1960-),男,江苏无锡人,本科,副主任医师,主要从事肾脏病临床及科研工作。邮箱:wuxisunzx@126.com。
