老年人下肢动脉粥样硬化与心血管危险因素相关性分析
2015-12-08刘琴柯大智陈庆伟李桂琼邓玮
刘琴,柯大智,陈庆伟,李桂琼,邓玮
老年人下肢动脉粥样硬化与心血管危险因素相关性分析
刘琴,柯大智,陈庆伟,李桂琼,邓玮
目的:探讨老年人下肢动脉粥样硬化与心血管危险因素的相关性。
方法:连续入选2013-05至2014-11于我科住院行下肢动脉彩色超声的患者700例,根据年龄分为青中年组(n=83例)、老年组(n=377例)、高龄老年组(n=240例),根据下肢动脉彩色超声对动脉硬化严重程度评分标准,其中正常患者112例、轻度硬化患者81例、中度硬化患者466例、重度硬化患者41例,比较其危险因素的差异。
结果:二分类多因素非条件Logistic回归分析示,年龄、吸烟、糖尿病史、血清尿酸(UA)、踝肱指数(ABI)是下肢动脉粥样硬化的独立危险因素[回归系数(B)分别为:0.144,1.496,0.963,0.004,-2.510;95%可信区间(CI):1.120~1.190,2.257~8.824,1.456~4.716,1.001~1.007,0.012~0.534;P值:0.000,0.000,0.001,0.006,0.009];有序多分类Logistic回归分析显示,年龄、男性、吸烟、ABI、UA、高血压病史与动脉硬化严重程度相关(回归系数分别为:0.130,0.737,0.592,-3.365,0.003,0.735;95%CI:0.097~0.162,0.222~1.252,0.052~1.132,-4.674~-2.055,0.001~0.005,0.313~1.157;P值:0.000,0.005,0.032,0.000,0.005,0.001);与青中年组相比,老年组、高龄老年组中、重度硬化病变率明显较高;高龄老年组中、重度硬化病变率亦较老年组高(P均<0.01),差异有统计学意义;随着增龄,下肢动脉粥样硬化严重程度评分升高,差异有统计学意义(P<0.01)。
结论:与青中年相比,老年人下肢动脉粥样硬化程度较重;增龄、吸烟、糖尿病史、UA、ABI是下肢动脉粥样硬化的独立危险因素;其严重程度与高龄、男性、吸烟、UA、ABI、高血压病史相关。
老年人;下肢动脉粥样硬化;心血管危险因素;彩色多普勒超声
Methods: A total of 700 consecutive patients receive lower extremity Color Doppler ultrasound in our hospital from 2013-05 to 2014-11 were investigated. The patients were divided into 3 age groups: Young and middle group, n=83, Elder group, n=377 and Senile group, n=240. Based on ultrasound scoring system, the patients were divided into 4 groups: Normal group, n=112, Mild atherosclerosis (Mild) group, n=81, Moderate group, n=466 and Severe group, n=41. The cardiovascular risk factors among different groups were compared.
Results: Multivariate unconditional logistic regression analysis showed that age, smoking, history of diabetes, uric acid (UA), ankle-brachial index (ABI) were the independent risk factors for LEAD (B=0.144, 1.496, 0.963, 0.004, -2.510; 95% CI: 1.120-1.190, 2.257-8.824, 1.456-4.716, 1.001-1.007, 0.012-0.534; P=0.000, 0.000, 0.001, 0.006, 0.009 respectively. Ordinal logistic regression analysis indicated that age, male gender, smoking, ABI, UA, history of hypertension were related to the severity of atherosclerosis (B=0.130, 0.737, 0.592, -3.365, 0.003, 0.735; 95% CI: 0.097-0.162, 0.222-1.252, 0.052-1.132, -4.674 to -2.055, 0.001-0.005, 0.313-1.157; P=0.000, 0.005, 0.032, 0.000, 0.005, 0.001 respectively. Compared with Young and Middle groups, Elder and Senile groups had increased rates of moderate and
severe arteriosclerotic lesions; compared with Elder group, Senile group presented the higher incidence of moderate and severe lesions, all P<0.01. With elevated age, the severity score of LEAD increased accordingly, P<0.01.
Conclusion: Lower extremity atherosclerosis lesions were more severe in elder patient, and it was particularly severe in senile patients.
(Chinese Circulation Journal, 2015,30:1076.)
下肢动脉粥样硬化性疾病(LEAD)是全身动脉硬化在肢体局部的表现,是老年人常见的一种肢体慢性缺血性疾病,已被NCEP ATPⅢ[1]列为冠心病的等危症。临床上,LEAD涵盖了一组临床特点、危险层次及预后极不均一的疾病群体,目前人们已对老年LEAD及其相关危险因素开展研究,但不同年龄层次、不同严重程度LEAD与各危险因素之间的相关性及特点尚不完全清楚。本文针对老年(特别是高龄老年人)这一特殊群体,通过彩色多普勒超声检测患者下肢动脉粥样硬化情况,比较各年龄层次、不同严重程度LEAD各危险因素的特点,分析其相关性,探讨高危因素,为其防治提供依据。
1 资料与方法
对象:连续选取2013-05至2014-11于我院老年病科行下肢动脉彩色多普勒超声检查的住院患者共700例。根据年龄分为青中年组(42~59岁)83例,平均(54.99±4.18)岁;老年组(60~79岁)377例,平均(70.01±5.87)岁;高龄老年组(80~100岁)240例,平均(84.06±3.51)岁。根据动脉硬化严重程度,其中正常患者112例,平均(62.51±7.96)岁,轻度硬化81例,平均(68.14±8.17)岁,中度硬化466例,平均(75.65±9.49)岁,重度硬化41例,平均(81.88±7.12)岁。排除标准[2]:(1)急性动脉栓塞;(2)血栓闭塞性脉管炎;(3)多发性大动脉炎;(4)结节性多动脉炎;(5)特发性动脉血栓形成;(6)需与可引起假性间歇性跛行的其他疾病,包括神经根压迫、椎管狭窄、有症状的贝克氏囊肿、慢性肌筋膜综合征、神经性疼痛、髋关节炎等鉴别。
方法: (1)临床资料:对所有研究对象详细询问病史,记录年龄、性别、吸烟史、高血压病史、糖尿病史。检测血清甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、血清肌酐(Cr)、尿酸(UA)、超敏C反应蛋白(hs-CRP)、糖化血红蛋白(HbA1c)、血浆纤维蛋白原(Fib)、空腹血糖(FBG)、早餐后2小时血糖(2hPBG);收集研究对象的血压、身高(cm)、体重(kg)、踝肱指数(ABI)值,计算体重指数(BMI)=体重/身高2(kg/m2)。(2) 诊断标准:采用GE vivid7型彩色多普勒超声检测仪,线阵式探头频率10 MHz,受检者充分暴露下肢,取仰卧或俯卧位,检测股总动脉、股深动脉、股浅动脉、腘动脉、胫前动脉、胫后动脉。动脉内中膜厚度(IMT)测量和增厚标准: 上述任一动脉横断面IMT最厚处测量,正常IMT<1.0 mm[3,4],IMT≥1.0 mm定义为内膜增厚。斑块定义及测量[4]: 下肢动脉横断面IMT最厚处测量,局限性IMT增厚凸入动脉管腔≥0.5 mm,或较周围IMT增加超过50%,或IMT>1.5 mm定义为斑块。根据下肢动脉彩色超声结果进行严重程度评分[5],标准:①动脉内膜厚度:正常(<1 mm)0分,轻度增厚(1.0~1.2 mm)1分,中重度增厚(>1.2 mm)2分。②硬化程度:正常0分,轻度硬化(内膜不厚但回声强,无斑块)1分,中重度硬化(轻度伴斑块或狭窄)计2分。③斑块:正常0分,单发1分,多发2分,弥漫3分。④狭窄:正常0分,轻度狭窄(狭窄30%~50%)1分,中重度狭窄(狭窄50%~75%)2分,闭塞(>75%~无血流)3分。用总分评定病变严重性:①0分为正常。②<10分为轻度。③ 10~19分为中度。④≥20分为重度。
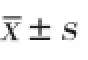
2 结果
不同年龄组间临床基线资料比较(表1): 与青中年组比较,老年组人群高血压患病率、Fib、Cr、
hs-CRP较高,DBP、TC、ABI较低;差异有统计学意义(P均<0.05~0.01)。与青中年组比较,高龄老年组高血压患病率、SBP、Fib、Cr、UA、hs-CRP较高,BMI、DBP、TG、TC、LDL-C、ABI较低,差异有统计学意义(P均<0.05~0.01)。与老年组比较,高龄老年组高血压患病率、Fib、Cr、UA、hs-CRP较高,BMI、DBP、TG、TC、ABI较低,差异有统计学意义(P均<0.05~0.01)。
不同严重程度下肢动脉粥样硬化患者基线资料比较(表2): 随动脉硬化严重程度加重,年龄呈明显上升趋势,差异有统计学意义(P均<0.01)。与正常患者比较,轻度硬化患者Cr、UA较高,ABI较低,差异有统计学意义(P均<0.05~0.01);与正常患者相比,中度硬化患者具有较高的男性百分比、吸烟率、高血压及糖尿病患病率,SBP、FBG、2 h PBG、Fib、Cr、UA、hs-CRP亦较高,BMI、TC、HDL-C、ABI较低,差异有统计学意义(P均<0.05~0.01);与正常患者相比,重度硬化患者具有更高的男性百分比、吸烟率、高血压患病率,SBP、2 h PBG、HbA1c、Fib、Cr、UA、hs-CRP均较高,而TC、HDL-C、ABI较低,差异有统计学意义(P均<0.05~0.01)。与轻度硬化患者比较,中度硬化患者男性百分比、高血压患病率、SBP、FBG、Cr、UA较高,HDL-C、ABI较低,差异有统计学意义(P均<0.05~0.01);与轻度硬化患者相比,重度硬化患者男性百分比、吸烟率、高血压患病率、SBP、Fib、Cr、UA、hs-CRP更高,ABI明显偏低,差异有统计学意义(P均<0.05~0.01);与中度硬化患者比较,重度硬化患者高血压患病率、Fib、UA较高,ABI较低,差异有统计学意义(P均<0.01)。
不同年龄组下肢动脉粥样硬化严重程度比较(表3): 年龄越大,严重程度评分越高(P均<0.01)。与青中年组相比,老年组、高龄老年组中、重度硬化病变率明显较高;高龄老年组中、重度硬化病变率较老年组高(P均<0.01)。
下肢动脉粥样硬化危险因素的多因素分析(表4): 以有无下肢动脉粥样硬化为因变量,各危险因素为自变量进行多因素非条件Logistics回归分析,年龄、吸烟、糖尿病史、UA、ABI是下肢动脉粥样硬化的独立危险因素(P均<0.01),其中ABI与其呈负相关。
与下肢动脉粥样硬化严重程度相关的危险因素(表5):以下肢动脉粥样硬化严重程度为因变量,以各危险因素为自变量进行有序多分类Logistic回归分析,年龄、男性、吸烟、ABI、UA、高血压病史与动脉硬化严重程度相关(P均<0.05)。
表1 不同年龄组间临床基线资料比较
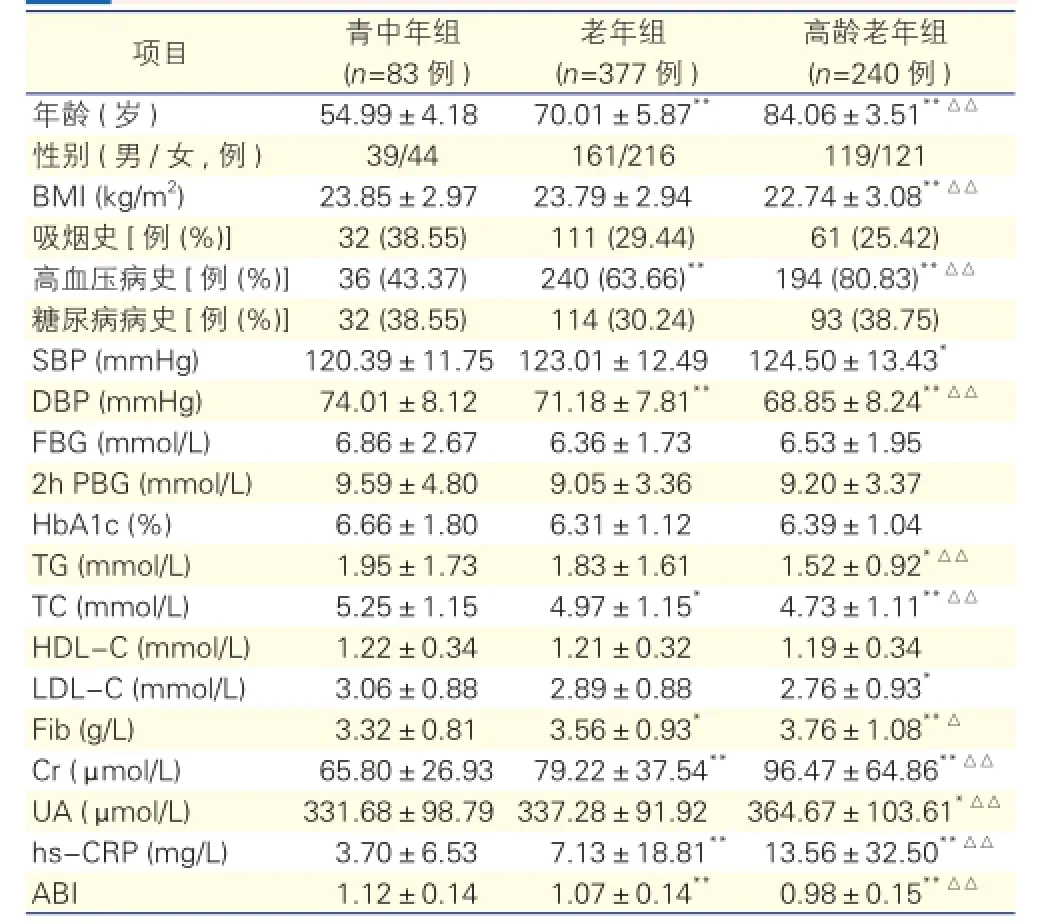
表1 不同年龄组间临床基线资料比较
注: BMI:体重指数; SBP:收缩压; DBP:舒张压; FBG:空腹血糖; 2 h PBG:早餐后2 h血糖; HbA1c:糖化血红蛋白; TG:甘油三酯; TC:胆固醇; HDL-C:高密度脂蛋白胆固醇; LDL-C:低密度脂蛋白胆固醇; Fib:血浆纤维蛋白原; Cr:血清肌酐; UA:尿酸; hs-CRP:超敏C反应蛋白; ABI:踝肱指数。与青中年组比较*P<0.05**P<0.01;与老年组比较△P<0.05△△P<0.01。1 mmHg=0.133 kPa
?
表2 不同程度下肢动脉粥样硬化基线资料比较
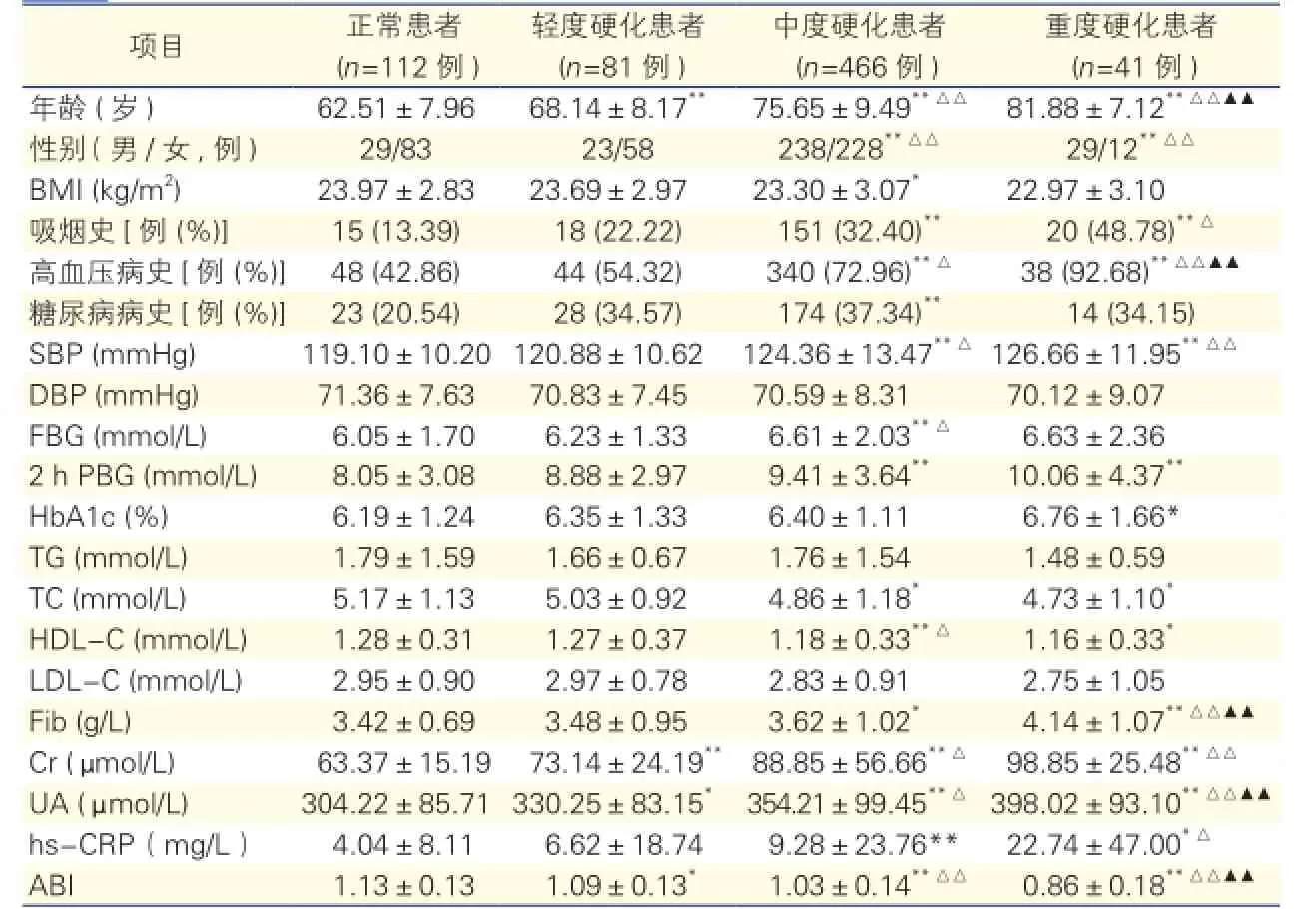
表2 不同程度下肢动脉粥样硬化基线资料比较
注:根据下肢动脉彩色多普勒超声结果将其硬化严重程度评分:0分为正常;<10分为轻度;10~19分为中度;≥20分为重度。与正常患者比较*P<0.05**P<0.01;与轻度硬化患者比较△P<0.05△△P<0.01;与中度硬化患者比较▲▲P<0.01。余注见表1
?
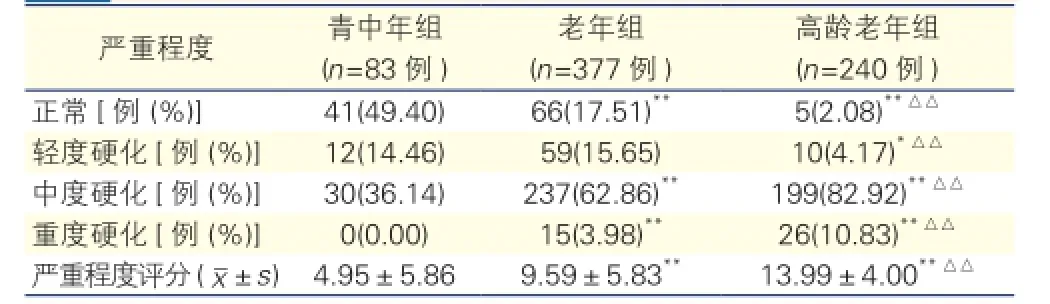
表3 不同年龄组下肢动脉粥样硬化严重程度比较
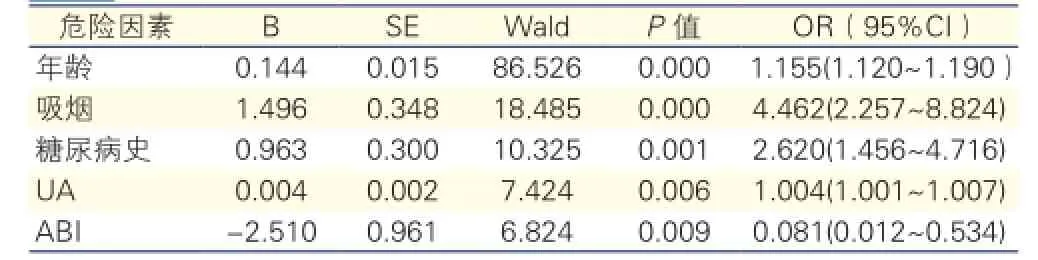
表4 各危险因素与下肢动脉粥样硬化的相关性
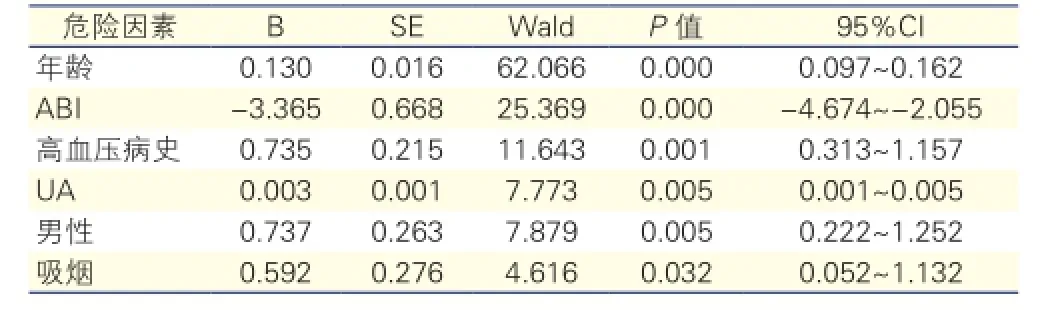
表5 下肢动脉粥样硬化严重程度相关的危险因素 (有序多分类Logistic回归分析)
3 讨论
本研究通过彩色多普勒超声检测下肢动脉内膜厚度、硬化程度、斑块及狭窄,诊断LEAD并按其严重程度分组,着重对高龄老年及不同程度动脉硬化人群进行分析研究,探讨其特点及危险因素分布。
本研究显示,年龄越大,动脉硬化严重程度评分越高;老年、高龄老年组中、重度硬化病变率明显较高;多因素回归分析显示增龄是下肢动脉粥样硬化的独立危险因素,且与其严重程度密切相关。伴随增龄,血管弹性减退,内皮细胞逐渐凋亡、内皮功能下降;合并心血管及代谢性疾病渐增多,协同促进动脉粥样硬化的发生与发展。因此,增龄是动脉粥样硬化不可控制的危险因素。
本研究发现,中、重度下肢动脉硬化患者男性百分比显著高于正常及轻度硬化患者,有序多分类回归分析亦显示男性与动脉硬化严重程度呈正相关。Framingham研究显示,男性下肢动脉硬化闭塞症患病率相对高于同龄女性。其致动脉粥样硬化可能与男性睾酮水平有关,老年睾酮水平降低,低睾酮水平可降低血管内皮功能而促发动脉粥样硬化[6]。研究表明血睾酮水平与TC、TG、LDL-C、脂蛋白(a)呈负相关[7],均可促进动脉粥样硬化的形成。
本研究显示,中、重度下肢动脉硬化患者吸烟率明显较高,多因素Logistic回归分析示吸烟与下肢动脉粥样硬化及其严重程度密切相关。香烟中的有害物质使血管内皮功能受损,合成释放一氧化氮减少,内皮依赖性血管舒张功能受损,同时可促进血小板聚集、黏附和纤维蛋白原沉积[8],诱发动脉粥样硬化。亦有研究提出吸烟可促进TC在动脉内膜下沉积,同时降低HDL-C水平[9],协同促进动脉粥样硬化的形成与发展。Framingham研究强调,吸烟者外周动脉粥样硬化性疾病的发生率是非吸烟者的2~4倍。
高血压是冠心病、脑卒中、动脉粥样硬化的主要危险因素。本研究中,高血压患病率随增龄上升,合并下肢动脉硬化严重程度加剧。老年、高龄老年组高血压患病率较青中年组增加,高龄老年组高血压患病率亦较老年组增加;中、重度下肢动脉硬化患者高血压患病率较正常及轻度硬化者高,重度硬化患者高血压患病率亦较中度硬化者高,且以收缩压升高为主。有序多分类Logistic回归分析显示高血压与动脉粥样硬化严重程度密切相关。Framingham研究报道在男性高血压患者中外周动脉粥样硬化疾病患病率为非高血压患者的2.5倍,女性为3.9倍。
本研究发现,中度下肢动脉硬化患者糖尿病患病率、FBG、2h PBG较正常患者高,重度硬化患者2h PBG、HbA1c较正常患者高,提示血糖控制不良会促进下肢动脉粥样硬化的发生。多因素Logistic回归分析亦显示糖尿病是下肢动脉粥样硬化的独立危险因素。糖尿病引起动脉硬化是一个长期、慢性的过程,其机制可能是:血糖升高,氧化应激性增加,大量自由基产生致血管内皮细胞功能障碍,强化白细胞与内皮细胞间的相互作用,低密度脂蛋白氧化和糖基化及糖基化终产物沉积引起的一系列连锁反应[10]。糖尿病患者下肢血管疾病患病率是非糖尿病患者的20倍[11]。
本研究中,随增龄及动脉硬化程度加重,TG、TC、LDL-C呈降低趋势,与既往高血脂引起动脉粥样硬化的结论不符,其原因可能与绝大多数老年人既往合并高脂血症或动脉硬化性疾病长期服用调脂药物有关。研究认为高血脂可引起内膜增厚,内弹力板部分断裂,内膜下脂质和胶原纤维沉积、泡沫细胞和炎性细胞浸润、平滑肌细胞迁移、增生,这是动脉粥样硬化的病理表现,也是血管重塑的病理学基础[12]。本研究HDL-C随增龄、动脉硬化程度加重而渐降低,中、
重度动脉硬化患者明显低于正常患者。HDL-C将胆固醇逆向运输至肝脏降解,降低胆固醇水平,从而抵抗动脉粥样硬化,HDL-C降低致血管内皮细胞中胆固醇积聚,加速动脉粥样硬化的形成与发展。
ABI公认为下肢血管疾病的早期筛查、诊断方法,本研究进一步验证了其可靠性及与彩色超声诊断的一致性。本研究发现,随增龄、下肢动脉硬化严重程度加重,ABI明显降低,Logistic回归分析亦提示其与下肢动脉粥样硬化呈负相关。
此外,本研究可见随增龄、下肢动脉硬化严重程度加重,UA、Cr、Fib、hs-CRP渐升高,多因素Logistic回归分析显示UA是下肢动脉粥样硬化的独立危险因素,且与其严重程度相关。上述因素均是动脉粥样硬化性疾病常见危险因子,通过多种途径参与其发生、发展。
动脉粥样硬化被视为一种与衰老相关的疾病,本研究特别关注高龄老年人这一特殊群体,表2中可见高龄老年组高血压患病率明显升高,呈SBP升高、DBP降低,符合老年人以收缩压升高为主,脉压差增大的特点;UA、Cr、Fib、hs-CRP亦显著升高,如上所述,它们协同促进下肢动脉粥样硬化的发生与发展。高龄老年人下肢动脉粥样硬化除上述传统危险因素外,与细胞生理性老化亦相关,动脉粥样硬化斑块作为细胞衰老的证据显示其特征为细胞增殖减少,不可逆的细胞生长停滞和凋亡,DNA损伤升高,端粒缩短和功能障碍,细胞衰老促进动脉粥样硬化的进展[13]。炎症反应学说作为动脉粥样硬化的发病机理之一,衰老与动脉壁炎症活动的增强亦有关,伴随增龄血管黏附分子1(VCAM-1)水平显著升高,VCAM-1表达的内皮细胞介导单核细胞粘附和聚集于内皮边缘,参与动脉粥样硬化的形成[14]。平滑肌细胞(VSMCs)增殖是动脉粥样硬化的一个关键性事件,老化使VSMCs从中膜迁移积聚到血管内膜,致动脉内膜增厚诱发动脉粥样硬化;VSMCs属性改变是动脉壁病理学的重要事件,它导致随老化引起的血管重塑和功能下降,促进动脉粥样硬化的进展[15]。动物实验表明,血液中来源于骨髓的内皮祖细胞随年龄增长而渐耗竭,致内皮祖细胞修复内皮损伤的能力下降,更易形成动脉粥样斑块,促发动脉粥样硬化性疾病[16]。综上,高龄老年人群受多重传统危险因素和衰老引起机体本身的病理生理学改变的影响,致下肢动脉粥样硬化加重。
本研究的局限性:因大多受试者合并高血压、糖尿病、冠心病、高脂血症等慢性疾病,在入院前及住院期间均按相应适应症不同程度地接受调脂药物、血管扩张药物、抗血小板药物、降糖药物等治疗,所以上述药物对动脉粥样硬化的影响及相关性难以衡量。
综上所述,本研究发现老年人下肢动脉粥样硬化与多种心血管危险因素相关。增龄、吸烟、糖尿病史、UA、ABI是下肢动脉粥样硬化的独立危险因素,且高龄、男性、吸烟、UA、ABI、高血压病史与其严重程度相关。控制上述危险因素对延缓乃至逆转下肢动脉硬化的发展尤为重要,将降低其致残率、致死率,进而提高老年下肢动脉粥样硬化患者生活质量与期望寿命。
[1] Grundy SM, Cleeman JI, Merz CN, et a1. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III Guidelines. Circulation, 2004, 110: 227-239.
[2] 中华医学会老年医学分会;中华医学会外科学分会血管外科专业组;中华老年医学杂志编辑委员会;老年人四肢动脉粥样硬化性疾病诊治中国专家建议(2012). 中华老年医学杂志, 2013, 32: 121-131.
[3] 中国医师协会超声医师分会-血管和浅表器官超声检查指南(2011). 北京: 人民军医出版社, 2011: 23-28.
[4] Touboul PJ, hennerici MG, Meairs S, et al. Mannheim carotid intimamedia thickness consensus (2004-2006-2011). Cerebrovasc Dis, 2012, 34: 290-296.
[5] 潘长玉, 高研, 袁申元, 等.2型糖尿病患者下肢血管病变发生率及相关因素调查. 中国糖尿病杂志, 2001, 9: 323-326.
[6] Kienitz T, Quinkler M. Testosterone and blood pressure regulation. Kidney Blood Press Res, 2008, 31: 71-79.
[7] Schatzl G, Masersbacher S, Temml C, et al. Serum androgen levels in men: impact of health status and age. Urology, 2003, 61: 629-633.
[8] Pope CA 3rd, Burnett RT, Krewski D, et al. Cardiovascular mortality and exposure to airborne fine particulate matter and cigarette smoke: shape of the exposure-response relationship. Circulation, 2009, 120: 941-948.
[9] 罗甜甜, 孙海阁, 习丹, 等. 吸烟影响高密度脂蛋白代谢致动脉粥样硬化的新机制. 中国循环杂志, 2014, 29: 149-151.
[10] Yamagishi S. Role of advanced glycation end products (AGE) and soluble receptor for AGE (sRAGE) in vascular complications in diabetes. Nihon Rinsho. 2012, 70(Supp5): 243-247.
[11] Guo X, Shi Y, Huang X, et al. Features analysis of lower extremity arterial lesions in 162 diabetes patients. J Diabetes Res, 2013, 2013: 781360.
[12] 韩琼, 李燕燕, 杜菲, 等. 脂多糖诱导高脂家兔动脉血管重塑的研究. 中国循环杂志, 2014, 6: 466-470.
[13] Wang JC, Bennett M. Aging and atherosclerosis: mechanisms, functional consequences, and potential therapeutics for cellular senescence. Circ Res, 2012, 111: 245-259.
[14] Li Y, Gilbert TR, Matsumoto AH, et al. Effect of aging on fatty streak formation in a diet-induced mouse model of atherosclerosis. J Vasc Res, 2008, 45: 205-210.
[15] Orlandi A, Bochaton-Piallat ML, Gabbiani G, et al. Aging, smooth muscle cells and vascular pathobiology: implications for atherosclerosis. Atherosclerosis, 2006, 188: 221-230.
[16] Rauscher FM, Goldschmidt-Clermont PJ, Davis BH, et al. Aging, progenitor cell exhaustion, and atherosclerosis. Circulation, 2003, 108: 457-463.
Relationship Between Lower Extremity Atherosclerosis and Cardiovascular Risk Factors in Elder People
LIU Qin, KE Da-zhi, CHEN Qing-wei, LI Gui-qiong, DENG Wei.
Department of Geriatrics Cardiology, Second Affliated Hospital of Chongqing Medical University, Chongqing (400010), China
Objective: To explore the relationship between lower extremity atherosclerosis disease (LEAD) and cardiovascular risk factors in elder people.
Elder people; Lower extremity atherosclerosis; Cardiovascular risk factors; Color Doppler ultrasound
2015-03-03)
(编辑:汪碧蓉)
重庆市卫计委医学科研项目(NO:07-2-103,NO:2015MSXM019)
400010 重庆市,重庆医科大学附属第二医院 老年心血管科
刘琴 硕士研究生 主要从事老年心血管疾病的基础与临床研究 Email:liuqincq@163.com 通讯作者:柯大智 Email:kedazhili@163.com
R54
A
1000-3614(2015)11-1076-05
10.3969/j.issn.1000-3614.2015.11.011
