短短芽孢杆菌降解芘的细胞毒性分析
2015-12-06廖丽萍尹华刘芷辰叶锦韶彭辉刘则华
廖丽萍,尹华,刘芷辰,叶锦韶,彭辉,刘则华
1. 暨南大学环境学院,广东省高校水土环境毒害性污染物防治与生物修复重点实验室,广东 广州 510632;2. 华南理工大学环境与能源学院,工业聚集区污染控制与生态修复教育部重点实验室,广东 广州 5100062;3. 暨南大学化学系,广东 广州 510632
短短芽孢杆菌降解芘的细胞毒性分析
廖丽萍1,尹华2*,刘芷辰1,叶锦韶1,彭辉3*,刘则华2
1. 暨南大学环境学院,广东省高校水土环境毒害性污染物防治与生物修复重点实验室,广东 广州 510632;2. 华南理工大学环境与能源学院,工业聚集区污染控制与生态修复教育部重点实验室,广东 广州 5100062;3. 暨南大学化学系,广东 广州 510632
近年来国内外对芘微生物降解过程中的菌种选育、降解性能和降解产物分析等相关报道较多,但针对芘降解菌与芘的分子作用机制研究却不多见。为了探明降解菌短短芽孢杆菌(Brevibacillus brevis)与芘的分子作用机制,考察了 B. brevis对质量浓度为1.0 mg·L-1的芘的生物降解,分析了在无机盐培养基中B. brevis与芘作用过程中,其细胞凋亡规律及膜电位的变化,以期从细胞毒性的角度揭示PAHs的微生物降解机理。实验结果显示芘的降解率随着处理时间的增加而呈上升趋势,B. brevis对芘的降解率在168 h达到56.5%。在芘的降解过程中,细胞出现显著的凋亡现象,细胞总凋亡率与细胞早期凋亡率均在48 h时达到峰值,之后均随时间的延长而下降,168 h时细胞早期凋亡率与总凋亡率均小于0.5%,菌体依然对芘具有降解能力。随着细胞凋亡的发生,细胞膜电位下降,即细胞膜电位发生去极化现象,说明细胞外的芘与 K+共转运进入细胞内,从而有助于菌体对芘的吸收与降解。
芘;微生物降解;细胞凋亡;细胞膜电位
芘(pyrene)是多环芳烃(polycyclic aromatic hydrocarbons, PAHs)的四环代表物,属难降解有机污染物(Lu等,2014),在环境中广泛存在,可通过呼吸道、消化道、皮肤等途径进入人体,破坏人体的免疫系统(Song等,2012),已被列入具有致癌性的PAHs之列。
微生物降解被认为是去除环境中PAHs的主要途径,许多细菌、真菌、藻类及胞外聚合物具有降解PAHs的能力(Ashour等,2008;Chen 和Ding,2012;Whitman等,1997)。关于PAHs的微生物降解,目前主要侧重于菌种选育、降解性能优化和降解产物分析等方面(Balachandran等,2012;Chen等,2010;蔡翰等,2013)。对于PAHs微生物降解过程中降解菌与污染物的分子作用机制研究还有待深入。为了阐明PAHs微生物降解机理,对菌体降解PAHs过程细胞毒性的变化开展分析,有利于从生命代谢的角度揭示PAHs的降解机制。本研究利用课题组前期筛选的PAHs高效降解菌开展芘的微生物降解,考察降解菌与芘之间的相互作用,分析菌体降解芘过程中芘对菌体细胞毒性的影响,以期为更深入阐明PAHs微生物降解机理奠定基础。
1 材料与方法
1.1 实验材料
实验菌种:芘降解菌短短芽孢杆菌(Brevibacillus brevis)由本课题组于受多环芳烃污染的环境筛选获得。
芘储备液:用色谱纯甲醇溶解芘,配制成 100 mg·L-1的储备液,4 ℃保存待用。芘使用液:用储备液配制成1.0 mg·L-1的使用液。
牛肉膏蛋白胨培养基(g·L-1):牛肉膏3,蛋白胨10,NaCl 5。pH7.2~7.4。固体培养基加琼脂1.5%~2.0%,用于菌株的分离富集及扩大培养。
无机盐培养基(MSM)(mg·L-1):K2HPO450,KH2PO430,MgSO4·7 H2O 10,柠檬酸钠50。
磷酸盐缓冲液(PBS)(g·L-1):K2HPO40.24,Na2HPO41.44,NaCl 8.0,KCl 0.2,调节pH=7.4。
1.2 实验方法
1.2.1 芘降解实验
在灭菌无机盐培养基中加入芘储备液与菌液,配成20 mL降解体系,并使芘的浓度为1.0 mg·L-1,菌浓度为1.0 g·L-1。于30 ℃ 130 r·min-1避光处理,分别在第24、48、72、96、120、168 h取样测定芘残余量。以不加菌为空白对照。所有实验做3个平行,取平均值计算,并根据平均值计算标准偏差SD。
降解率=(对照组残余量-样品组残余量)/对照组残余量×100%
1.2.2 芘的分析方法
取出样品后,用6.0 mol·L-1HCl调节pH至2,样品转入125 mL分液漏斗,加入等体积的乙酸乙酯萃取,充分混合后静置分层,收集有机相。重复上述操作,萃取两次,合并有机相,过无水硫酸钠,收集于梨形瓶中,用旋转蒸发仪于 35 ℃蒸干,最后用流动相洗涤浓缩定容至 10 mL,利用 HPLC(LC-20A,日本岛津)进行芘检测。检测条件:分离柱为InertsilODSSP C18柱(5 μm、4.6×250 mm);使用紫外检测器,检测波长254 nm;流动相V甲醇∶V水=90∶10,流速为1 mL·min-1;保留时间为4.8 min;进样量20 μL。芘的检测限为5 μg·L-1。
1.2.3 B. brevis 降解芘过程中细胞凋亡检测
离心收集处理芘24、48、72、96、120、168 h的菌体,利用15.0 mg·L-1溶菌酶去除细胞壁,PBS重悬,离心收集原生质体,通过稀释使细胞浓度约为106个·mL-1。加入200 μL Binding Buffer重悬后用10 μL Annexin V-FITC染色,室温避光反应10 min;6000 r·min-1离心5 min收集沉淀,用200 μL Binding Buffer重悬后加入 10 μL 碘化丙啶(Propidium Iodide,PI)避光染色,用流式细胞仪检测。流式细胞仪激发波长为425 nm,异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)的荧光检测波长为525 nm,PI的检测波长为630 nm。以不加污染物为对照组,对照组菌体分出200 μL不染色作空白参照。
1.2.4 B. brevis 降解芘过程中细胞膜电位检测
收集培养24、48、72、96、120、168 h的菌体,PBS重悬,稀释样品使细胞浓度约为106个·mL-1。加 入 200 μL Tetrechloro-tetraethylbenzimidazol carbocyanine iodide(JC-1)37 ℃避光染色15 min,用流式细胞仪检测。流式细胞仪的激发波长为 488 nm,JC-1的荧光检测波长为530和590 nm。以不加芘为对照组。
2 结果与讨论
2.1 芘的降解
芘在MSM体系中的降解情况如图1所示,在MSM 体系中,芘的降解率随着处理时间的增加而呈上升趋势。24 h时,B. brevis对芘的降解率只有3.0%,这主要是由于菌体要通过细胞壁的吸附、跨膜运输等作用才能把芘积累到细胞内(Ye等,2014),该运输过程缓慢,导致细胞内降解酶与芘的接触机会较少(叶锦韶等,2010)。当降解时间为48~96 h时,芘的降解速率较快,降解率显著提高,胞内酶在该阶段起了主要的作用。120~168 h时,菌体对芘的降解速率开始下降,但菌体对芘依然具有降解能力,168 h时芘的降解率达到56.5%。这个阶段细胞壁和细胞膜的结构因芘的作用而发生了改变,部分胞内物质流失(蔡翰等,2013),但细胞并未失去活性,细胞仍能产生相应的酶对芘进行分解利用。
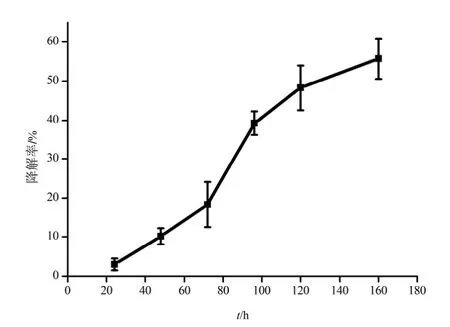
图1 B. brevis对芘的降解Fig. 1 Pyrene biodegradation by B. brevis
2.2 B. brevis 降解芘过程中细胞凋亡规律
为了进一步研究在芘的降解过程中菌体活性的变化,运用流式细胞术测定了菌体细胞的凋亡变化。细胞凋亡早期的变化发生在细胞膜表面,细胞膜表面的变化之一是磷脂酰丝氨酸(PS)从细胞膜内侧转移到细胞膜外。Annexin V是一种分子量为35~36 kD的Ca2+依赖性磷脂结合蛋白,可通过细胞外侧暴露的PS与凋亡早期细胞的胞膜结合。因此Annexin V被作为检测细胞早期凋亡的灵敏指标之一。将 Annexin V进行 FITC标记,以标记了的Annexin V作为荧光探针,利用流式细胞仪可检测细胞早期凋亡的发生。PI是一种核酸染料,它不能透过完整的细胞膜,但对凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核染红。因此将Annexin V与PI匹配使用,可将处于不同凋亡时期的细胞区分开来(Qin等,2015)。
图2为菌体降解芘48 h时的细胞凋亡散点图,其中Q1表示既与PI作用,也与Annexin V作用的粒子,主要指坏死细胞;Q2表示与PI作用,但不与 Annexin V作用的粒子,即晚期凋亡细胞;Q3表示既不与PI作用,也不与Annexin V作用的粒子,即活细胞;Q4表示不与PI作用,但与Annexin V作用的粒子,指早期凋亡细胞。从图2可以看出,在芘的胁迫下,部分细胞处于Q2(晚凋)和Q4(早凋)区,发生自身凋亡,细胞膜基团发生改变。
图3为芘降解过程中细胞早期凋亡率与细胞总凋亡率随时间的变化情况。B. brevis降解芘20~48 h时,细胞的早期凋亡率显著增多,且明显大于空白对照组。48 h达到峰值;随后48~96 h,细胞的早期凋亡率显著减少;96~168 h,凋亡速率放缓。该结果表明在降解过程中,芘能够诱导菌体细胞的凋亡。在芘的胁迫下,菌体出现凋亡现象,细胞表面基团发生了变化,表面疏水性增强(Li和 Zhu,2012),同时使细胞表面的芘进入细胞内。通过胞内酶的作用,芘逐渐被降解。同时,细胞的凋亡会造成胞内核酸酶的释放,核酸酶将遗传物质分解成小的片段,DNA的变化使得调控菌体降解的某些功能蛋白被表达或表达量增多(Wu等,2009),也促进了菌体对芘的降解作用。故48~96 h时,菌体对芘的降解速率较快。120 h时,细胞早期凋亡率与总凋亡率均显著减小,168 h时细胞早期凋亡率与总凋亡率均小于0.5%。该结果表明随着菌体对环境的适应,菌体能够利用凋亡细胞流出的离子、蛋白、糖类等胞内物质以及芘作为能源,进行生长代谢(Chen等,2010;叶锦韶等,2014),使活性菌体的比例逐渐增多,因此菌体依旧能够产生与降解有关的酶,对残留的芘进行降解。
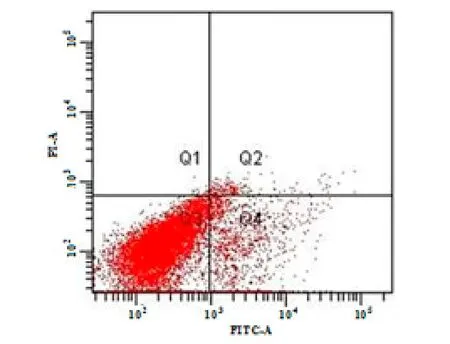
图2 B. brevis降解芘48 h时的细胞凋亡散点图Fig. 2 Cell apoptosis scatter plot of B. brevis after pyrene degradation for 48 h
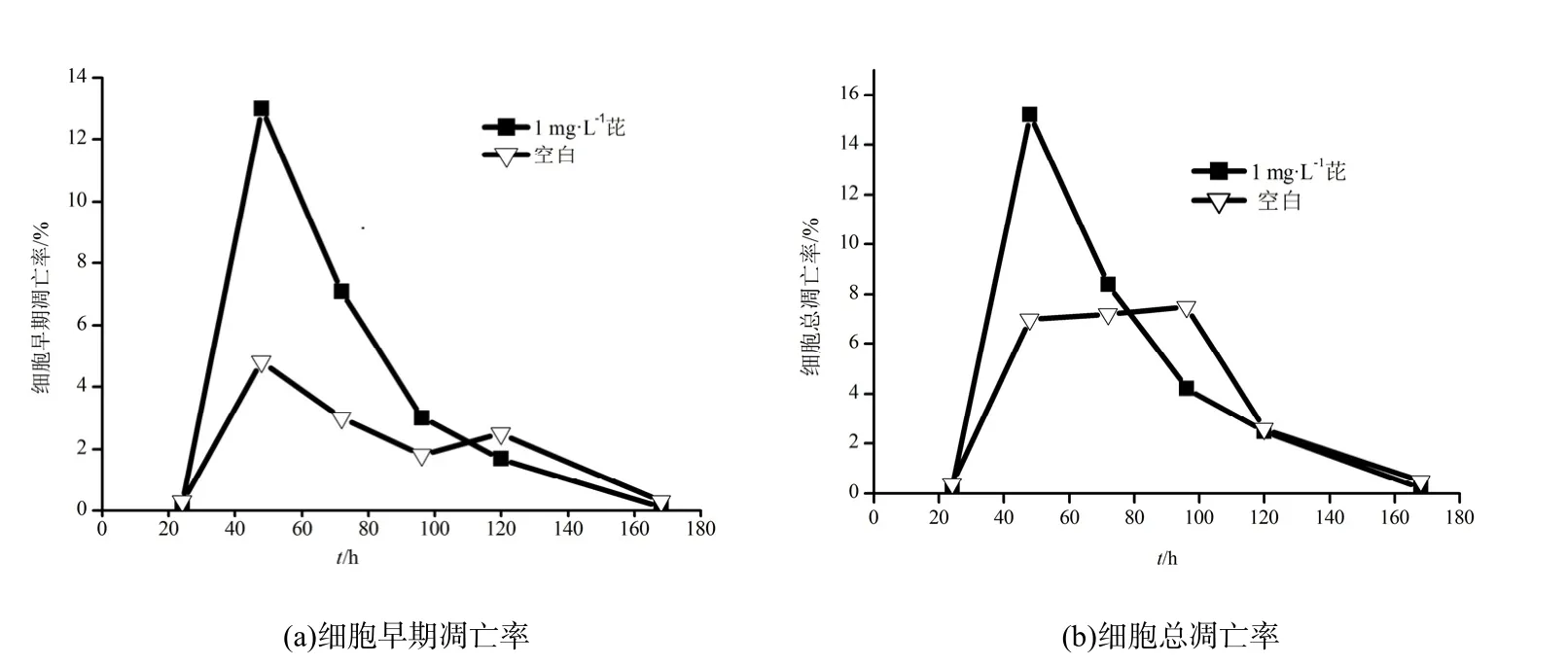
图3 B. brevis降解芘过程中细胞凋亡的变化Fig. 3 Change of bacterium apoptosis during pyrene degradation
2.3 B. brevis降解芘过程中细胞膜电位的变化
在细胞凋亡的过程中往往伴随着跨膜电位的破坏,这被认为是细胞凋亡过程中最早发生的现象之一。荧光探针 JC-1是一种阳离子型的亲脂性染料,能够自由穿过细胞膜,与胞浆结合。膜电位高时,JC-1通过细胞膜极性进入细胞体内,并因浓度升高而形成发射红色荧光的多聚体;膜电位降低时,发生去极化现象,JC-1从细胞体内释放,浓度降低,逆转为发射绿色荧光的单体形式。故而通过绿色和红色荧光强度的比值可定量检测细胞膜电位的变化(Qin等,2014)。
菌体降解芘过程中细胞膜电位随时间的变化如图4。从图中可以看出,第24~96 h期间,细胞膜电位呈快速的下降趋势,且明显小于对照组。该结果表明,在芘的降解过程,细胞膜电位发生去极化现象。研究表明,细胞膜电位的变化与细胞内外Na+、K+的变化密切相关(Volkov等,2011)。细胞发生凋亡时,细胞膜的完整性被破坏,细胞膜通透性增大(Chen等,2014),细胞内的Na+逐渐释放到细胞外,细胞外的K+不断通过K+-ATP酶离子泵运输到细胞内,细胞内高K+、低 Na+,造成细胞外环境为高Na+、低K+(何宝燕等,2007),从而导致细胞膜电位下降。芘是一个不带电荷的分子,可与胞外K+共转运进入细胞内,因此,膜电位的去极化促进细胞对芘的吸收与降解(Yin等,2014)。120 h后,细胞内外的Na+、K+处于平衡状态,故膜电位去极化程度减弱,菌体对芘的吸收与降解速率也减缓。
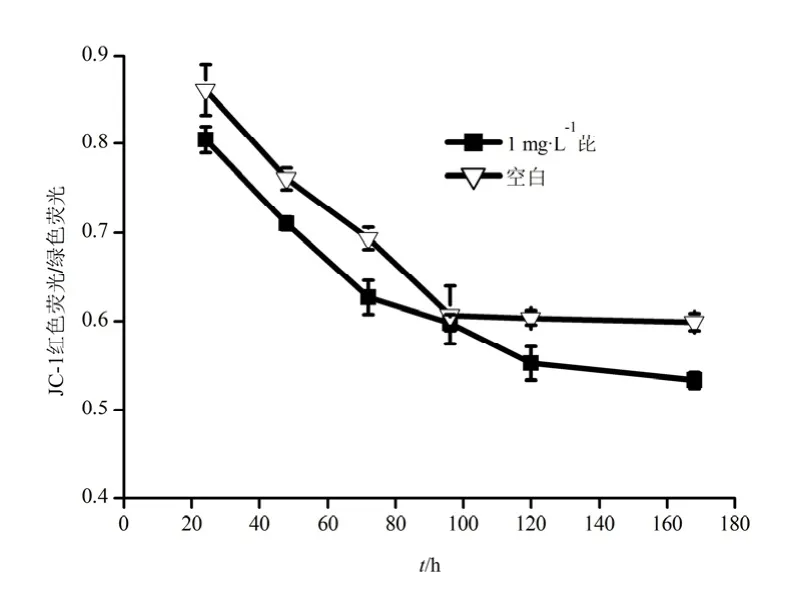
图4 B. brevis降解芘过程中细胞膜电位的变化Fig. 4 Change of membrane potential during pyrene degradation by B. brevis
3 结论
(1)B. brevis对芘的降解率在168 h达到56.5%。
(2)在芘的降解过程中,细胞出现显著的凋亡现象,促进了菌体对芘的降解。168 h时细胞早期凋亡率与总凋亡率均小于0.5%,菌体依然对芘具有较强的降解能力。
(3)随着细胞凋亡的发生,细胞膜电位发生去极化现象,促进了细胞对芘的吸收与降解。
ASHOUR L, AL-RUB F A, SHEIKHA D, et al. 2008. Biosorption of naphthalene from refinery simulated waste-water on blank alginate beads and immobilized dead algal cells[J]. Separation Science and Technology, 43: 2208-2224.
BALACHANDRAN C, DURAIPANDIYAN V, BALAKRISHNA K, et al. 2012. Petroleum and polycyclic aromatic hydrocarbons (PAHs) degradation and naphthalene metabolism in Streptomyces sp. (ERI-CPDA-1) isolated from oil contaminated soil[J]. Bioresource Technology, 112: 83-90.
CHEN B L, DING J. 2012. Biosorption and biodegradation of phenanthrene and pyrene in sterilized and unsterilized soil slurry systems stimulated by Phanerochaete chrysosporium[J]. Journal of Hazardous Materials, 229-230: 159-169.
CHEN B L, WANG Y S, HU D F. Biosorption and biodegradation of polycyclic aromatic hydrocarbons in aqueous solutions by a consortium of white-rot fungi[J]. Journal of Hazardous Materials, 179(1-3): 845-851.
CHEN S N, YIN H, YE J S, et al. 2014. Influence of co-existed benzo[a]pyrene and copper on the cellular characteristics of Stenotrophomonas maltophilia during biodegradation and transformation[J]. Bioresource Technology, 158: 181-187.
LI F, ZHU L Z. 2012. Effect of surfactant-induced cell surface modifications on electron transport system and catechol 1,2-dioxygenase activities and phenanthrene biodegradation by Citrobacter sp. SA01[J]. Bioresource Technology, 123: 42-48.
LU J, GUO C L, ZHANG M L, et al. 2014. Biodegradation of single pyrene and mixtures of pyrene by a fusant bacterial strain F14[J]. International Biodeterioration & Biodegration, 87: 75-80.
QIN Q P, CHEN Z F, QIN J L, et al. 2015. Studies on antitumor mechanism of two planar platinum(II) complexes with 8-hydroxyquinoline: Synthesis, characterization, cytotoxicity, cell cycle and apoptosis[J]. European Journal of Medicinal Chemistry, 92: 302-313.
QIN Q P, LI Y L, LIU Y C, et al. 2014. Synthesis, crystal structure, cytotoxicity and cell apoptosis induction of a copper(II)-based Schiff base complex[J]. Inorganica Chimica Acta, 421:260-266.
SONG M K, SONG M, CHOI H S, et al. 2012. Identification of molecular signatures predicting the carcinogenicity of polycyclic aromatic hydrocarbons (PAHs)[J]. Toxicology Letters, 212(1): 18-28.
VOLKOV E M, NURULLIN L F, VOLKOV M E, et al. 2011. Mechanisms of carbacholine and GABA action on resting membrane potential and Na+/K+-ATPase of Lumbricus terrestris body wall muscles[J]. Comparative Biochemistry and Physiology, Part A, 158(4): 520-524.
WHITMAN B E, MIHELEIE J R, LUEKING D R. 1997. Naphthalene biosorption in soil water systems of low or high sorptive capacity[J]. Applied Microbiology and Biotechnology, 43(3): 529-544.
WU Y R, HE T T, ZHONG M Q, et al. 2009. Isolation of marine benzo[a]pyrene-degrading Ochrobactrum sp. BAP5 and proteins characterization[J]. Journal of Environmental Sciences, 21: 1446-1451.
YE J S, ZHAO H J, YIN H, et al. 2014. Triphenyltin biodegradation and intracellular material release by Brevibacillus brevis[J]. Chemosphere, 105: 62-67.
YIN X M, LIANG X, XU G H, et al. 2014. Effect of phenanthrene uptake on membrane potential in roots of soybean, wheat and carrot[J]. Environmental and Experimental Botany, 99: 53-58.
蔡瀚, 尹华, 叶锦韶, 等. 2013. 1株苯并[a]芘高效降解菌的筛选与降解特性[J]. 环境科学, 34(4): 1937-1944.
何宝燕, 尹华, 彭辉, 等. 2007. 酵母菌吸附重金属铬的生理代谢机理及细胞形貌分析[J]. 环境科学, 28(1): 194-198.
叶锦韶, 史一枝, 尹华等. 2010. 克雷伯氏菌对三苯基锡的酶促降解特性[J]. 环境科学, 31(2): 459-464.
Cytotoxicity Assay of Pyrene Biodegradation by Brevibacillus brevis
LIAO Liping1, YIN Hua2*, LIU Zhichen1, YE Jinshao1, PENG Hui3*, LIU Zehua2
1. Key Laboratory of Water/Soil Toxic Pollutants Control and Bioremediation of Guangdong Higher Education Institutes, School of Environment, Jinan University, Guangzhou 510632, China; 2. Key Laboratory of Ministry of Education on Pollution Control and Ecosystem Restoration in Industry Clusters, School of Environment and Energy, South China University of Technology, Guangzhou 510006, China; 3.Department of Chemistry, Jinan University, Guangzhou 510632, China
Although there have been many reports on the isolation of pyrene degrading stains, pyrene degradation characteristics and its catabolites, the information regarding molecular mechanism between degrading bacteria and pyrene is limited thus far. To explore the molecular mechanism between degrading bacterium Brevibacillus brevis and pyrene, the biodegradation of pyrene (1.0 mg·L-1) by B. brevis, as well as the cell apoptosis and changes of membrane potential of B. brevis under pyrene exposure in mineral salt medium (MSM) was conducted to reveal the mechanism of pyrene biodegradation from the perspective of cytotoxicity. The experimental results showed that pyrene degradation efficiency increased with time. And the biodegradation efficiency of pyrene by B. brevis reached 56.5% after 168 h. In the degradation process, pyrene significantly induced the cell apoptosis. Both the total percentage of apoptotic cells and the percentage of apoptotic cells in the early stage reached their peak values on the 48th h, and decreased thereafter with the extension of time. The total percentage of apoptotic cells and the percentage of apoptotic cells in the early stage were all less than 5% at 168 h, which revealed that B. brevis at this stage still had degradation capability for pyrene. Moreover, as the apoptosis occurred, cell membrane potential declined evidently, which meant that cell membrane potential was depolarized. This result implied that extracellular pyrene and K+co-transported into the cells, thus promoting the uptake and degradation of pyrene.
pyrene; biodegradation; cell apoptosis; membrane potential
10.16258/j.cnki.1674-5906.2015.03.020
X171.5
A
1674-5906(2015)03-0501-04
廖丽萍,尹华,刘芷辰,叶锦韶,彭辉,刘则华. 短短芽孢杆菌降解芘的细胞毒性分析[J]. 生态环境学报, 2015, 24(3): 501-504.
LIAO Liping, YIN Hua, LIU Zhichen, YE Jinshao, PENG Hui, LIU Zehua. Cytotoxicity Assay of Pyrene Biodegradation by Brevibacillus brevis [J]. Ecology and Environmental Sciences, 2015, 24(3): 501-504.
国家自然科学基金委-广东省联合基金重点项目(U0933002);广东省自然科学基金重点项目(S2013020012808)
廖丽萍(1988年生),女,硕士研究生,主要研究方向为水污染控制与修复。E-mail:feather66@126.com *通讯联系人:尹华(1960年生),女,教授,博士生导师。研究方向:持久性有机污染物的治理与生物修复。E-mail:huayin@scut.edu.cn;tbpenghui@163.com
2015-01-22
