微卫星不稳定状态对Ⅳ期结直肠癌患者化疗反应性和预后的影响
2015-12-06吴宇辰张长胜梁斐黄丹朱骥徐烨刘方奇
吴宇辰,张长胜,梁斐,黄丹,朱骥,5,徐烨,刘方奇
1. 复旦大学附属肿瘤医院大肠外科,复旦大学上海医学院肿瘤学系,上海 200032;
2. 合肥市第二人民医院胃肠外科,安徽 合肥 230011;
3. 复旦大学附属肿瘤医院临床统计中心,复旦大学上海医学院肿瘤学系,上海 200032;
4. 复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032;
5. 复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
结直肠癌是我国第六大常见肿瘤,其致死率排名第五位[1]。相当一部分患者在诊断时已发生远处转移。对晚期结直肠癌患者,姑息手术,辅助放化疗以及单抗药物的应用可有效改善患者生活质量并延长生存[2]。因而,对化疗反应及预后的准确预测尤为重要。
DNA微卫星不稳定(microsatellite instability,MSI)是结直肠癌发病的重要原因[3]。它是指用于修复DNA复制错误的错配修复(mismatch repair,MMR)基因(MLH1、MSH2、MSH6、PMS1和PMS2)发生突变导致的DNA高度重复序列(微卫星)的增多,进而诱发肿瘤。它的机制包括:MLH1基因启动子部位的甲基化以及错配修复基因的遗传突 变。前者主要见于15%的散发性结直肠癌[4],而后者是遗传性非腺瘤性结直肠癌(hereditary non-polyposis colorectal cancer,HNPCC)的发病机制[5-6]。MSI状态有多重检测方法,其中免疫组化方法在诊断MSI状态有着方便,快速,价格相对低等优势,是目前临床医学运用的主要方式。Lindor等[7]的研究证实此方法拥有良好的灵敏度(>90%)及特异度(100%)
微卫星不稳定在预测肠癌患者预后及化疗反应方面也有重要作用。相较微卫星稳定(microsatellite stability,MSS)的肠癌,MSI患者多以Ⅱ,Ⅲ期肠癌为主,同时具有更长的总体生存时间(overall survival,OS)[8-9]。早期研究发现,对于肿瘤可切除的非晚期肠癌患者,M S I 患者能够从5-F U 为基础的化疗中获益[10-11]。但之后Ribic等[12]通过随机对照试验否定了上述结论,同时越来越多的研究也否定该结果[13-15]。因而,Ⅱ,Ⅲ期MSI患者无法从以5-FU为基础的化疗中获益已成共识。
由于MSI状态在晚期结直肠癌患者中比例较低,因而针对此类患者,其生存预测作用及与化疗敏感性的关系研究较少。Des Guetz等[16]的系统综述在评估近年所有MSI与晚期肠癌的研究认为MSI患者与MSS患者在对化疗的敏感性方面没有统计学差异,但由于该研究入组较少(6项),且由于化疗方案不尽相同故其相关结果仍颇具争议。
为了解微卫星状态对Ⅳ期结直肠癌患者预后的影响以及对以奥沙利铂联合5-FU为基础的一线化疗方案的敏感性,本研究回顾性分析此类患者的临床特征及预后,以期为晚期结直肠癌患者化疗指导及预后评估提供参考。
1 资料和方法
1.1 研究对象
入选条件:2008年3月—2012年3月复旦大学附属肿瘤医院收治的同时性或异时性Ⅳ期散发性结直肠癌患者;肠镜证实为结肠直肠癌;部分同时性Ⅳ期患者接受原发灶切除手术;经PET-CT、ECT、CT 和MR 影像学检查(一项或多项)证实有远处转移灶且转移灶均未接受手术或其他局部治疗;均接受以奥沙利铂联合5-FU为基础的一线化疗方案;有足够的组织标本行MMR蛋白表达检测评判微卫星状态。
1.2 姑息化疗方法
FOLFOX:奥沙利铂135 mg/m2,静脉滴注;第1天,亚叶酸钙 200 mg/m2;5-FU 400 mg/m2,推注2 h,后续600 mg/m2,静脉持续滴注48 h,第1~14天为1个周期。 XELOX:卡培他滨 1 000 mg/m2,口服,2次/日,第1~14天;奥沙利铂135 mg/m2,静脉滴注,第1~21天为1个周期。化疗后3、6个月,及化疗终止时进行评估,评估采用胸部,腹部及盆腔CT、MRI或PET/CT等影像学检查。后续二线治疗包括FOLFIRI方案(亚叶酸钙、5-FU及伊立替康联合),靶向药物(贝伐单抗或西妥昔单抗)等。
1.3 化疗反应性的评定标准
采用WHO实体肿瘤评价标准分为完全缓解(complete response,CR),部分缓解(partial response,PR),稳定(stable disease,SD),进展(progressive disease,PD),CR+PR为有效率,CR+PR+SD为疾病控制率。根据患者住院病史记录,登记其基本特征、疾病原发时间、肿瘤病理特征。后采用电话或门诊随访,末次随访时间为2015年2月。OS定义为从诊断为Ⅳ期肠癌至死亡或末次随访时间。在同时性Ⅳ期结直肠癌患者且行原发灶姑息切除手术患者中,无进展生存期(progression free survival,PFS)指从术后开始到患者出现肿瘤进展的时间。
1.4 微卫星不稳定分析
该研究采用免疫组化法检测肿瘤组织中错配修复基因MLH1、MSH2、MSH6及PMS2的表达。任何一项错配修复及因表达缺失,被定义为“微卫星不稳”。
术后肠癌组织固定,包埋,并制成石蜡切片。经烤片,脱蜡后,PBS清洗3次,每次3 min。切片经30%过氧化氢-甲醇混合液浸泡10 min后,放入加有柠檬酸钠的染缸,煮沸10 min,自然恢复至室温。PBS洗涤后将兔抗人MLH1、MSH2、MSH6及PMS2(Abcam,Cambridge,MA;USA)按1∶300稀释,50 μL滴至切片的组织上,将切片放于湿盒中,4 ℃过夜。后室温平衡30 min,用PBS缓冲液,洗涤3次,每次10 min,二抗于组织上,放于湿盒中,室温温育30 min。链霉素卵白素辣根过氧化物酶及DAB个30 min染色,水洗、吹干、树脂封片。镜检,若肿瘤组织阴性表达而正常黏膜阳性表达,表示有缺失,提示突变。MLH1、MSH2、MSH6或PMS2中任何一个基因蛋白的表达缺失,即认为MSI肿瘤,否则即为MSS。
1.5 统计学处理
使用SPSS 19.0统计软件进行分析。对两组数据基线资料及年龄行独立样本t检验,对性别、病理、化疗方案、分化程度、肿瘤部位、是否有远处淋巴结转移等采用χ2检验或者Fisher精确检验。Log-rank检验来比较两组患者之间PFS和OS之间的差异。采用Cox回归模型探索患者预后的影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1 患者微卫星不稳定状态与基本临床特征
共收集符合入选条件患者113例。其中同时性远处转移患者93例,既往原发灶切除的异时性远处转移患者20例。全部患者中MSI患者35例,MSS患者78例。
由于异时性远处转移患者人数相对较少,且存在既往肿瘤分期及治疗方案不同等不均一因素,为有效控制变量,我们进一步分组,筛选其中同时性远处转移且原发灶姑息性手术治疗的患者共79例,其中MSI患者22例,MSS患者57例。两组间各基本临床特征差异无统计学意义。
2.2 微卫星不稳定状态对患者预后的影响
根据微卫星不稳定状态将患者分为MSI组和MSS组,在样本中(113例),两组OS差异无统计学意义(P=0.607,图1)。通过进一步分组后,在79例同时性远处转移且原发灶姑息性切除的患者中,MSI患者的PFS显著优于MSS患者(P=0.005,图2A)。同时,MSI患者的OS显示优于MSS患者的趋势(P=0.07,图2B)。
2.3 同时性远处转移且原发灶姑息性切除患者预后多因素分析
基于上述结果,我们进一步将79例同时性远处转移且原发灶姑息性切除患者依据MSI状态、年龄、性别、病理及分化程度、肿瘤原发部位及转移部位分别纳入Cox多因素回归模型(表2)。
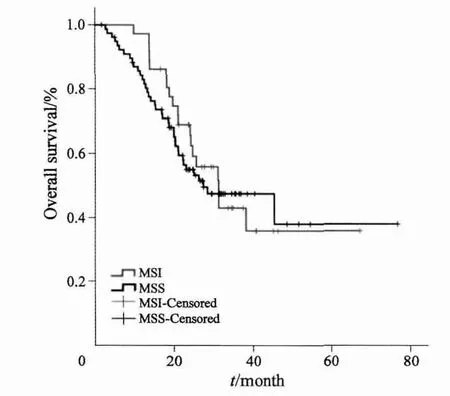
图1 113例患者MSI及MSS的总体生存曲线Fig. 1 Kaplan-Meier curves for overall survival of 113 patients with metastatic colorectal cancer stratifi ed by microsatellite status
在Cox模型中,肿瘤微卫星不稳定状态(P=0.043),肿瘤分化程度(P=0.021),右半结肠肿瘤(P=0.016)及远处淋巴结转移(P=0.047)是此组患者PFS的独立预后因子。而在OS组中,没有发现具有独立预测作用的因子。
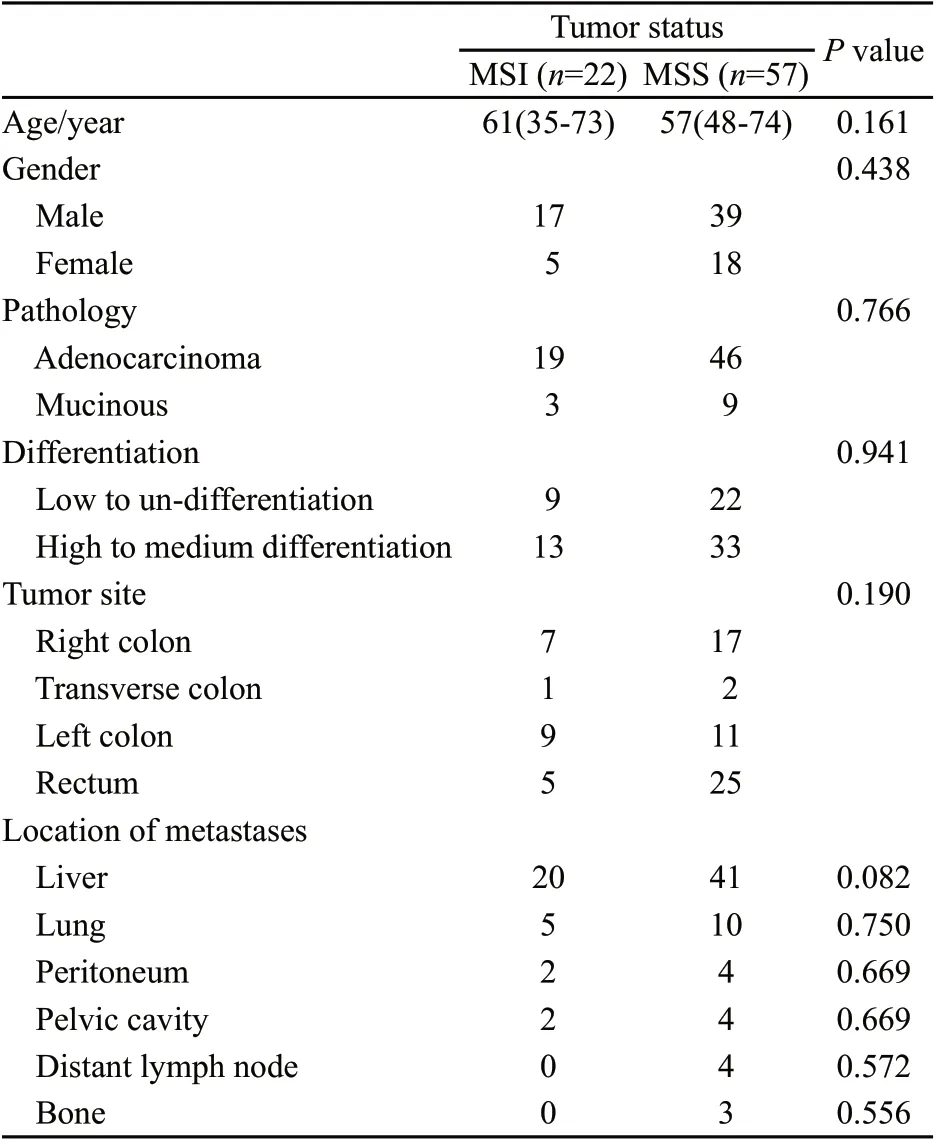
表1 79例同期远处转移且行姑息性手术患者临床特征比较Tab. 1 Clinical characteristics of 79 patients with synchronous metastatic colorectal cancer and palliative tumor resection
2.4 化疗疗效
所有患者均可评价疗效。无一例患者出现CR。113例患者中(表3),MSI组化疗总有效率(PR)11.4%,疾病控制率(PR+SD)51.4%;MSS组总有效率7.7%,疾病控制率41.0%。两组总有效率(P=0.562)及疾病控制率(P=0.303)差异均无统计学意义。
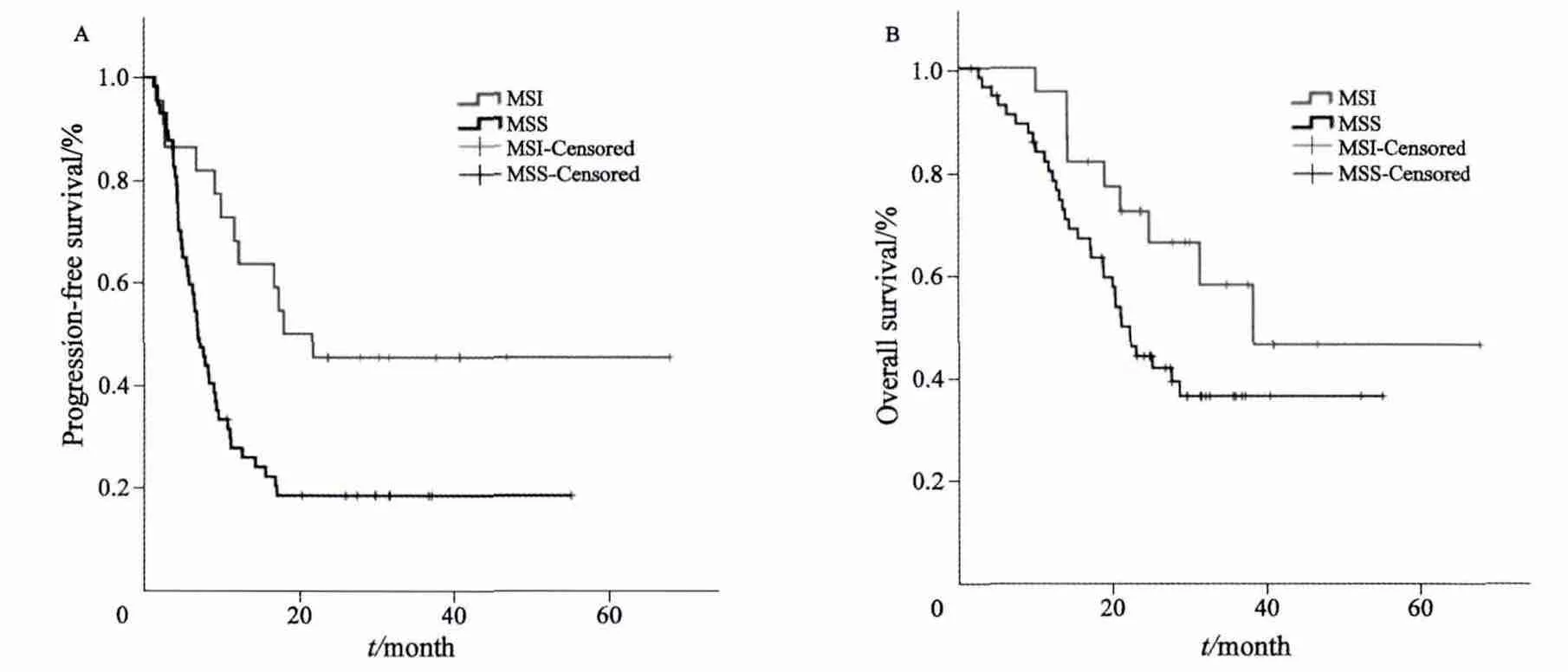
图2 79例患者MSI及MSS的生存曲线Fig. 2 Kaplan-Meier curves for survival of 79 patients with synchronous metastatic colorectal cancer and palliative tumor resection stratifi ed by microsatellite status
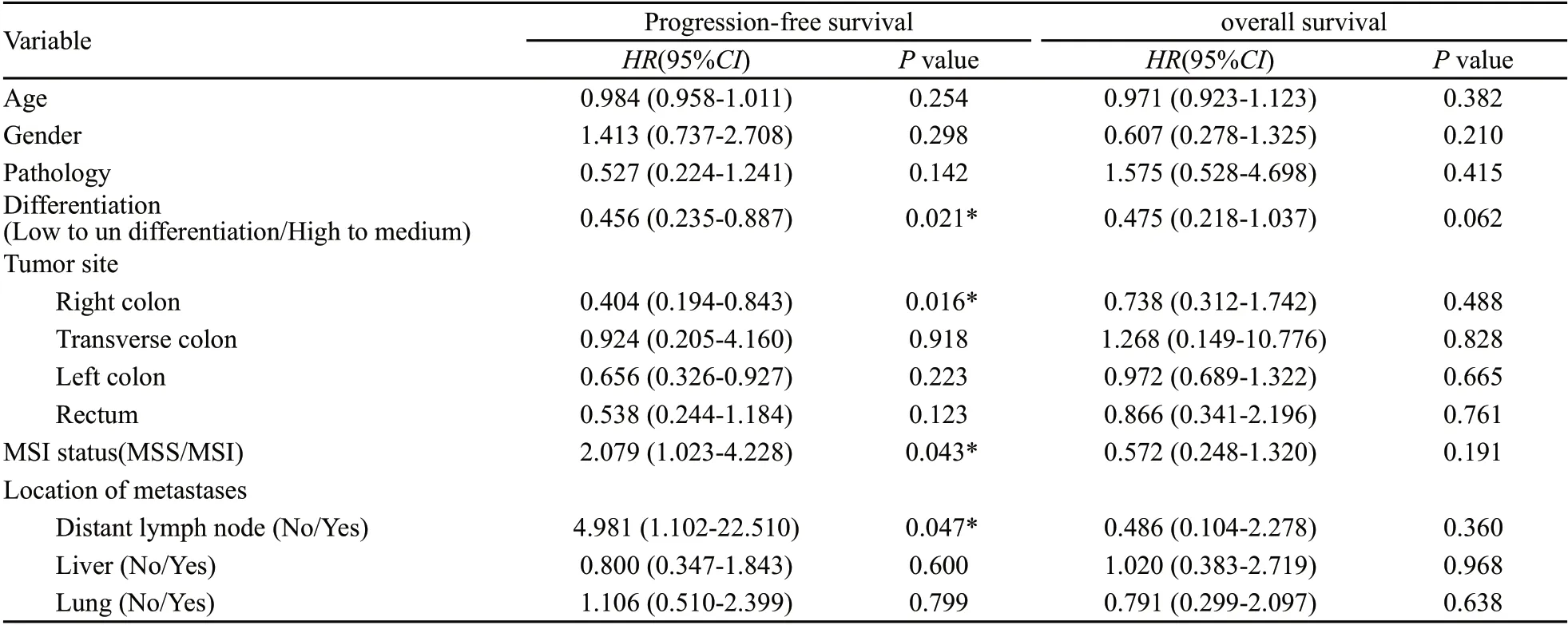
表2 多因素分析Tab. 2 Cox multivariate analysis
在同时性远处转移且原发灶姑息性切除的79例患者中(表4),MSI组PR 2例,SD 11例,PD 9例,总有效率9.1%,疾病控制率59.1%;MSS组PR 3例,SD 15例,PD 39例,总有效率5.3%,疾病控制率31.6%。在比较两组化疗反应时,我们发现MSI 组的化疗总反应率好于MSS组,差异无统计学意义(P=0.08)。MSI组的疾病控制率高于MSS组。差异有统计学意义(P=0.025)。
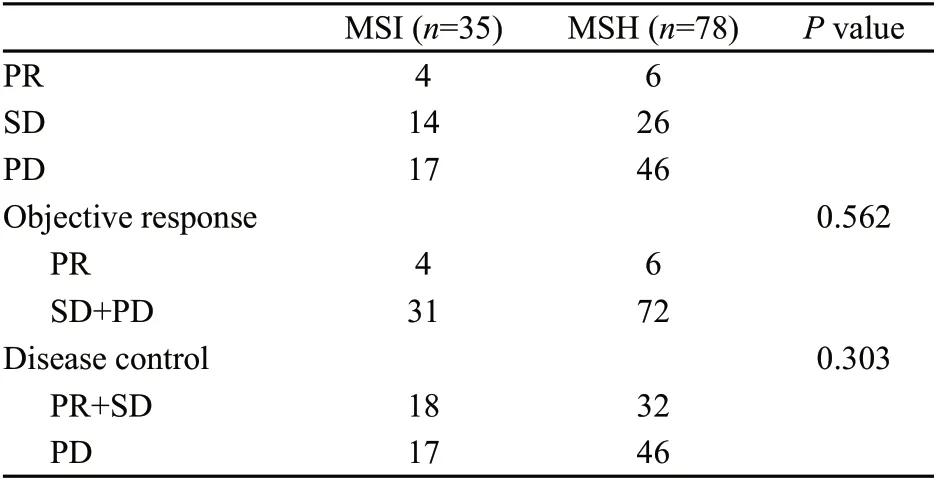
表3 113例患者化疗反应比较Tab. 3 Treatment response in correlation to MSI status of 113 patients
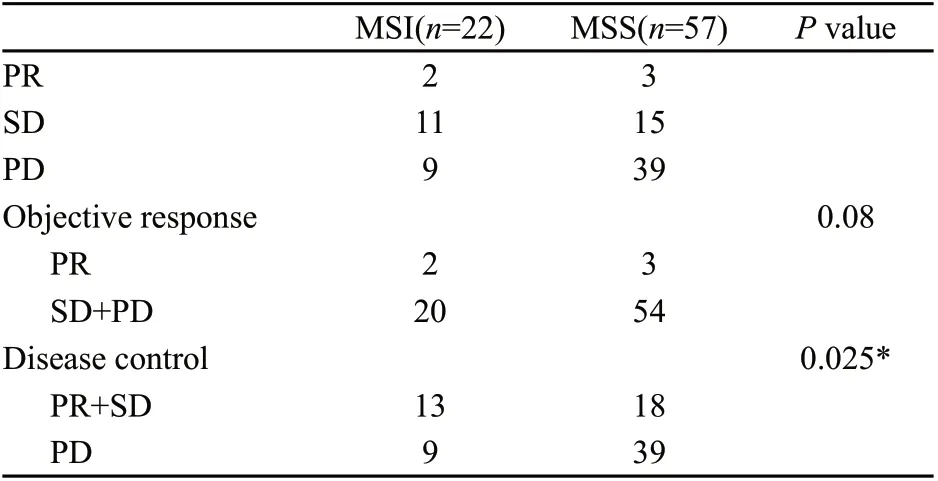
表4 79例初治及姑息手术患者化疗反应比较Tab. 4 Treatment response in correlation to MSI status of 79 patients
3 讨 论
以往研究中微卫星不稳的晚期肠癌患者的中位生存时间存在较大差异,且微卫星不稳定状态对患者预后的影响仍存在争议。Des Guetz等[16]的Meta分析总结认为MSI患者中位生存时间为9~33个月,且MSI对晚期肠癌患者总生存时间及化疗反应无影响。本研究全部113例晚期结直肠癌患者,其中位生存时间为23.5个月,其中MSI患者中位生存时间为24.5个月。MSI患者化疗反应相对于MSS患者差异无统计学意义。以上结果与上述研究基本相符。但是,上述报道未分类研究外科治疗和化疗具体方案方案,并且未严格控制患者纳入标准,因而缺乏一定准确性。
为此,我们进一步优化入组标准,选择其中病程及治疗可控,且人数最多的组,即同期远处转移且原发灶姑息手术治疗的患者组,进行进一步分析。本研究结果发现,虽然此组中MSI患者与MSS患者的OS差异无统计学意义,但MSI患者中位无进展生存期为19.9个月,而MSS患者中位无进展生存期仅7个月。PFS差异有统计学意义(P=0.005)。此外,在多因素分析中,MSI仍可作为PFS的独立预测指标。由此可见,同期远处转移且采用姑息手术治疗的患者中MSI者有更好的PFS,如此巨大的差异在以往的研究中未见报道。
在针对5-FU为基准的化疗中,有关MSI晚期肠癌是否有更好化疗反应一直存在争议。Liang等[17]发现对使用高剂量5-FU联合亚叶酸钙(5-FU:2 600 mg/m2;亚叶酸钙:300 mg/m2)后,MSI患者有着更好的化疗反应率(65.7% vs 35.1%,P=0.001)和总体生存时间(24个月 vs 13个月,P=0.000 1)。同时,这一结果也被Brueckl等[18]证实。但在,以奥沙利铂联合5-FU作为一线化疗药物的其他研究中,MSI患者并未取得更好的化疗反应。Des Guetz等[19]首次报道了MSI对基于FOLFOX化疗的44例(其中MSI 9例)晚期结直肠癌患者的治疗作用,结果没有发现MSI患者的化疗反应及预后与MSS组的区别。另外,Müller等[20]也比较了MSI对采用FOLFOX或XELOX为一线化疗的晚期结直肠癌中的影响(其中MSI 4例),并在分析化疗反应时发现,MSS的患者其疾病控制率(CR+PR+SD)明显优于MSI组(P=0.019),且MSI对PFS和OS依旧没有预测作用。但不容忽视的是,由于MSI在晚期结直肠癌中发生率很低[21],这两项研究普遍存在MSI患者过少的问题,也未对患者的手术治疗方式等因素进行分组讨论,因而有一定的偏倚。本研究中,我们纳入更多MSI患者,并首次对同时性远处转移且原发灶姑息性切除并使用奥沙利铂联合5-FU作为一线化疗方案的患者的MSI状态进行讨论,不仅发现了MSI可作为独立预测患者PFS的影响因子,还发现了MSI患者有着更好的疾病控制率。
综上所述,我们发现对于同时性远处转移且原发灶姑息性切除的这一类患者,在基于奥沙利铂联合5-FU为基础的化疗中,MSI患者比MSS患者拥有更好的PFS及疾病控制率,且MSI可以作为独立的预测PFS因素。
[1]CHEN W, ZHENG R, ZHANG S, et al. Report of cancer incidence and mortality in China, 2010 [J]. Ann Transl Med, 2014, 2(7): 61.
[2]SALTZ L. Systemic therapy for metastatic colorectal cancer [J]. J Natl Compr Canc Netw, 2013, 11(5 Suppl): 649-652.
[3]DUVAL A, HAMELIN R. Mutations at coding repeat sequences in mismatch repair-deficient human cancers: toward a new concept of target genes for instability [J]. Cancer Res, 2002, 62(9): 2447-2454.
[4]LOTHE R A, PELTOMAKI P, MELING G I, et al. Genomic instability in colorectal cancer: relationship to clinicopathological variables and family history [J]. Cancer Res, 1993, 53(24): 5849-5852.
[5]BOLAND C R, THIBODEAU S N, HAMILTON S R, et al. A National Cancer Institute Workshop on Microsatellite Instability for cancer detection and familial predisposition: development of international criteria for the determination of microsatellite instability in colorectal cancer [J]. Cancer Res, 1998, 58(22): 5248-5257.
[6]UMAR A, BOLAND C R, TERDIMAN J P, et al. Revised bethesda guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability [J]. J Natl Cancer Inst, 2004, 96(4): 261-268.
[7]LINDOR N M, BURGART L J, LEONTOVICH O, et al. Immunohistochemistry versus microsatellite instability testing in phenotyping colorectal tumors [J]. J Clin Oncol, 2002, 20(4): 1043-1048.
[8]POPAT S, HUBNER R, HOULSTON R S. Systematic review of microsatellite instability and colorectal cancer prognosis [J]. J Clin Oncol, 2005, 23(3): 609-618.
[9]JASS J R, DO K A, SIMMS L A, et al. Morphology of sporadic colorectal cancer with DNA replication errors [J]. Gut, 1998, 42(5): 673-679.
[10]HEMMINKI A, MECKLIN J P, JARVINEN H, et al. Microsatellite instability is a favorable prognostic indicator in patients with colorectal cancer receiving chemotherapy [J]. Gastroenterology, 2000, 119(4): 921-928.
[11]ELSALEH H, JOSEPH D, GRIEU F, et al. Association of tumour site and sex with survival benefit from adjuvant chemotherapy in colorectal cancer [J]. Lancet, 2000, 355(9217): 1745-1750.
[12]RIBIC C M, SARGENT D J, MOORE M J, et al. Tumor microsatellite-instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for colon cancer [J]. N Engl J Med, 2003, 349(3): 247-257.
[13]CARETHERS J M, SMITH E J, BEHLING C A, et al. Use of 5-fluorouracil and survival in patients with microsatelliteunstable colorectal cancer [J]. Gastroenterology, 2004, 126(2): 394-401.
[14]JOVER R, ZAPATER P, CASTELLS A, et al. Mismatch repair status in the prediction of benefit from adjuvant fluorouracil chemotherapy in colorectal cancer [J]. Gut, 2006, 55(6): 848-855.
[15]BENATTI P, GAFA R, BARANA D, et al. Microsatellite instability and colorectal cancer prognosis [J]. Clin Cancer Res, 2005, 11(23): 8332-8340.
[16]DES GUETZ G, UZZAN B, NICOLAS P, et al. Microsatellite instability does not predict the efficacy of chemotherapy in metastatic colorectal cancer. A systematic review and metaanalysis [J]. Anticancer Res, 2009, 29(5): 1615-1620.
[17]LIANG J T, HUANG K C, LAI H S, et al. High-frequency microsatellite instability predicts better chemosensitivity to high-dose 5-fluorouracil plus leucovorin chemotherapy for stage Ⅳ sporadic colorectal cancer after palliative bowel resection [J]. Int J Cancer, 2002, 101(6): 519-525.
[18]BRUECKL W M, MOESCH C, BRABLETZ T, et al. Relationship between microsatellite instability, response and survival in palliative patients with colorectal cancer undergoing first-line chemotherapy [J]. Anticancer Res, 2003, 23(2C): 1773-1777.
[19]DES GUETZ G, MARIANI P, CUCHEROUSSET J, et al. Microsatellite instability and sensitivitiy to FOLFOX treatment in metastatic colorectal cancer [J]. Anticancer Res, 2007, 27(4C): 2715-2719.
[20]MüLLER C I, SCHULMANN K, REINACHER-SCHICK A, et al. Predictive and prognostic value of microsatellite instability in patients with advanced colorectal cancer treated with a fluoropyrimidine and oxaliplatin containing first-line chemotherapy. A report of the AIO Colorectal Study Group [J]. Int J Colorectal Dis, 2008, 23(11): 1033-1039.
[21]GRYFE R, KIM H, HSIEH E T, et al. Tumor microsatellite instability and clinical outcome in young patients with colorectal cancer [J]. N Engl J Med, 2000, 342(2): 69-77.
