丹参酮ⅡA磺酸钠注射液与复方氨基酸(18AA)注射液的配伍稳定性研究
2015-12-05马超
马 超
丹参酮ⅡA磺酸钠注射液与复方氨基酸(18AA)注射液的配伍稳定性研究
马 超
(赣州市人民医院药剂科,江西,赣州 341100)
目的 对丹参酮ⅡA磺酸钠注射液与复方氨基酸(18AA)注射液配伍稳定性进行实验研究。方法 模拟临床浓度和使用方法,研究两种药物配伍后的pH值变化、配伍后的含量变化。结果 配伍后各项结果均无明显变化。结论 丹参酮ⅡA磺酸钠注射液可与复方氨基酸(18AA)注射液可以配伍。
丹参酮ⅡA磺酸钠;复方氨基酸(18AA)注射液;配伍稳定
丹参酮ⅡA磺酸钠广泛应用于心脑血管疾病的治疗,具有活血化瘀,改善微循环的作用[1]。而复方氨基酸(18AA)注射液为18种氨基酸与山梨醇配制而成的灭菌水溶液,用于大面积创伤、严重感染、消化系统功能障碍、营养恶化及免疫功能下降患者的营养支持,临床实践中有时需要同时使用丹参酮和复方氨基酸注射液,但是目前尚未有相关两种药物配伍的资料,为保证临床使用安全,我们对丹参酮ⅡA磺酸钠与复方氨基酸(18AA)注射液配伍稳定性进行研究,现报道如下。
1 仪器与试药
1.1 仪器
Waters510型高效液相色谱仪(美国Waters);Waters486紫外检测器;N2000色谱工作站(江西创新信息工程有限公司);KQ-100E数控超声波清洗器(南通市精工仪器有限公司);pHS-3C酸度计(上海雷磁仪器厂)。
1.2 试药
丹参酮ⅡA磺酸钠对照品(中国药品生物制品检定所提供,批号:21597-201416);复方氨基酸(18AA)注射液(500 mL,四川科伦,pH5.6,批号51550);丹参酮ⅡA磺酸钠注射液(上海第一生化药业有限公司,规格:10 mg:2 mL,批号31267,pH6.5);甲醇、乙腈为色谱纯;磷酸为分析纯;水为纯化水。
2 方法与结果
2.1 配伍后外观及pH值变化观察
根据临床用法与用量配制药液:丹参酮ⅡA磺酸钠注射液20 mg溶于复方氨基酸(18AA)注射液500 mL中,制得药液,在室温条件下,分别在0,1,2,4,6 h按中国药典[2]进行目视观察及不溶性微粒检查,同时测定各组溶液的pH值,每个样本连测3次,取平均值。结果:两组混合液在整个观察期间内透明澄清,无颜色变化,均未见结晶、沉淀,外观无任何变化。pH值的变化见表1。
2.2 含量变化考察
2.2.1 溶液配制
2.2.1.1 对照品溶液
取丹参酮ⅡA磺酸钠对照品40 mg,置于250 mL量瓶中,加水溶解并稀释至刻度。
2.2.1.2 空白样品溶液
取复方氨基酸(18AA)注射液为空白溶液。
2.2.1.3 样品溶液
以复方氨基酸(18AA)注射液为溶媒模拟临床实际应用,将丹参酮ⅡA磺酸钠80 mg注射液加入500 mL中,精密配制溶液。
2.2.2 含量测定条件[3]
2.2.2.1 色谱条件
色谱柱:ODS C18柱(150 mm × 4.6 mm,5 μm);流动相:甲醇-乙腈-水-磷酸(250:30:250:0.2);流速:1 mL·min-1;检测波长:254 nm;温度:25 ℃;进样量:20 μL;AUFS:0.02。
2.2.2.2 系统适应性试验
分别取对照品溶液、供试品溶液、空白样品溶液各20 μL进样,以丹参酮的峰记记录色谱图(图1),色谱柱的理论塔板数为1944,分离度为2.6。
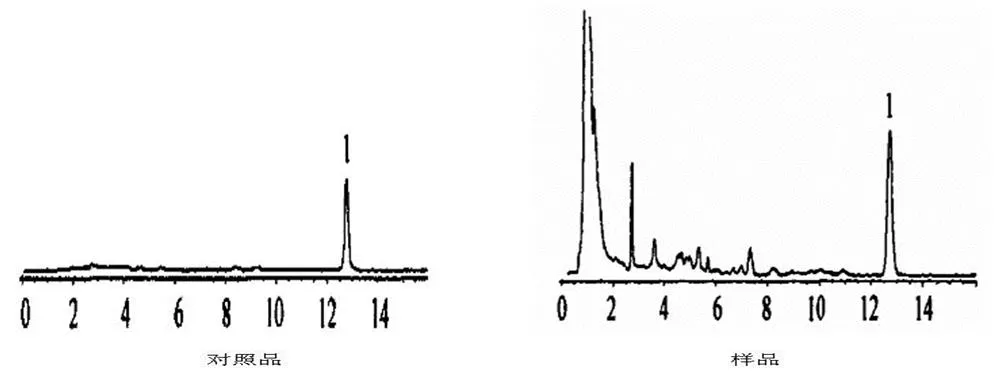
1. 丹参酮ⅡA磺酸钠
图1 丹参酮的HPLC色谱图(t/min)
Fig.1 HPLC chromatogran of tanshinone
2.2.2.3 线性关系考察
分别精密吸取“2.2.1.1”项下的对照品溶液适量,加灭菌注射用水分别配成系列浓度的丹参酮ⅡA磺酸钠溶液。按“2.2.2.1”项下色谱条件测定,记录峰面积,以质量浓度(X)为横坐标,以峰面积(Y)为纵坐标,经回归计算,线性关系良好,其线性关系范围分别为50~654 μg/mL,回归方程为Y=12.86X+ 0.994 × 4213(r = 0.9991,n = 6)。
2.2.2.4 精密度试验
分别精密吸取“2.2.1.1”项下的丹参酮ⅡA磺酸钠对照品溶液1.0,1.5,2.0 mL。置于5 mL量瓶中各3份,流动相定容,配成低、中、高3个浓度,按上述色谱条件连续进行测定6次,峰面积积分RSD结果分别为0.70%、0.84%、0.87%。
2.2.2.5 回收率试验
取复方氨基酸(18AA)注射液5 mL 10份,置于10 mL量瓶中,其中9份加入丹参酮ⅡA磺酸钠对照品溶液0.5,1.0,1.5 mL各3份,所有10份溶液均加水至10 mL,精密量取2 mL至50 mL量瓶中,用流动相稀释至50 mL摇匀。在上述色谱条件下分别测定,取平均值,计算回收率,结果两种药液3个浓度的平均回收率和RSD分别为101.06%和1.56%、100.99%和1.66%、100.98%和1.06%。
2.2.3 含量测定
分别精密取“2.1”项下溶液于室温下放置,用流动相稀释1倍后得浓度约为0.3 mg/mL的配伍液按0,1,2,4,6 h分别取适量样品测定,按“2.2.2.1”色谱条件,进行测定。将峰面积代入回归方程,计算各时间点溶媒中丹参酮ⅡA磺酸钠的含量。以配伍即刻(0 h)的含量为100%,计算各时间点的丹参酮ⅡA磺酸钠的相对含量,每一样品进样3针取平均值,结果见表1。

表1 含量测定及pH测定结果(20 ± 1℃,n = 3)
3 讨论
有文献报道丹参酮ⅡA磺酸钠注射液与临床使用的五种溶媒可配伍,比如5%葡萄糖注射液、10%葡萄糖注射液、0.9%氯化钠注射液、葡萄糖氯化钠注射液、低分子右旋糖酐注射液、5%木糖醇注射液等配伍后,24 h内含量、pH值和性状均无明显改变,不溶性微粒的增加符合《中国药典》规定,薄层色谱鉴别中也无新斑点产生[4-8]。复方氨基酸注射液与头孢匹胺、康艾等存在配伍禁忌[9-10],但尚未有复方氨基酸注射液与上述两种药物的配伍稳定性的相关研究。本研究根据临床常用量进行配伍实验,在(20 ± 1) ℃、自然光照射下观察到配伍后外观、pH、均符合药典相关规定,配伍后6 h内药物含量变化极小,提示在临床混合配伍使用情况下未见两者化学反应和结构改变以及含量变化,表明两种药物可以在6 h内配伍使用,但本研究仅考察了在常温下6 h内的稳定性,对其在非常温下及更长时间内的配伍尚待作进一步考察。
本研究仅对外观和pH值、含量等相关指标进行了测定,对药典要求的其他相关检测项目尚待进一步考察。
本研究提示临床配伍问题多在实际工作中发生,需要医务工作者加强用药后的巡回检查,对疑似配伍禁忌问题发生时需要及时采取有效措施,并对发生的问题进行总结、回顾、分析、研究,以期为临床用药提供安全指导服务。
[1] 梁勇,羊裔明,袁淑兰.丹参酮药理作用及临床应用研究进展[J].中草药,2000,31(4):304.
[2] 中国药典委员会.中国药典(二部) [M].北京:化学化工出版社,2010:68-69.
[3] 余驰,殷丹,陈科力,熊婕.高效液相色谱法测滇丹参中丹参酮ⅡA的含量[J].中国医院药学杂志,2007,27[12]: 1786-1788.
[4] 任汝仙,李雅琴.丹参酮ⅡA磺酸钠注射液与4种输液配伍的稳定性考察[J].中国药业,2012,21(13):4-6.
[5] 毕莉.丹参酮ⅡA磺酸钠注射液在不同pH值输液中的稳定性[J].健康必读,2012(8):94-96.
[6] 王丰伟,涂安娜.丹参酮ⅡA磺酸钠注射液配伍稳定性考察[J].海峡药学,2010(22):4-6.
[7] 王艳宁,高桂娥. 丹参酮ⅡA磺酸钠注射液与5种输液配伍的稳定性研究[J].广西中医学院学报,2006,9(1): 31-34.
[8] 蒋雪嫣.复方丹参注射液与45种药物配伍的稳定性考察[J].中医药临床杂志,2005,17(5):16-17.
[9] 白雪莲.复方氨基酸注射液(18AA)与注射用头孢匹胺钠存在配伍禁忌[J].中华现代护理杂志,2009, 15(24):14-15.
[10] 丁莹.康艾和复方氨基酸注射液存在配伍禁忌[J].中国实用护理杂志,2010,26(20):31-33.
COMPATIBILITY STABILITY BETWEEN SULFOTANSHINONE SODIUM INJECTION AND COMPOUND AMINO ACID INJECTION (18AA)
MA Chao
(Pharmacy Department, The People’s Hospital of Ganzhou, Ganzhou, Jiangxi 341100, China)
Objective: To research the compatibility stability between sulfotanshinone sodium injection and compound amino acid injection (18AA). Methods: Simulating clinical concentration and the using method, the pH change, content change were investigated after compatibility of two kinds of drugs compatibility. Results: All the results have no obvious changes after the compatibility. Conclusion: The two drugs have injection compatibility.
sulfotanshinone sodium injection; compound amino acid injection (18AA); compatibility stability
1674-8085(2015)04-0090-03
R969.3
A
10.3969/j.issn.1674-8085.2015.04.019
2015-03-16;修改日期:2015-06-26
马 超(1984-),男,江西赣州人,主管药师,硕士,主要从事临床药学研究工作(Email:mcaei@163.com).
