13C CP/MAS NMR光谱法分析烟草果胶的含量和结构
2015-12-04刘百战郑赛晶高芸朱晓兰
刘百战,郑赛晶,高芸, 朱晓兰
1 上海烟草集团有限责任公司烟草行业卷烟烟气重点实验室, 上海, 200082;2 中国科学技术大学烟草与健康研究中心,合肥, 230052
烟草与烟气化学
13C CP/MAS NMR光谱法分析烟草果胶的含量和结构
刘百战1,郑赛晶1,高芸2, 朱晓兰2
1 上海烟草集团有限责任公司烟草行业卷烟烟气重点实验室, 上海, 200082;2 中国科学技术大学烟草与健康研究中心,合肥, 230052
采用CP/MAS13C NMR光谱法分析烟草果胶的含量和结构。对烟草果胶进行了优化提取后,再对其13C NMR光谱图C-6吸收峰区域进行了详细研究,用于计算果胶中半乳糖醛酸(GalA)、甲酯度(DM)和乙酰度(DA)的含量,并就建立的定量方法与经典的色谱法和重量法进行了比较。结果表明,CP/MAS13C NMR光谱法测定烟草样品中果胶的含量是可靠的,化学位移和峰面积可用来计算烟草果胶分子的组成、甲酯度和乙酰度,同步实现烟草中果胶的含量和结构分析。
烟草;果胶;NMR光谱;结构分析
果胶是植物所特有的细胞壁组分,属于多糖类碳氢化合物。烤烟烟叶中果胶含量一般可达6%~7%[1]。果胶是亲水胶体物质,对烟叶的吸湿性和弹性有一定的作用。果胶含量高的烟叶,对空气湿度的变化较敏感。空气相对湿度高时,烟叶吸湿变软,甚至导致起热、发霉;空气相对湿度低时,烟叶变硬变脆,容易破碎[2]。
对于烟草吸味质量来说,果胶质是一种不利的化学成分。果胶发酵生成多达1%~1.5%的乙酸,乙酸有辛辣和刺激味。果胶质在燃吸过程中可产生甲醇,甲醇再进一步氧化为甲醛、甲酸等成分,不仅会给烟气带来刺激性,而且不利于吸烟的安全性,同时较高的果胶质含量还会导致卷烟焦油量升高。因此,烟草中果胶含量的测定已成为烟草品质评价重要指标之一[3]。烟草中的果胶的测定常用EDTA提取果胶, 然后用重量法、容量法测定, 或者将果胶水解成半乳糖醛酸后用咔唑显色测定[4]。2010年行业以离子色谱法[5]作为测定烟草果胶的标准方法,采用酸化后使用果胶酶分别酶解酸化液和残渣,酶解液通过离子交换分离后,电化学检测器定量测定半乳糖醛酸。这些方法大多操作比较繁琐,且都需要进行酸解或酶解,对烟草中果胶的结构没有涉及,对果胶结构中的甲酯化度和乙酰度也鲜有研究[6]。
交叉极化结合魔角旋转13C核磁共振法(CP/MAS13C NMR)技术由于能够直接采用固体粉末定量地估计其化学组成和化学结构,对其组分不必进行分离和溶解等处理就可以直接测定而获得可靠的结构信息,已经成为研究高分子化合物化学结构和物理性质最重要的工具之一[7-8]。溶液核磁虽然具有高灵敏度,对于果胶分子而言,虽溶于水,但其溶液粘度非常大,这限制了溶液核磁的使用[7]。本研究采用交叉极化结合魔角旋转13C 固态核磁共振法结合光谱拟合技术研究建立烟草中果胶大分子的分析检测新方法,分析果胶大分子的微观结构,对于进一步研究其对烟草的吸湿性能的影响,改善烟叶的评吸质量,提高烟叶和烟梗的使用价值,降低生产成本,具有重要应用价值和现实意义。
1 材料与方法
1.1 仪器、试剂与材料
HHS11- 2 恒温水浴锅、定时电动搅拌器、JA2003 电子天平、101- 1 型烘箱、PHS3C 型精密pH计、FZ102 型植物粉碎机。硫酸铁铵、活性炭、硫酸铝钾、盐酸、氨水、无水乙醇、硫酸铝, 均为分析纯。由0.2 mol/ L硫酸铁铵和饱和硫酸铝钾溶液组成混合盐溶液。
仪器:AVANCE AV 400 spectrometer超导傅立叶数字化核磁共振谱仪(瑞士布鲁克)。
不同类型的烟样经40℃烘4小时后粉碎而得。聚半乳糖醛酸(PGA)、聚半乳糖醛酸钠(PGASS)和六甲苯(HMB)购自上海百灵威化学品公司,果胶酸钠、果胶样品及其衍生物用于样品分析。
1.2 果胶的提取及纯化[9]
称取10 g 烟末放入烧杯中, 加水100 mL超声30 min, 抽滤, 用温度小于40℃的温水洗涤2 次,洗去果渣中的可溶性糖分及部分色素类物质。取滤渣置于烧杯中, 加入稀硫酸溶液,调pH 值后, 在一定温度下搅拌萃取一段时间, 抽滤。提取液用1 M NaOH溶液调节pH值(3.5),接着用1:1乙醇沉降后离心,再依次用纯乙醇、丙酮和乙醇分别洗涤和沉降后,40℃真空干燥恒重后研磨成粉末,过100目筛,-20 ℃保存备用。
1.3 果胶含量的测定
水分含量的测定是在110 ℃干燥24h,果胶的得率均以烟叶干重计算。果胶中聚半乳糖醛酸含量的测定是采用CP/MAS13C NMR光谱分析。一级定标用四甲基硅烷(CH3)4Si。13C CP/MAS NMR光谱化学位移、光谱峰面积及在δ166-190ppm的分解峰形拟合的计算是采用MestReNova 6.1.1核磁软件进行分析,峰形分解的结果用来计算果胶的组成、甲酯度和乙酰度。
2 结果与讨论
2.1 CP/MAS 13C NMR仪器参数条件的优化
果胶中聚半乳糖醛酸含量的测定是采用CP/MAS13C NMR光谱分析。实验中对测试条件进行了优化,最终确立了条件:场强9.40 T,4 mm魔角探头,转速15 kHz,脉冲宽度90°,交叉极化时间4 µs,接触时间2 ms,采样时间34 ms,采样间隔时间2.0 s,扫描次数:1024,谱宽300 ppm,一级定标用四甲基硅烷(CH3)4Si。
在优化好的仪器实验参数条件下,以聚半乳糖醛酸标准样品测定果胶样品的核磁共振波谱。如图1所示,化学位移δ172 ppm处对应的为果胶分子中C-6区。该峰的位置稳定、干扰少、峰面积与果胶分子中的聚半乳糖醛酸及其衍生物(COOH、COO-&COOCH3)的存在量呈良好的线性关系,可实现烟草样品中果胶的固态定量分析[10]。对果胶分子13C CP/MAS NMR光谱图中的吸收峰所对应的化学位移归属如表1示。表中STD2是购自Sigma.公司的柠檬果胶制备的聚半乳糖醛酸钠盐,聚半乳糖醛酸的含量超过75 %,与STD1(PGA)相比,纯度略低。样品1和样品2 均为从烟草中提取的果胶样品。
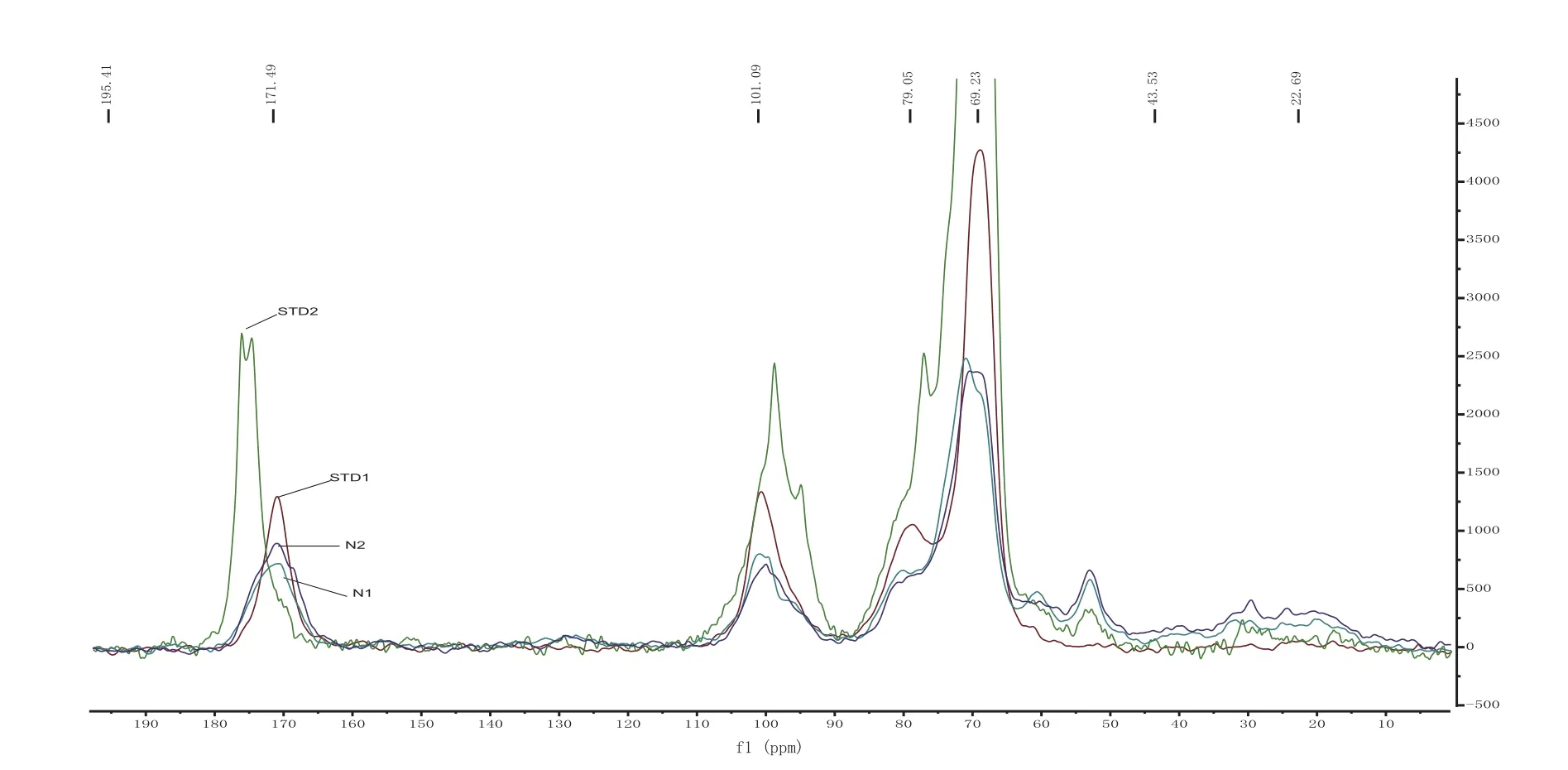
图1 . 聚半乳糖醛酸、聚半乳糖醛酸钠和烟草提取果胶样品的13C CP/MAS NMR光谱图Fig.1 13C CP/MAS NMR spectra of PGA, PGASS and pectin samples extracted from tobacco
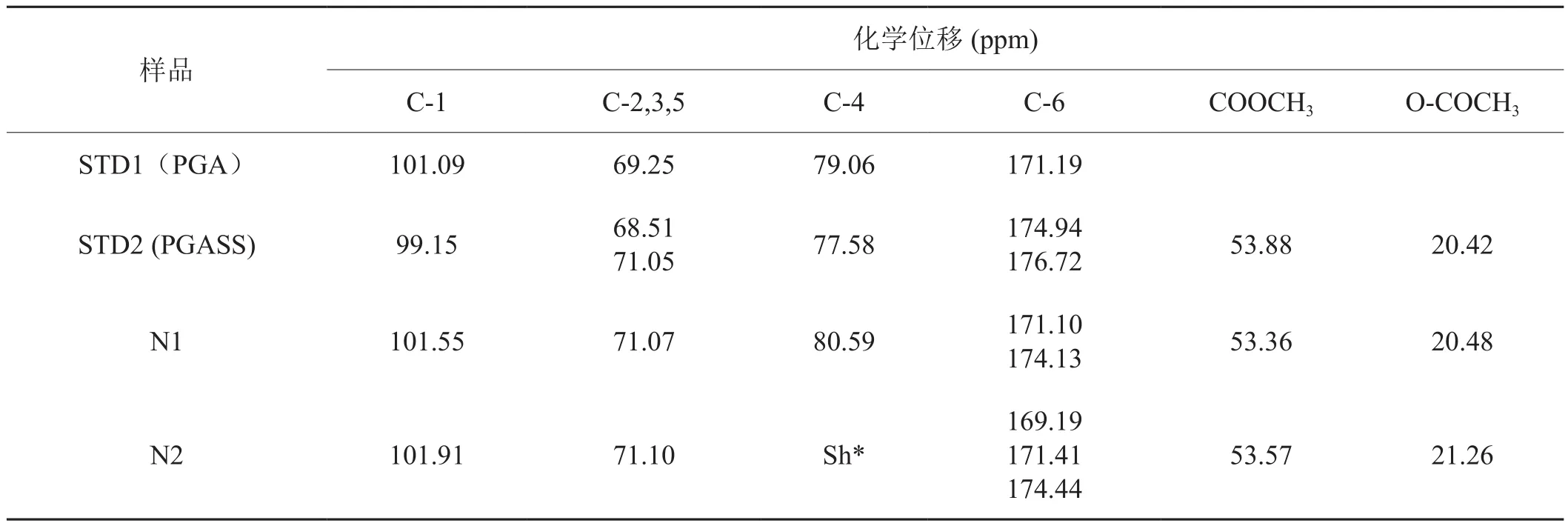
表1 果胶分子CP/MAS 13C NMR光谱的化学位移归属Tab. 1 CP/MAS 13C NMR chemical shifts (in ppm) for polygalacturonic acid and pectins.
2.2 果胶的提取条件的优化
果胶的提取过程对果胶的得率和最终果胶分子聚半乳糖醛酸的含量及结构都有深刻的影响[11],因此,提取条件的优化也是果胶分析中关键性因素,通常果胶可以用冷水/热水、缓冲溶液、冷/热的螯合试剂、热稀酸或稀碱液等从植物的细胞壁中提取分离,采用热酸提取果胶的产率最高,也是工业上最方便的提取方法之一[12]。实验中采用了正交实验方案对酸提取烟草果胶的主要条件(pH 值,温度和时间)进行了优化,各条件下果胶的得率和样品中聚半乳糖醛酸的含量如表2所示。
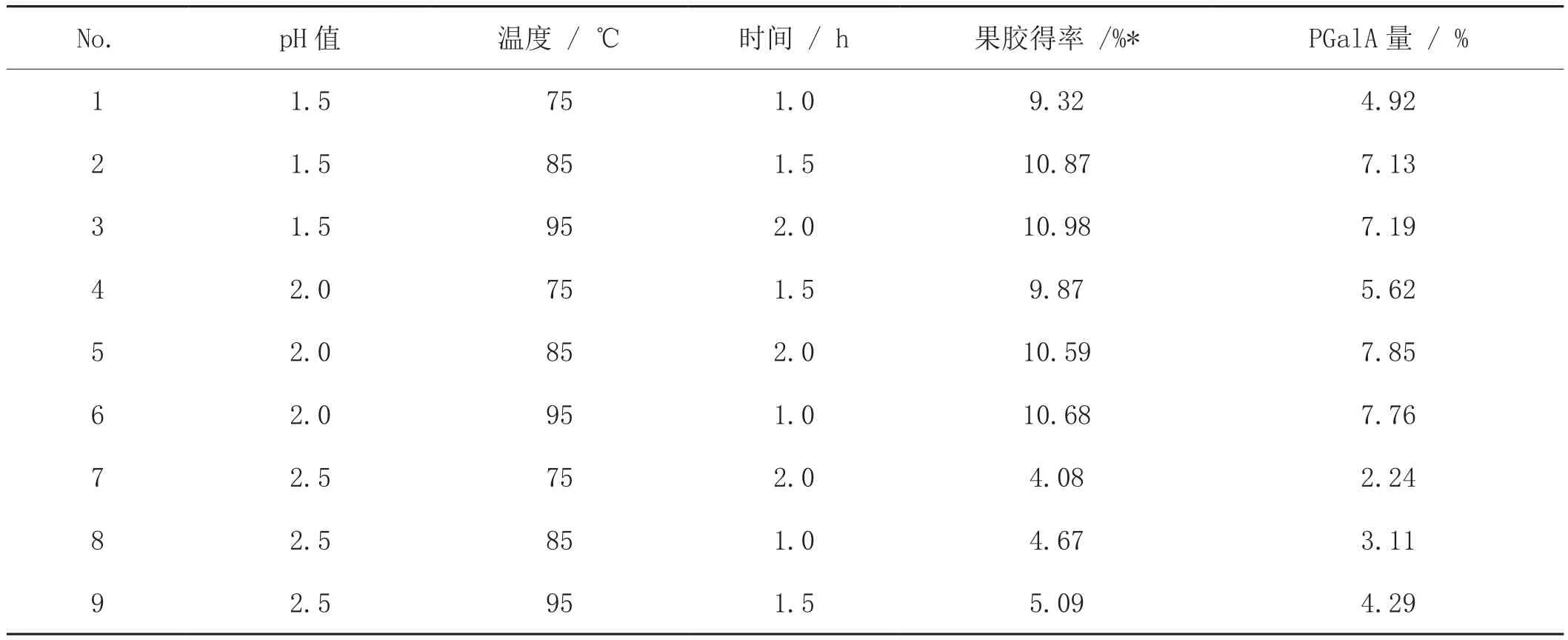
表2 酸提取条件(pH 值、温度和时间)对果胶得率和纯度的影响Tab. 2 Effect of pH value, temperature and heating time on the average recovery of pectin yields and purity from acid extraction tobacco sample (n = 3 )
以各项条件下的果胶得率和果胶分子中聚半乳糖醛酸的含量的三次水平分别求平均值后对应于各条件和水平作图如图2所示。从图中可见,不同pH值对提取的果胶的得率有显著影响,在pH值范围为1.5—2.5,果胶的平均产率差别较大,为4.61%—10.38 %(%w/w)。在酸性较弱(pH 2.5)时,可能会有部分果胶不能被完全水解,果胶的产率最低。随酸强度的增加果胶产率增加,但是高酸度也有可能会使杂质(如纤维素、半纤维素等)在酸性条件下发生水解造成得率的提高[13],并不代表果胶的纯度高,实际上pH 值为2,提取的果胶中聚半乳糖醛酸的含量明显比pH为1.5时高。温度对果胶的提取率有明显影响,温度越高,果胶的得率越高,同时果胶中聚半乳糖醛酸的含量也越高[14]。如图所示,95℃提取的果胶中聚半乳糖醛酸的含量总比85℃和75℃高,但也有文献[15]表明,水解温度超过90℃以上,也会造成部分果胶水解。时间对果胶的提取率的影响没有前两项因素那样明显,时间延长到1.0 h以上,果胶的提取率增加速度减缓,长时间维持在酸性条件下也会使果胶的得率和酯化度下降。因此,综合考虑酸提取烟草果胶的主要条件为pH 值2.0,温度85℃和时间1.5h,在此条件下,测定的烟草样品中果胶的含量为7.91%(以聚半乳糖醛酸计)。
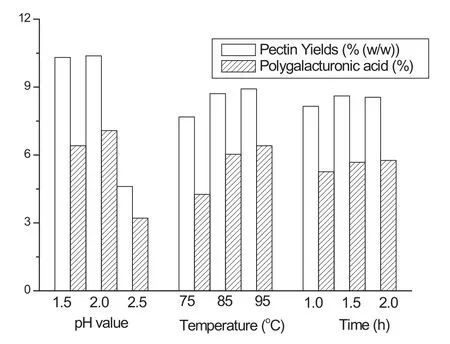
图2 酸解主要条件(pH 值,温度和时间)对果胶得率和纯度的影响Fig. 2 Effects of pH value, temperature and time on the yield and purity of pectin in tobacco acid hydrolysis
2.3 烟草果胶定量方法评价
采用稀酸提取烟草果胶,制备得CP/MAS13C NMR光谱分析的烟草果胶样品。考虑到内标添加的包合性及放置位置的重现性不好会严重影响NMR光谱信号的强度,实验中选择了外标法定量[16]。在优化好的仪器实验参数条件下,称取系列聚半乳糖醛酸标准样品(10-80 mg,装不满时以NaCl固体装填,并与样品混匀),装入4 mm魔角探头,制备相应的13C NMR谱,以C-6δ166-177 ppm区积分面积与样品中聚半乳糖醛酸含量建立线性关系,具体方程为A=645.39×m-339.28 (R2=0.9996),显示果胶分子中的聚半乳糖醛酸的质量在测定范围内线性良好,因此由果胶样品13C NMR光谱中δ(166-177 ppm)吸收峰面积得出聚半乳糖醛酸量,换算出果胶含量。
为验证13C CP/MAS NMR光谱方法的准确性,实验中对两种烟草样品提取的果胶样品采用聚半乳糖醛酸标准样品分两种份量添加后进行13C CP/MAS NMR光谱分析,每样重复测定聚半乳糖醛酸含量三次,以验证方法的精密度和准确度,具体结果见表3中1# 和2#所示。结果表明,两种样品中烟草果胶的平均回收率为97.3 %,相对标准偏差(RSD)为3.0 %~4.2 %,表明本方法准确性好、精密度高。实验中以NMR光谱图S/N=3和S/N=10时计算果胶样品的检出限和定量下限分别为0.42 mg/g和1.27 mg/g。
为验证前处理及整个定量方法的准确性,实验中还在烟草果胶提取过程中添加了已知果胶含量(8.46 %)标准烟草样品2 g和6 g,与烟草样品合在一起共10 g进行随后的酸解和纯化过程,最后进行13C CP/MAS NMR光谱分析果胶样品的聚半乳糖醛酸,每个样测定三次,计算整个过程的平均回收率和相对标准偏差如表3中3# 和4# 所示,结果显示两种样品中烟草果胶的平均回收率为92.5%,相对标准偏差(RSD)为4.4 %—4.9 %,表明整个定量方法准确性好,精密度满足分析要求。
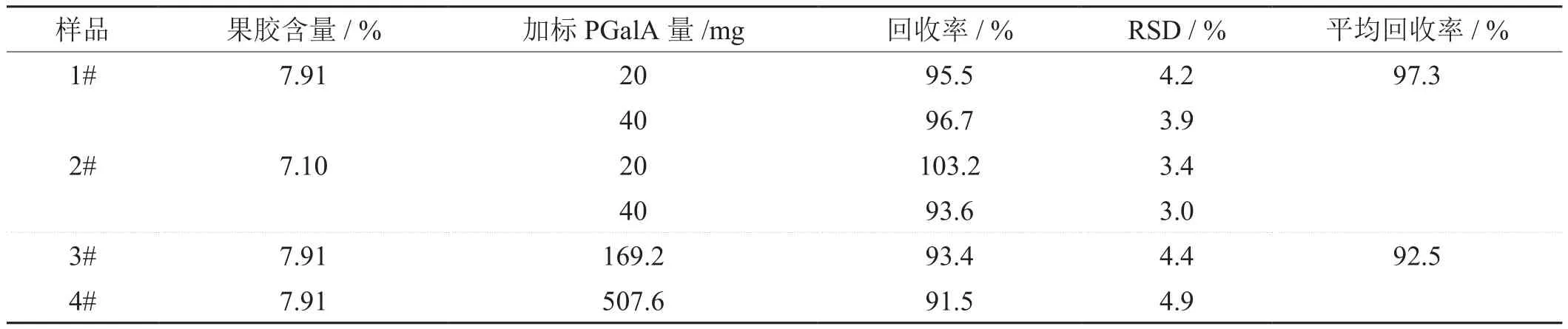
表3 烟草果胶样品添加PGalA标样和标准烟样的回收率和重复性结果Tab. 3 Recovery and repetition data for pectin added with PGalA and standard tobacco samples
2.4 烟草果胶分子结构的测定
2.4.1 果胶分子中果胶酸和果胶酯酸的组成及比例
烟草果胶CP/MAS13C NMR光谱中,对应于果胶的三种组成形式,δ169-178 ppm处对应的果胶C-6信号峰可分解为三种不同位移的谱线[10],如图3所示:(a) 果胶酸:COOH, —171 ppm;(b)果胶酸甲酯:COOCH3,—174 ppm;(c)果胶酸盐:COO-,—176 ppm。根据提取时酸度的不同,果胶酸盐和果胶酸不同时存在,但与果胶酸酯同时存在。对C6信号峰(δ169-178 ppm)拟合,利用混合洛仑兹和高斯函数模型并借助DWIN-NMR软件完成拟合过程,实现δ169-178 ppm处对应的果胶C-6信号峰的分析和分解(如图3),可得出果胶分子中果胶酸和果胶酯酸的组成及比例。
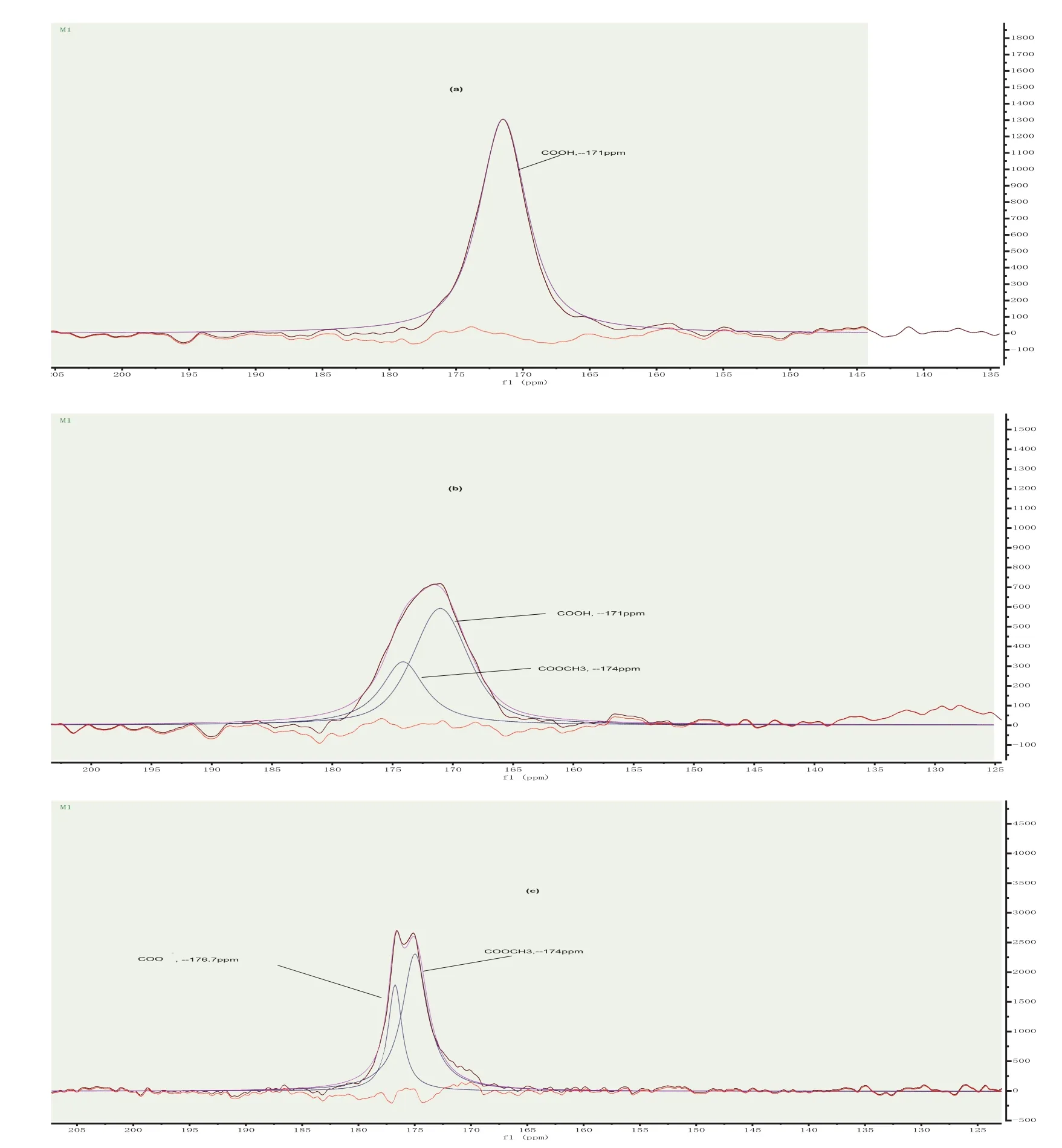
图3 果胶分子中13C CP/MAS NMR C-6信号峰的光谱拟合Fig. 3 Spectral fi tting of 13C CP/MAS NMR C-6 in pectin molecules
2.4.2 果胶分子中甲酯度的计算
果胶结构可以分为以下三种类型:同型半乳糖醛酸聚糖(HG),鼠李半乳糖醛酸聚糖I (RGI)和鼠李半乳糖醛酸聚糖II (RGII)[17]。HG型果胶分子的甲酯度和乙酰度对果胶的性能有直接的影响[18],尤其是果胶的水溶性和凝胶性能,植物果胶的甲酯度在植物生长过程中还影响果胶酶的调节作用。另外,果胶的主链上存在酯基和酰基等功能基团也有利于果胶的改性。如烟草提取的果胶样品图4所示,在其光谱峰C-6区(δ166-180ppm)有聚半乳糖醛酸和其甲酯(-COOH和-COOCH3) 同时存在,另外在δ53 ppm也有很强的-COOCH3吸收,这说明烟草果胶样品的甲酯度较高。根据δ169- 178 ppm处对应的果胶C-6信号峰及其分解拟合COOCH3,—174 ppm谱线面积,结合果胶分子中COOCH3(δ50-55 ppm)C信号峰面积,计算出烟草果胶样品中甲酯度。
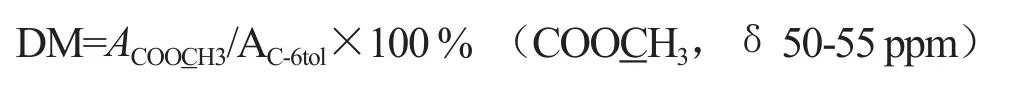
或
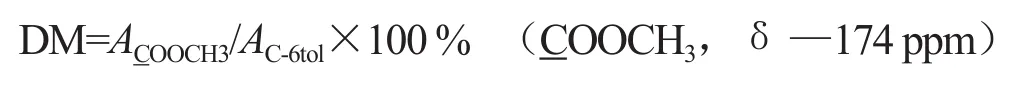
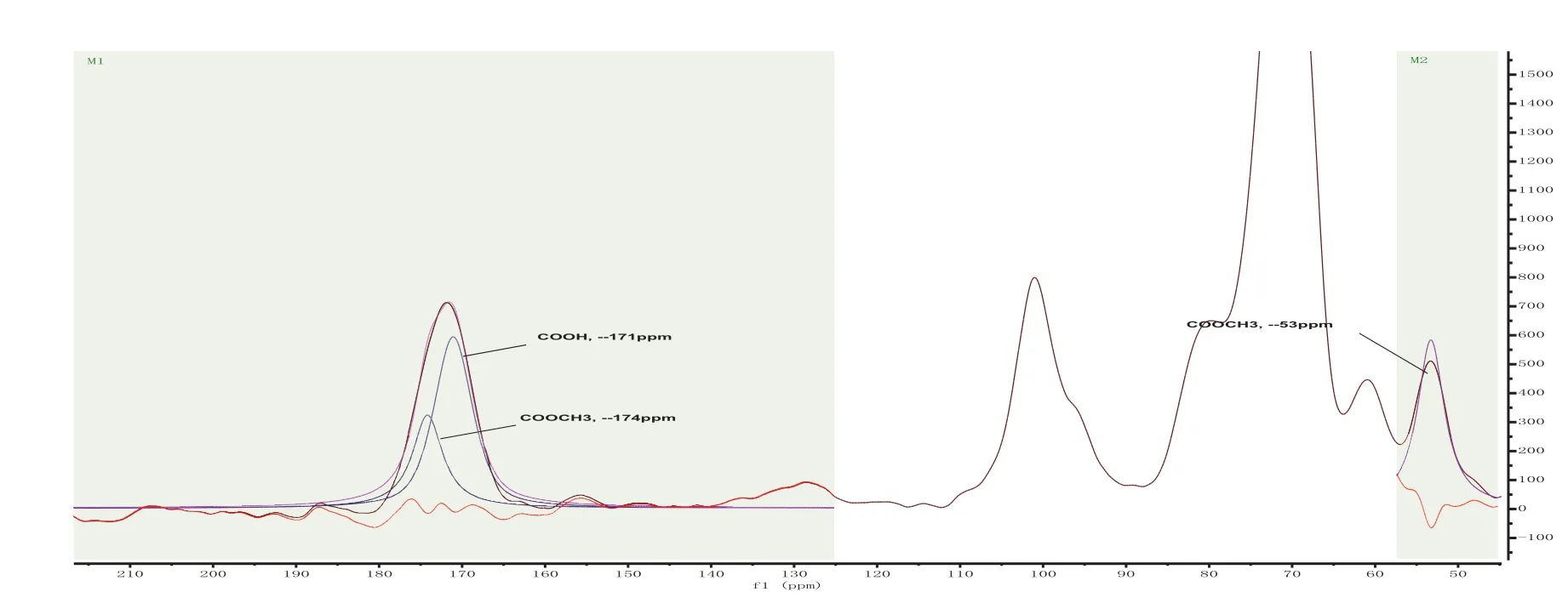
图4 含有甲酯基团的烟草果胶样品13C CP/MAS NMR光谱图Fig. 4 13C CP/MAS NMR spectra of pectin in tobacco samples containing methylester group
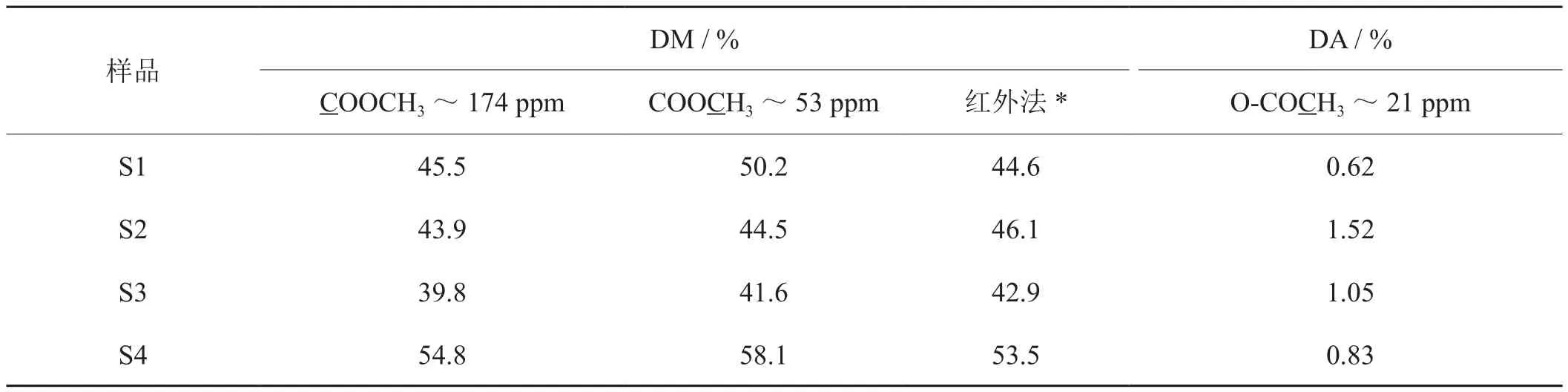
表4 不同方法测定的烟草果胶样品的甲酯化度结果Tab. 4 DM data of pectin in tobacco samples by different methods
此外,实验中还采用红外光谱法测定部分样品的甲酯度[19],结果如表4所示。由表可见,采用C-6信号峰光谱分解拟合计算的样品甲酯度与采用红外光谱法测定的酯化度相当接近,大多数采用果胶分子中COOCH3(δ50-55 ppm)C信号峰面积计算出甲酯度也相一致,个别样品略有出入,这可能是由于13C CP/MAS NMR光谱中由于各个C所处的环境不同,交叉极化的弛豫时间也不一样,采用不同C之间峰面积进行比较,存在一定误差[20]。值得一提的是,由于红外光谱测定的是果胶分子的总酯化度,包括甲酯度和乙酯度,由于烟草果胶中乙酯非常低,因此总酯化度与甲酯度基本一致。
2.4.3 果胶分子中乙酰度的计算
如烟草提取的果胶样品图5所示,在其光谱峰C-6区(δ166-180 ppm)有聚半乳糖醛酸和其酯基同时存在,在δ53 ppm也有很强的-COOCH3吸收,但δ21 ppm处的O-COCH3吸收较弱,这说明了烟草果胶样品的乙酰度较低[21]。根据δ169-178 ppm处对应的果胶C6信号峰,结合果胶分子中O-COCH3(δ20-25 ppm)中C信号峰面积,可计算出烟草果胶样品中乙酰度。
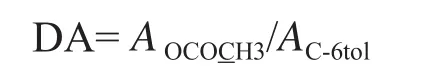
需要说明的是,对于高乙酰度的果胶样品,结果会更准确,低乙酰度误差较大。实验中测定了部分果胶样品的乙酰度,如表4示,均较低。
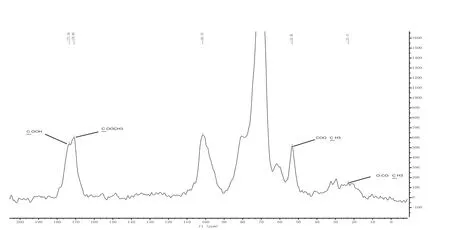
图5 含有甲酯和乙酰基团的烟草果胶样品13C CP/MAS NMR光谱图Fig. 5 13C CP/MAS NMR spectra of pectin in tobacco samples containing methylester and acetyl groups
2.5 不同来源烟草果胶大分子分析
分别用本方法与经典的重量法及现行行业标准方法(水解后进行离子色谱分析)对4种国产不同类型的烟草样品进行了提取和分析,平行测定三次,结果如表5所示。从果胶的含量来看,三种方法测得的结果相差不大,四种不同类型的烟叶果胶的含量范围为7.0-9.8 %之间,重量法结果比NMR光谱法和离子色谱法略高些,可能是少量蛋白质、草酸等杂质引起的[22],另外重量法的平均变异系数RSD > 5%,但NMR光谱法和离子色谱法均低于5 %,说明采用NMR光谱法测定烟草样品中果胶的含量也是可靠的。同时采用13C CP/MAS NMR光谱法不仅可以得到烟草样品中果胶的含量,更为重要的是可以得到果胶的甲酯化度,四种样品中广州晒烟烟叶果胶的甲酯化度最高(53.2 %),湖北白肋烟烟叶果胶的甲酯化度最低(36.6 %),可见不同类型的烟叶果胶的甲酯化度还是有明显差别的。Lauterbach等曾采用热解气相色谱-质谱法测定了各种商业等级调制后的烤烟、白肋烟和香料烟中可溶性果胶的甲基化和酰胺化程度。结果表明,烤烟的可溶性果胶的甲基化和酰胺化程度较高。白肋烟的甲基化程度最低,与本文的结果相一致。另外,虽然采用相同的提取工艺,但是对于不同类型的烟叶样品,果胶的得率相差较大,对提取的果胶纯度也有影响,不过并不影响最终果胶含量的分析。
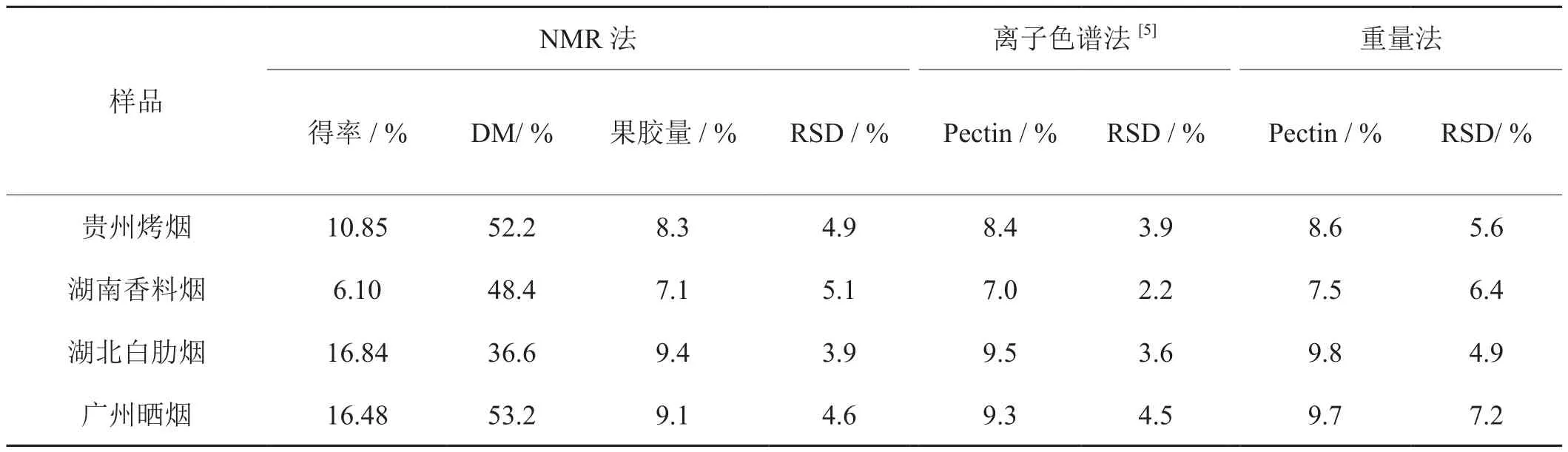
表5 13C CP/MAS NMR光谱法与离子色谱法及重量法分析不同烟草果胶样品结果比较Tab. 5 Analysis of pectin in different tobacco samples by NMR spectra method, ion chromagraphic and gravimetric method (n = 3 )
3 结论
本文针对烟草果胶进行了优化酸提取,再对其CP / MAS13C NMR光谱图C-6吸收峰光谱分析烟草果胶的含量和结构,并与经典方法进行了比较。结果表明,CP / MAS13C NMR光谱法可以同步实现烟草中果胶的含量和结构分析,C-6吸收峰的化学位移和峰面积可用于计算果胶中果胶分子中聚半乳糖醛酸的含量及组成、甲酯度和乙酰度的含量等,并应用于实际烟草样品的分析。
[1]饶巍,庹苏行,钟科军,周冀衡.烟草果胶的提取分析研究进展[J]. 广州化学, 2009, 34(1): 71-76.
[2]任晓红,陈刚,马海燕,等. 烤烟细胞壁物质对烟叶质量影响研究[J].中国农学通报2010,26(4): 113-116.
[3]闫克玉,闫洪洋,李兴波,等. 烤烟烟叶细胞壁物质的对比分析[J].烟草科技,2005, (10): 6-11.
[4]杨海健,丁红营,于国东,等.咔唑比色法测定造纸法再造烟叶中的果胶含量[J].分析实验室,2012, 31(6): 100-102.
[5]YC/T 346-2010 烟草及烟草制品 果胶的测定 离子色谱法.
[6]Jankana B, Noppamas S, Amornrut C, et al. Determination of galacturonic acid from pomelo pectin in term of galactose by HPAEC with fl uorescence detection[J]. Carbohydrate Polymers,2010, 81: 461-465.
[7]Synytsya A, Copikova J, Brus J.13C CP/MAS NMR Spectra of pectins: a Peak-Fitting Analysis in the C-6 Region[J]. 2003,Czech Journal of Food Sciences. 21(1): 1-12.
[8]Husson E, Buchoux S, Avondo C, et al. Enzymatic hydrolysis of ionic liquid-pretreated celluloses: Contribution of CP-MAS13C NMR and SEM[J]. Bioresource Technology, 2011, 102: 7335–7342.
[9]李光水,刘启斌,虞新安. 用混合盐析法从烟末中提取果胶的实验[J]. 烟草科技,2001, (11): 1-20.
[10]Synytsya A, Copikova J, Pavlikova H.13C CP/MAS NMR Spectroscopy in the Analysis of Pectins[J]. 1998, Journal of Carbohydrate Chemistry, 17(2): 279-292.
[11]Georgiev Y, Ognyanov M, Yanakieva I, et al. Isolation,characterization and modi fi cation of citrus pectins[J]. J BioScience Biotechnology, 2012, 1(3): 223-233.
[12]Cho YJ, Hwang JK. Modelling the yield and intrinsic viscosity of pectin in acidic solubilization of apple pomace[J]. 2000, Journal of Food Engineering, 44: 85-89.
[13]Constenla D, Ponce AG, Lozano JE. Effect of pomace drying on apple pectin[J]. Lebensmittel -Wissenschaft und – Technologie,2002, 35: 216-221.
[14]Kalapathy U, Proctor A, Effect of acid extraction and alcohol precipitation conditions on the yield and purity of soy hull pectin[J]. 2001, Food Chemistry 73: 393-396.
[15]Marcon MV, Carneiro PIB, Wosiacki G., et al. Pectins from Apple Pomace – Characterization by13C and 1H NMR Spectroscopy[J].Ann Magn Reson, 2005, 4(3): 56-63.
[16]Smernik RJ, Oades JM. The use of spin counting for determining quantitation in solid state13C NMR spectra of natural organic matter 1. Model systems and the effects of paramagnetic impurities [J]. Geoderma, 2000, 96: 101-129.
[17]Willats W. GT, Knox JP, Mikkelsen J.D. Pectin: new insights into an old polymer are starting to gel [J]. Trends in Food Science &Technology, 2006, 17: 97-104.
[18]Lionetti V, Cervone F, Bellincampi D. Methyl esterification of pectin plays a role during plant-pathogen interactions and affects plant resistance to diseases[J]. Journal of Plant Physiology, 2012,169: 1623-1630.
[19]郑芸,方积年. 测定果胶中甲酯化取代度的方法[J]. 天然产物研究与开发. 2006, 18: 709-712.
[20]Fransen CTM., Laar H, Kamerling JP, et al. CP/MAS NMR analysis of carbohydrate fractions of soybean hulls and endosperm[J]. Carbohydrate Research, 2000, 328: 549- 559.
[21]Garna H, Mabon N, Robert C, et al. Effect of extraction Conditions on the yield and Purity of Apple Pomace Pectin Precipitated but not washed by Alcohol[J]. Journal of Food Science. 2007, 72(1):C1-C9.
[22]任晓红. 烤烟细胞壁物质与烟叶质量的关系. 河南农业大学硕士学位论文,2007:13-16.
Quantitative and structure analysis of pectin in tobacco by13C CP / MAS NMR spectroscopy
LIU Baizhan1, ZHENG Saijing1, GAO Yun2, ZHU Xiaolan2
1 Key Laboratory of Cigarette Smoke Research , China National Tobacco Corporation, Shanghai 200082, China;
2 Research Center of Tobacco and Health, University of Science and Technology of China, Hefei 230052, China
A method utilizing13C CP / MAS NMR spectra was developed for quantitative determination and structure analysis of pectin in tobacco. NMR spectra was employed to measure pectin after the extraction of tobacco samples with acid under optimized condition and was applied to calculate galacturonic acid content (GalA), degree of methylation (DM) and acetylation (DA) by peak fi tting in C-6 region. Results were in good agreement with convenient methods (chromography and gravimetric method) and NMR method could realize quantitative and structure analysis of pectin in tobacco simultaneously.
tobacco; pectin; NMR spectroscopy; structure analysis
:LIU Baizhan, ZHENG Saijing, GAO Yun, et al. Quantitative and structure analysis of pectin in tobacco by13C CP / MAS NMR spectroscopy [J]. Acta Tabacaria Sinica, 2015,21 (2)
刘百战,郑赛晶,高芸,等.13C CP/MAS NMR光谱法分析烟草果胶的含量和结构[J]. 中国烟草学报,2015,21(2)
国家烟草专卖局烟草行业卷烟烟气重点实验室开放基金项目(SZBCW201300708)
刘百战(1965—),博士,高级研究员,主要从事烟草化学与分析研究。
朱晓兰(1972—),博士, E-mail: zxl8906@ustc.edu.cn。
2014-04-03
