沉默JP2基因对小鼠心肌细胞SK2通道的影响*
2015-12-04郭文静樊红琨郑春光张桂红罗天霞
郭文静,樊红琨,郑春光,张桂红,段 萍,杨 阳,罗天霞,章 茜#
1)郑州大学基础医学院生理学教研室 郑州450001 2)河南护理职业学院生理学教研室 安阳455001
Junctophilins(JPs)是偶联细胞膜与细胞内质网离子通道交通的分子基础,并具有膜偶联复合物(junctional membrane complexes,JMCs)特性的一类蛋白[1-2]。已知JPs 存在4种亚型,分别为JP1、JP2、JP3 和JP4。JP2 主要存在于骨骼肌和心肌,敲除JP2 可导致兴奋-收缩失偶联,进而引起心肌和骨骼肌收缩障碍[3-4]。SK 通道是依赖于细胞内Ca2+激活的K+通道,其中SK2 通道存在于心肌细胞膜,包括T 管膜[5]。研究[6]表明SK2 通道参与动作电位复极化过程,与室上性心律失常发生的分子机制相关。作者之前的研究[7]表明细胞内Ca2+稳态可影响SK2 通道的功能。该实验采用RNA 干扰(RNAi)技术研究沉默JP2 基因,观察对新生小鼠心肌细胞(neonatal mouse cardiomyocytes,NMCMs)SK2 通道的影响。
1 材料与方法
1.1 靶向小鼠JP2 的siRNA 慢病毒质粒的构建根据siRNA 的设计原则及文献[8]报道,针对Gen-Bank 中小鼠JP2 基因(NM_001205076.1)的2个不同 位 点(5'-GCCACAATGTGCTGGTCAA-3',5'-GT GATCTTGCTGAA-3'),分别设计2 对靶向JP2 基因并带Age Ⅰ和EcoR Ⅰ酶切位点的DNA 互补序列和RNAi阴性对照(negative control,NC)序 列(5'-TTCTCCGAACGTGTCACGT-3')。经Blast 软件分析确定序列的特异性。上述序列的合成及重组慢病毒质粒(LV-JP2-RNAi-1、LV-JP2-RNAi-2 和LV-NCEGFP)的包装和收获由上海吉凯基因有限公司完成。
1.2 NMCMs 的培养 取出生1~2 d 的昆明小鼠心脏剪碎,37℃低速离心,用含EDTA 的胰蛋白酶(Hyclone 公司)消化,收集细胞悬液,离心,弃上清,用含体积分数20%胎牛血清的DMEM/F12 培养基(美国Gibco 公司)重悬细胞。将细胞悬液接种于35 mm 培养皿,37℃、体积分数5%CO2培养箱孵育90 min。取上清接种于24 孔板,加入5-Brdu 使其终浓度为0.1 mmol/L,37℃、体积分数5%CO2培养箱孵育,36 h 后换液。
1.3 重组慢病毒质粒感染NMCMs 将生长良好、融合至50% 的细胞分为4组,分别转染LV-JP2-RNAi-1、LV-JP2-RNAi-2 和LV-NC-EGFP,以未转染细胞(Ctrl-NC)作对照,48 h 后荧光显微镜观察绿色荧光蛋白(GFP)的表达情况。2.5 g/L 胰蛋白酶消化NMCMs。收集各组细胞,流式细胞仪(美国BD公司)检测感染效率。
1.4 实时荧光定量PCR 检测JP2 mRNA 的表达收集感染48 h 的细胞,采用Trizol 法抽提总RNA,37℃DNase 处理,合成cDNA 第一条链(上海生工生物工程技术服务有限公司)。JP2 基因引物序列:上游5'-CTGGCTATCCTATTTGTTCAC CT-3',下 游5'-GTTTTAGGTCCGAAGTCCCAT-3',产物大小135 bp。内参(GADPH)基因引物序列:上游5'-GGTTGTCTCCTGCGACTTCA-3',下游5'-TGGTCCAGGGTTTCTTACTCC-3',产物大小183 bp。引物由上海生工生物工程技术服务有限公司设计合成。PCR 总反应体系为20 μL。反应条件:95℃2 min;95℃10 s,60℃40 s,40个循环。制备熔解曲线:95℃变性1 min,冷却至55℃,使得DNA 双链充分结合;从55℃起到95℃,每一步增加0.1℃,保持4 s,同时读取吸光度值。实验重复3次。JP2 mRNA 以其与内参基因吸光度比值作为相对表达量。
1.5 Western blot 检测SK2 通道蛋白的表达 收集感染72 h 细胞,-80℃冰箱储存备用。提取各组细胞蛋白,100 g/L SDS-PAGE 分离SK2,电泳,转膜,50 g/L 脱脂牛奶-TBS 室温封闭1 h,加入兔多克隆抗SK2 抗体(1 ∶300 稀释,Alamone labs)或β-actin (1∶600 稀释,美国Sigma 公司),4℃孵育过夜。加入辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000 稀释),室温孵育2 h,ECL 化学发光曝光显影。
1.6 统计学处理 应用SPSS 17.0 对数据进行分析,采用单因素方差分析和SNK-q 检验比较各组间JP2 mRNA 表达的差异,检验水准α=0.05。
2 结果
2.1 重组慢病毒质粒对NMCMs 的感染 NMCMs生长状态良好,形态正常(图1A),倒置荧光显微镜下可见明显的GFP 表达(图1B)。Ctrl-NC组心肌细胞的转染效率为0,LV-JP2-RNAi-1 和LVJP2-RNAi-2组心肌细胞转染效率分别达70% 和80%。

图1 NMCMs 慢病毒质粒转染的观察(×10)
2.2 各组细胞JP2 mRNA 水平 见表1。
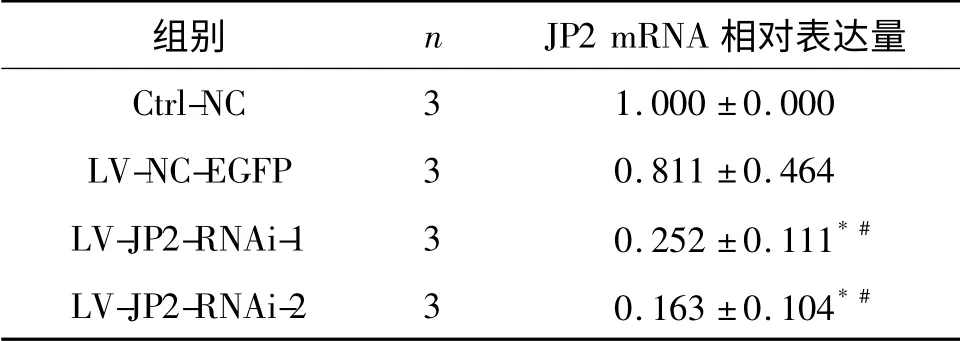
表1 各组细胞JP2 mRNA 表达水平
2.3 各组细胞SK2 通道蛋白的表达 与Ctrl-NC及LV-NC-EGFP组细胞比较,LV-JP2-RNAi-2组细胞SK2 通道蛋白的表达明显被抑制,见图2。

图2 各组细胞SK2 通道蛋白的表达
3 讨论
在心肌细胞,由T 管膜和肌质网膜形成二联体膜偶联复合物,后者是实现心肌兴奋-收缩偶联的重要结构基质[9]。SK2 通道表达于心肌细胞膜,包括T 管膜,细胞内Ca2+浓度的变化是激活SK 通道的惟一因素[10]。JP2 功能异常可影响细胞膜表面离子通道与细胞内Ca2+的偶联,直接影响心肌或骨骼肌兴奋-收缩偶联过程,导致收缩障碍,如果敲除JP2,动物将于胚胎期死亡[11-12]。
RNAi 是一种序列特异性的、由双链RNA 诱导的基因沉默现象,siRNA 可以在细胞中持续抑制靶基因的表达,持续数周甚至更久,具有经济、快捷、高效等显著优势,成为RNAi 研究的首选方法[13]。该实验构建靶向JP2 的siRNA 慢病毒载体,流式细胞仪检测结果表明它可在心肌细胞内有效表达。该研究将该慢病毒载体转染至NMCMs,可有效地沉默心肌细胞JP2 mRNA 表达,并可抑制小鼠心肌细胞SK2 通道的表达。
总之,该实验结果为深入研究JP 与SK 通道在小鼠心肌动作电位中的作用及分子机制奠定了基础。
[1]Takeshima H,Komazaki S,Nishi M,et al.Junctophilins:a novel family of junctional membrane complex proteins[J].Mol Cell,2000,6(1):11
[2]Garbino A,Van Oort RJ,Disit SK,et al.Moleculad evolution of the junctophilin gene family[J].Physiol Genomics,2009,37(3):175
[3]Ito K,Komazaki S,Sasamoto K,et al.Deficiency of triad junction and contraction in mutant skeletal muscle lacking junctophilin type 1[J].J Cell Biol,2001,154(5):1059
[4]Chopra N,Yang T,Asghari P,et al.Ablation of triadin causes loss of cardiac Ca2+release units,impaired excitationcontraction coupling,and cardiac arrhythmias[J].Proc Natl Acad Sci U S A,2009,106(18):7636
[5]Lu L,Zhang Q,Timofeyev V,et al.Molecular coupling of a Ca2+-activated K++channel to L-type Ca2+channels via alpha-actinin2[J].Circ Res,2007,100(1):112
[6]Zhang Q,Timofeyev V,Lu L,et al.Functional roles of a Ca2+-activated K++channels in atrioventricular node[J].Circ Res,2008,102(4):465
[7]Mu YH,Zhao WC,Duan P,et al.RyR2 modulates a Ca2+-activated K++current in mouse cardiac myocytes[J].PLoS One,2014,9(4):e94905
[8]Lee EH,Cherednichenko G,Pessah IN,et al.Functional coupling between TRPC3 and RyR1 regulates the expressions of key triadic proteins[J].J Biochem,2006,281(15):10042
[9]Han J,Wu H,Wang Q,et al.Morphogenesis of T-tubules in heart cells:the role of junctophilin-2[J].Life Sci,2013,56(7):647
[10]Xu YF,Tuteja D,Zhang Z,et al.Molecular identification and functional roles of a Ca2+-activated K++channel in human and mouse hearts[J].J Biol Chem,2003,278(49):49085
[11]Van Oort RJ,Garbino A,Wang W,et al.Disrupted junctional membrane complexes and hyperactive ryanodine receptors after acute junctophilin knockdown in mice[J].Circulation,2011,123(9):979
[12]Jayasinghe ID,Baddeley D,Kong CH,et al.Nanoscale organization of junctophilin-2 and ryanodine receptors within peripheral couplings of rat ventricular cardiomyocytes[J].Biophys J,2012,102(5):L9
[13]Wiedenheft B,Sternberg SH,Doudna JA.RNA-guided genetic silencing systems in bacteria and archaea[J].Nature,2012,482(7385):331
