微拟球藻 I型脂酰辅酶 A: 二脂酰甘油酰基转移酶编码基因NoDGAT1A的功能分析
2015-12-02路延笃
辛 一 , 路延笃 徐 健
(1. 中国科学院 青岛生物能源与过程研究所 单细胞中心, 山东 青岛 266101; 2. 中国科学院大学, 北京100049)
微藻是一类在自然界中分布广泛的光合单细胞生物的总称[1]。在逆境胁迫时, 许多微藻可在胞内大量积累三脂酰甘油(triacylglycerol, TAG), 因此, 开发微藻产油被视作未来生物能源的一个重要发展方向[2]。目前,该领域主要侧重于优良藻种的选育, 但对微藻合成TAG的代谢和调控机制仍然了解得不够全面。
在高等动、植物中, TAG生物合成的研究较为深入, Kennedy途径是其中最重要的合成途径之一[3],根据组学分析和功能基因鉴定可知, 该途径也在微藻TAG的合成中发挥重要作用[4]。在Kennedy途径中, 三个脂酰辅酶 A依次将脂酰基转移到甘油-3-磷酸上, 最终形成TAG, 脂酰辅酶A: 二脂酰甘油酰基转 移 酶 (acyl-CoA: diacylglycerol acyltransferase,DGAT)作为该途径的限速酶[5], 催化第三个脂酰辅酶A与二酰基甘油(diacylglycerol, DAG)形成TAG。目前共发现三种DGAT亚家族——DGAT1、DGAT2和DGAT3。其中, DGAT1属于膜结合的O-酰基转移酶家族, 含有至少 6个跨膜区[6]。DGAT1在高等植物种子的油脂积累中发挥重要作用, 其表达水平还影响着 TAG的脂肪酸链组成[7]。在三角褐脂藻中,DGAT1对饱和的C16和C18底物具有偏好性, 且利用可变剪切来调节其TAG合成酶的活性[8]。
微拟球藻(Nannochloropsis spp.)是一类单细胞真核微藻, 属于不等鞭毛亚门, 真眼点藻纲, 属内目前已命名6个种[9]。由于其具备含油量较高、生长速度较快等特点, 因而被视为最具工业应用潜力的产油微藻之一[10]。由于微拟球藻在自然界中广泛分布,且位于海洋食物链的起始端, 因此研究其包括 TAG合成在内的碳流分配, 对于理解海洋碳循环也具有重要意义[11]。此外, 微拟球藻还能合成二十碳五烯酸(eicosapentaenoic acid, EPA)等高附加值产品, 在食品及医学等领域具有广泛应用[12]。目前微拟球藻的转录组和脂质组分析提示, I型DGAT的编码基因之一NoDGAT1A在缺氮12 h后表达量上调, 而且许多含有EPA的TAG含量也从此时开始出现显著增长,表明NoDGAT1A可能在合成含有EPA的TAG时发挥重要作用[13-14]。本研究从微拟球藻高产油藻株 N.oceanicaIMET1的cDNA序列中克隆出NoDGAT1A,并将该基因在TAG合成突变的酵母中进行诱导表达,考察NoDGAT1A在TAG合成中的生理功能, 这为构建微藻产油关键基因的功能网络提供了理论依据。
1 材料和方法
1.1 藻种培养与cDNA制备
以优化后的f/2半海水培养基(盐度1.5, 400 mg/L KNO3, 38.5 mg/L NaH2PO4, 12 mg/L FeCl3, 4 mg/L Na2EDTA, 0.9 mg/L MnCl2, 50 μg/L CuSO4, 42 μg/L NaMoO4, 98 μg/L ZnSO4, 44 μg/L CoCl2, 100 μg/L Vitamin B1, 0.5 μg/L Vitamin H, 0.5 μg/L Vitamin B12)在 25℃和 50 μmol/(m2·s)进行培养微拟球藻藻株IMET1。待藻液培养至适宜浓度时, 以水平转速3 000 g离心20 min, 将收集到的藻体与直径0.1~0.2 mm玻璃珠混合, 使用 FastPrep-24快速核酸提取仪以6.5 m/s振荡1 min使细胞破碎, 用HP Plant DNA Kit(Omega)提取DNA。随后, 将冷冻保存的藻体在液氮中充分研磨, 采用 TRIzol (Invitrogen)试剂盒进行总RNA的提取, 再用 PrimeScript RT reagent Kit With gDNA Eraser (Takara)以随机引物合成cDNA[15]。
1.2 NoDGAT1A的克隆与序列分析
利用常规PCR技术从IMET1的cDNA中克隆NoDGAT1A, 并在基因5′端和3′端分别引入酶切位点BamHI和NotI。依据本实验室前期的IMET-1基因组和缺氮诱导产油过程的转录组动态数据[13-14]所设计的 正 向 引 物 为 5′ GGATCCACATAATGTCTAT GCACAAACTGACTCG, 反 向 引 物 为 5′ TGCG GCCGCCTAAAGAGCGCTCT。PCR 反应体系 50 μL,包括 4 μLdNTP (2.5 mmol/L), 正反向引物各 2 μL(10 μmol/L), 5 μL 10×buffer (Mg2+plus), 0.4 μL rTaq酶(5 U/μL, TAKARA), 1 μL cDNA 模板, 以及 35.6 μL超纯水。反应过程如下: 起始94℃预变性3 min, 然后94℃变性30 sec, 55℃退火30 sec, 72℃延伸1 min,30个循环, 最后72℃反应7 min。用Gel Extraction Kit (Omega)从PCR产物中回收目的片段, 连入pMD 18-T 载体(Takara), 并转入大肠杆菌 Trans5α(Transgene)中, 阳性克隆送至Invitrogen公司测序确认后, 于-80℃保存。
氨基酸序列的相似度利用 NCBI中的 Blastp(http: //www.ncbi.nlm.nih.gov/BLAST)进行比较, 采用 在 线 软 件 TMHMM (http: //www.cbs.dtu.dk/services/TMHMM-2.0/)进行疏水性预测分析, 用MEGA4.0[16]分析, 用MEGA4.0[16]重建 DGAT氨基酸序列的邻接树,所有节点的可靠性通过1 000次重抽样分析进行评价。
1.3 酵母表达载体的构建和遗传转化
本课题所用的酵母表达载体 pXJ401是以pYES2.0 (Invitrogen)为骨架构建的, 主要步骤如下:用Plasmid Mini Kit I (Omega)从上述Trans5α转化子中提取质粒后, 在37℃下, 使用NEB公司的限制性内切酶 BamHI和 NotI分别对 pYES2.0和含有NoDGAT1A的pMD18-T载体进行双酶切。从酶切产物中回收目的片段, 再用 T4连接酶 (Thermo)将NoDGAT1A连入 pYES2.0。同时, 将酵母的Ⅱ型DGAT编码基因DGA1连入pYES2.0作为正对照。本研究所采用的营养缺陷型酿酒酵母突变体 H1246由Stymne教授提供[17]。酵母转化采用醋酸锂热激转化法[18], 将得到的单菌落接入SC液体筛选培养基中,置于30℃摇床中培养至平台期, 将PCR检测结果为阳性的菌液于-80℃保存。
1.4 酵母转化子的诱导表达与油脂分析
诱导表达时, 将上述转化子培养至对数期, 再接入含有 2%半乳糖(w/v)的诱导培养基中, 初始OD600值为 0.4, 置于 30℃摇床中培养至平台期。诱导开始时, 向菌液中施加或不施加EPA溶液(过滤除菌, 终浓度90 μmol/L)。酵母油脂的提取参考Bligh和 Dyer发明的氯仿-甲醇法[19]。酵母总脂的薄层层析分离参考 Ghosal的方法[20], 当可观察到清晰的斑点时, 将含有TAG的硅胶点刮下, 并用Agilent气相色谱-四级杆质谱联用仪分析上述 TAG的甲酯化产物。各脂肪酸链的量依据其与内标物(正十九烷酸)的峰面积比值以及各样品中内标物质量进行计算。
2 结果与讨论
2.1 NoDGAT1A的序列特征
根据本课题组的前期工作[13-14], 利用 PCR和3730测序技术, 从 IMET1的 cDNA中得到了NoDGAT1A的全序列。该基因的ORF区全长为1314 bp,共编码437个氨基酸。氨基酸序列的BLAST结果表明, NoDGAT1A与拟南芥 DGAT1的相似度为 38%,而且 NoDGAT1A编码的氨基酸序列中含有MBOAT(membrane bound O-acyltransferase)这一多数DGAT1共有的结构域。TMHMM分析结果表明,NoDGAT1A中至少含有9段高疏水区(图1), 这些高疏水区可能是该蛋白的跨膜区。此外, 在邻接法构建的DGAT进化树(图2)中, NoDGAT1A位于DGAT1分支, 并与硅藻(三角褐脂藻及假微型海链藻)的进化距离较近。由此可知, NoDGAT1A符合Ⅰ型DGAT序列的一般特征。

图1 NoDGAT1A的疏水性分析Fig.1 Hydrophobicity plots of NoDGAT1A (predicted using the TMHMM server)
2.2 NoDGAT1A的TAG合成酶活性
在酿酒酵母 S. cerevisiae中, DGA1、LRO1、ARE1和 ARE2负责其几乎全部 TAG的合成, 鉴于此,Stymne等从野生型酵母菌株SCY62中敲除了上述4个基因, 构建了基本能够正常生长、但无法合成TAG的突变株 H1246[17]。由于该突变株具有清晰的遗传背景和良好的可操作性, 因而被广泛用于 TAG合成通路的研究中[8,21-22]。为了鉴别NoDGAT1A是否具有TAG合成活性, 本研究将NoDGAT1A连接在酵母表达载体pYES2.0上, 转化入酵母突变株H1246中。并以克隆有酵母内源DGAT基因DGA1的pYES2.0作为正对照, 以pYES2.0空载体作为负对照。
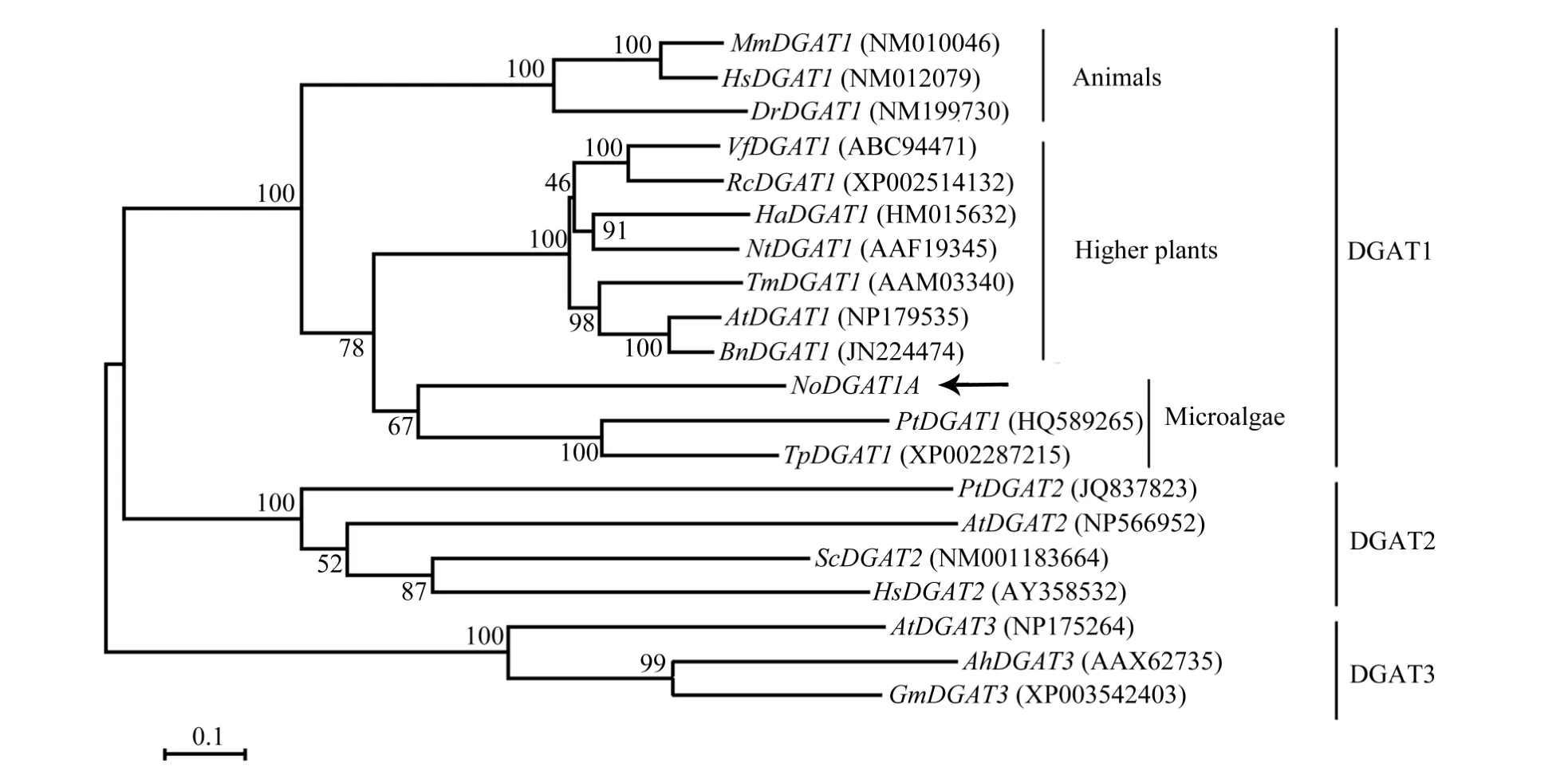
图2 三类DGAT亚家族的邻接树Fig.2 A neighbor-joining phylogram showing relationships among NoDGAT1A and diverse hypothetical and characterized DGAT-like proteins from diatoms, higher plants and animals
EPA是微拟球藻 TAG的重要组分, 而酵母的TAG中不存在 EPA[17]。鉴于此, 本研究向上述三种H1246的转化子中分别加入等量的 EPA底物, 以考察其对NoDGAT1A合成TAG的影响。随后, 将上述六种样品经过诱导表达后, 分别于平台期提取总油脂, 进行薄层层析实验, 由图3可见, 在施加或未施加EPA时, 负对照酵母株均无TAG积累; 正对照酵母株在施加或未施加EPA时, 均积累了明显的TAG点; 而表达有 NoDGAT1A的工程株, 只有在外加EPA的情况下, 才有 TAG产生。该结果提示, NoDGAT1A具备脂酰辅酶A: 二脂酰甘油酰基转移酶活性,且EPA是其合成TAG时所需的底物或诱导物。
2.3 NoDGAT1A的底物偏好性

图3 NoDGAT1A在H1246中的TAG合成酶活性Fig.3 Complementation of the TAG-deficient phenotype of the yeast mutant H1246 by expression of NoDGAT1A, DGA1 or empty pYES2
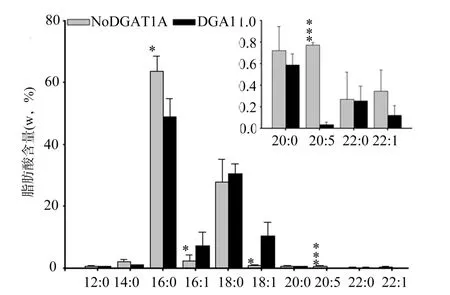
图4 NoDGAT1A与DGA1催化合成的TAG中脂肪酸链的差异比较Fig.4 Comparison of fatty acid contents in TAGs between the H1246 yeast strains that respectively expressed NoDGAT1A and DGA1
为了鉴定NoDGAT1A的脂肪酸底物偏好性, 本研究进一步将上述表达NoDGAT1A或DGA1的工程株产生的TAG样品, 从TLC薄板上分离出来, 并分别进行甲酯化, 再采用GC-MS进行分析。如图4所示, 在NoDGAT1A和DGA1催化合成的TAG中, 16:0和18: 0都是主要的脂肪酸链成分。而与DGA1相比, NoDGAT1A催化合成的TAG含有较多的16: 0和 EPA(20: 5), 尤其是 EPA 的含量远高于 DGA1(P<0.001)。由此可以推测, 微拟球藻TAG中含有的较高含量的EPA, 可能与其DGAT1A的活性有关。
综上所述, NoDGAT1A具有Ⅰ型DGAT的序列特征, 且在EPA诱导下, 可催化TAG合成。与酵母内源DGAT(DGA1)相比, NoDGAT1A催化合成的TAG含有更高比例的EPA, 表明它对其含有EPA的TAG的合成具有一定贡献。由于EPA是微拟球藻油脂的重要组分, 作为一种高值副产品能够提高微藻产油的经济性, 因此, 上述发现对微藻合成EPA和TAG的机制具有一定启示。
[1] Richmond A. Handbook of microalgal culture:Biotechnology and applied phycology[M]. 2004, Oxford:Blackwell.
[2] Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production:perspectives and advances[J]. Plant Journal, 2008,54(4): 621-639.
[3] Kennedy E P, Weiss S B. Function of cytidine coenzymes in the biosynthesis of phospholipides[J]. Journal of Biological Chemistry, 1956, 222(1): 193-213.
[4] Boyle N R, Page M D, Liu B S, et al. Three acyltransferases and nitrogen-responsive regulator are implicated in nitrogen starvation-induced triacylglycerol accumulation in Chlamydomonas[J]. Journal of Biological Chemistry, 2012, 287(19): 15811-15825.
[5] Lung S C, Weselake R J. Diacylglycerol acyltransferase:A key mediator of plant triacylglycerol synthesis[J].Lipids, 2006, 41(12): 1073-1088.
[6] Shockey J M, Gidda S K, Chapital D C, et al. Tung tree DGAT1 and DGAT2 have nonredundant functions in triacylglycerol biosynthesis and are localized to different subdomains of the endoplasmic reticulum[J]. Plant Cell,2006, 18(9): 2294-2313.
[7] Xu J, Francis T, Mietkiewska E, et al. Cloning and characterization of an acyl-CoA-dependent diacylglycerol acyltransferase 1 (DGAT1) gene from Tropaeolum majus, and a study of the functional motifs of the DGAT protein using site-directed mutagenesis to modify enzyme activity and oil content[J]. Plant Biotechnol J, 2008, 6(8): 799-818.
[8] Guiheneuf F, Leu S, Zarka A, et al. Cloning and molecular characterization of a novel acyl-CoA:diacylglycerol acyltransferase 1-like gene (PtDGAT1)from the diatom Phaeodactylum tricornutum[J]. FEBS J, 2011, 278(19): 3651-3666.
[9] Hibberd D J. Notes on the taxonomy and nomenclature of the algal classes Eustigmatophyceae and Tribophyceae(Synonym Xanthophyceae)[J]. Botanical Journal of the Linnean Society, 1981, 82(2): 93-119.
[10] Hu H, Gao K. Optimization of growth and fatty acid composition of a unicellular marine picoplankton,Nannochloropsis sp., with enriched carbon sources[J].Biotechnol Lett, 2003, 25(5): 421-425.
[11] Fogg G E. Some comments on picoplankton and its importance in the pelagic ecosystem[J]. Aquatic Microbial Ecology, 1995, 9(1): 33-39.
[12] Sukenik A. Ecophysiological considerations in the optimization of eicosapentaenoic acid production by Nannochloropsis sp. (Eustigmatophyceae)[J]. Bioresource Technology, 1991, 35(3): 263-269.
[13] Wang D M, Ning K, Li J, et al.Nannochloropsis genomes reveal evolution of microalgal oleaginous traits[J]. Plos Genetics, 2014, 10(1): e1004094.
[14] Li J, Han D, Wang D, et al. Choreography of transcriptomes and lipidomes of Nannochloropsis reveals the mechanisms of oil synthesis in microalgae[J]. Plant Cell, 2014, 26(4): 1645-1665.
[15] Lu Y, Zhou W, Wei L, et al. Regulation of the cholesterol biosynthetic pathway and its integration with fatty acid biosynthesis in the oleaginous microalga Nannochloropsis oceanica[J]. Biotechnol Biofuels, 2014, 80(1): 52-68.
[16] Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0[J]. Mol Biol Evol, 2007, 24(8): 1596-1599.[17] Sandager L, Gustavsson M H, Stahl U, et al. Storage lipid synthesis is non-essential in yeast[J]. Journal of Biological Chemistry, 2002, 277(8): 6478-6482.
[18] Gietz R D, Woods R A. Genetic transformation of yeast[J]. Biotechniques, 2001, 30(4): 816-822.
[19] Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917.
[20] Ghosal A, Banas A, Stahl U, et al. Saccharomyces cerevisiae phospholipid : diacylglycerol acyl transferase(PDAT) devoid of its membrane anchor region is a soluble and active enzyme retaining its substrate specificities[J]. Biochimica Et Biophysica Acta-Molecular and Cell Biology of Lipids, 2007, 1771(12):1457-1463.
[21] Gong Y M, Zhang J P, Guo X J, et al. Identification and characterization of PtDGAT2B, an acyltransferase of the DGAT2 acyl-Coenzyme A: Diacylglycerol acyltransferase family in the diatom Phaeodactylum tricornutum[J]. Febs Letters, 2013, 587(5): 481-487.
[22] Wagner M, Hoppe K, Czabany T, et al. Identification and characterization of an acyl-CoA: diacylglycerol acyltransferase 2 (DGAT2) gene from the microalga O.tauri[J]. Plant Physiology and Biochemistry, 2010,48(6): 407-416.
